基于AMPK/mTOR信号通路的细胞自噬对大鼠肺动脉平滑肌细胞增殖和凋亡的影响*
2022-09-01宋正阳施晓倩田云娜王新雨王肖婷张聪聪王万铁
宋正阳,施晓倩,田云娜,王新雨,张 赛,王肖婷,张聪聪,王万铁△
(1温州医科大学缺血/再灌注损伤研究所,浙江温州 325035;2杭州医学院中医教研室,浙江杭州 310052;3浙江医药高等专科学校药学院,浙江宁波 315000)
低氧高二氧化碳性肺动脉高压(hypoxia-hypercapnia pulmonary hypertension,HHPH)主要包括肺血管收缩、肺血管壁重构和血栓形成三个方面[1]。其中,肺血管收缩和肺血管重构为主要的致病环节[2]。而且,肺血管发生重构后无法逆转。因此,探明HHPH 的发生机制,进而为防治HHPH 提供新的理论依据,是十分重要的研究课题。
研究表明,细胞自噬在肺动脉高压的发生发展中扮演着不可轻视的角色。自噬广泛存在于机体组织中,在饥饿、病理应激或者药物(诸如雷帕霉素)等刺激时,通过降解自身细胞内物质为细胞提供能量[3-4]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是最经典的也是目前研究最多的自噬通路,整合了有关能量、营养状态和生长因子的信号,参与了各种细胞的生长增殖过程。AMP 活化蛋白激酶(AMP-activated protein kinase,AMPK)作为一个重要的能量转换器,直接或者间接调节mTOR 复合体1(mTOR complex 1,mTORC1)活性[5-6]。AMPK/mTOR 信号通路是否参与肺动脉高压的发生发展,其机制又是如何,可以作为HHPH 的一个治疗靶点进行更深入的探讨。
材料和方法
1 细胞与试剂
大鼠PASMCs 购于北京中科质检生物技术有限公司;AMPK 激动剂阿卡地新(acadesine;即5-aminoimidazole-4-carboxamide riboside,AICAR)和AMPK抑制剂dorsomorphin(又称compound C,CC)购于MedChemExpress;兔抗大鼠mTOR、p-mTOR、微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)、p62、AMPK、p-AMPK、caspase-3和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体均购于Cell Signaling Technology;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG 购于Biosharp;CCK-8 试剂盒购于Dojindo;高糖DMEM 培养液、胰酶和胎牛血清均购于Gibco;Beyo-Click™EdU-488 细胞增殖检测试剂盒购于碧云天公司;TUNEL 细胞凋亡检测试剂盒购于翌圣生物科技(上海)股份有限公司。
2 主要方法
2.1 细胞模型制备及分组 PASMCs 长至80%~90%时,用纯高糖DMEM 培养液置于常氧培养箱(21%O2,5%CO2,74%N2,37 ℃)饥饿处理24 h,之后弃去旧培养液并洗涤,随机分为5 组[正常对照(normal control,N)组、模型组(HH 组)、溶剂二甲基亚砜(dimethyl sulfoxide,DMSO)组(D 组)、AICAR 组(AI组)和CC 组],根据不同实验分组加入不同的培养混合液。N 组在常氧箱内培养24 h;HH 组用DMEM 高糖培养液培养,D 组在DMEM 高糖培养液中加入与抑制剂相同比例的DMSO,AI 组在DMEM 高糖培养液中加入1 mmol/L AICAR 溶液,CC 组在DMEM 高糖培养液中加入10µmol/L CC,后4组均置于造模箱内(5%O2,6%CO2,89%N2,37 ℃)培养24 h。
2.2 CCK-8 法检测细胞的活力 取对数生长期的PASMCs 细胞按每孔1×104个细胞数接种于96 孔板(每组3~6 个复孔),按以上分组造模结束后,弃去培养液并用PBS洗涤,每孔加入110µL CCK-8混合液,37 ℃常氧培养箱孵育1 h 后,用酶标仪测定450 nm处吸光度(absorbance,A),取每组平均值,实验重复3 次。细胞相对活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
2.3 5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)法检测细胞增殖情况 取对数期生长的细胞接种于24 孔板,造模处理后,每孔加300 µL 工作液和等比例培养液,37 ℃孵育2h,去除培养液加1 mL 固定液(4%多聚甲醛),洗3 次,每次5 min;每孔加1 mL通透液,室温15 min,PBS洗3次,每次5 min;每孔加100 µL click 反应液,避光孵育30 min,洗3次,每次5 min;每孔200µL 1×Hoechest 33342,避光孵育10 min,洗3 次,每次5 min。封片后用倒置显微镜进行观察。
2.4 TUNEL 检测细胞凋亡情况 将细胞悬液接种在24 孔板1 cm×1 cm 的玻片上,待细胞贴壁后,饥饿过夜,随后进行不同处理。造模结束后,吸弃培养液,PBS 清洗,加入4%多聚甲醛于4 ℃固定25 min。按TUNEL 细胞凋亡试剂盒的说明书进行实验,最后使用倒置显微镜进行拍照观察,计算TUNEL 阳性细胞占总细胞的比例。
2.5 qPCR 法检测PASMCs 中LC3、p62 和caspase-3的mRNA 表达水平 造模结束的细胞去除培养液洗涤后,10 cm培养液加入1 mL Trizol,祛酶移液枪头刮取细胞,加入1/5 体积氯仿,上下颠倒混匀,静置15 min。4 ℃、12 000 r/min 离心25 min。吸取上层水相(约300 µL),随后加等体积异丙醇使RNA 沉淀,弃上清同时加75%乙醇使沉淀悬浮,再次离心收集RNA。测完RNA 浓度后,进行cDNA 合成和gDNA 去除及qPCR体系与条件的操作,所得结果以2-ΔΔCt法计算mRNA相对表达量。引物序列见表1。

表1 引物序列Table 1.Sequences of the primers
2.6 Western blot 检测PASMCs 中AMPK、p-AMPK、mTOR、p-mTOR、LC3、p62、caspase-3 和PCNA 蛋白水平 取造模结束的细胞置于冰上,PBS 清洗后加入约1 mL 细胞裂解液(VPMSF∶VRIPA=1∶100),离心后收集上清。用BCA试剂盒测蛋白总浓度。每组加总上样量1/5 体积的loading buffer,混合后煮沸8 min 备用。以每孔30 µg 的蛋白上样量进行电泳,并转膜,10%脱脂牛奶中室温封闭1.5 h。Ⅰ抗(AMPK、p-AMPK、mTOR、p-mTOR、LC3、p62、caspase-3 和PCNA 抗体,1∶1 000)4 ℃冰箱过夜。次日洗涤后孵Ⅱ抗(1∶10 000)。孵育完成后,将漂洗后的PVDF 膜置于曝光仪中,滴加化学发光液(VA液∶VB液=1∶1),曝光并保存结果。
2.7 透射电镜观察PASMCs 中的自噬小体 取长势良好的PASMCs 制成细胞悬液并离心,经前固定、后固定和醋酸铀块染后,用丙酮脱水、浸透。待包埋聚合之后,分别对标本进行半薄和超薄切片,并用透射电镜观察PASMCs的超微结构。
3 统计学处理
采用SPSS 21.0 软件对数据进行相关统计学分析。数据以均值±标准差(mean±SD)表示,多组样本间均数差异的比较用单因素方差分析(ANOVA),采用LSD 法对方差齐者进行两两组间比较;方差不齐则采用Dunnett's T3检验,P<0.05则认为差异有统计学意义。
结果
1 各组细胞的活力
CCK-8 实验结果显示,与N 组相比,HH 组细胞活力显著增强(P<0.01);与HH 组相比,D 组细胞活力的差异无统计学意义(P>0.05),AI 组细胞活力进一步增强(P<0.05),而CC 组细胞活力显著下降(P<0.01),见图1。

Figure 1.The viability of PASMCs determined by CCK-8 assay.Mean±SD. n=3.**P<0.01 vs N group;#P<0.05,##P<0.01 vs HH group.图1 CCK-8法测定PASMCs活力
2 各组细胞的增殖情况
EdU 实验结果显示,与N 组相比,HH 组细胞EdU 阳性率显著上升(P<0.01);与HH 组相比,AI 组细胞EdU阳性率进一步上升(P<0.05),而CC组细胞EdU阳性率显著下降(P<0.01),见图2。
3 TUNEL检测细胞凋亡情况
TUNEL 染色结果显示,与N 组相比,HH 组细胞TUNEL 染色阳性率显著下降(P<0.01);与HH 组相比,AI 组TUNEL 染色阳性率进一步下降(P<0.05),而CC 组TUNEL 染色阳性率显著上升(P<0.01),见图3。
4 各组细胞LC3、p62和caspase-3的mRNA表达
qPCR 结果显示,与N 组相比,HH 组LC3 的mRNA 表达水平显著上升(P<0.01),而p62 和caspase-3 的mRNA 表达水平显著下降(P<0.01);D 组LC3、p62 和caspase-3 的mRNA 表达水平与HH 组相比差异无统计学意义(P>0.05);AI 组LC3 的mRNA表达水平与HH 组相比显著上升(P<0.01),而p62和caspase-3 的mRNA 表达水平与HH 组相比显著下降(P<0.01);CC 组LC3 的mRNA 表达水平比HH 组降低(P<0.01),而p62 和caspase-3 的mRNA 表达水平比HH组上升(P<0.01),见图4。

Figure 2.Hoechst 33342 and EdU staining of PASMCs(scale bar=50 µm).Mean±SD. n=3.**P<0.01 vs N group;#P<0.05,##P<0.01 vs HH group.图2 EdU测定PASMCs的增殖能力
5 各组细胞AMPK和mTOR的磷酸化水平
Western blot 实验结果显示,与N 组相比,HH 组p-AMPK/AMPK 比值显著升高(P<0.01),而p-mTOR/mTOR 比值显著下降(P<0.01);D 组p-AMPK/AMPK和p-mTOR/mTOR 比值与HH 组相比差异无统计学意义(P>0.05);AI组p-AMPK/AMPK 比值与HH组相比显著升高(P<0.01),p-mTOR/mTOR 比值与HH 组相比显著降低(P<0.01);CC 组p-AMPK/AMPK 比值比HH 组低(P<0.01),p-mTOR/mTOR 比值与HH 组相比显著升高(P<0.01),见图5。
6 各组细胞LC3、p62、caspase-3和PCNA表达水平
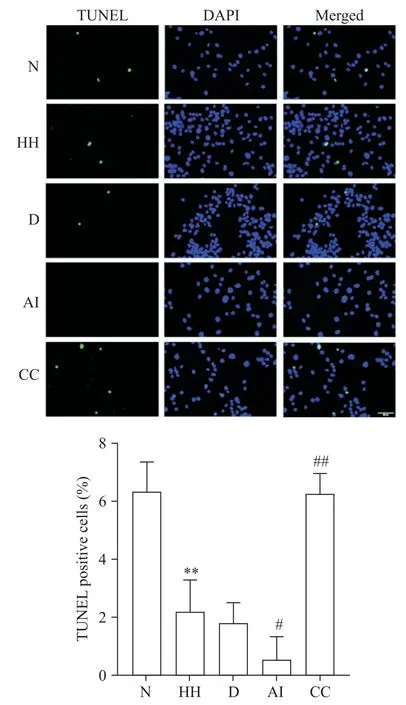
Figure 3.Apoptosis of PASMCs determined by TUNEL staining(scale bar=50 µm).Mean±SD. n=3.**P<0.01 vs N group;#P<0.05,##P<0.01 vs HH group.图3 TUNEL测定PASMCs的凋亡水平

Figure 4.Relative mRNA levels of LC3,p62 and caspase-3 in each group.Mean±SD. n=3.**P<0.01 vs N group;##P<0.01 vs HH group.图4 各组LC3、p62和caspase-3的相对mRNA水平
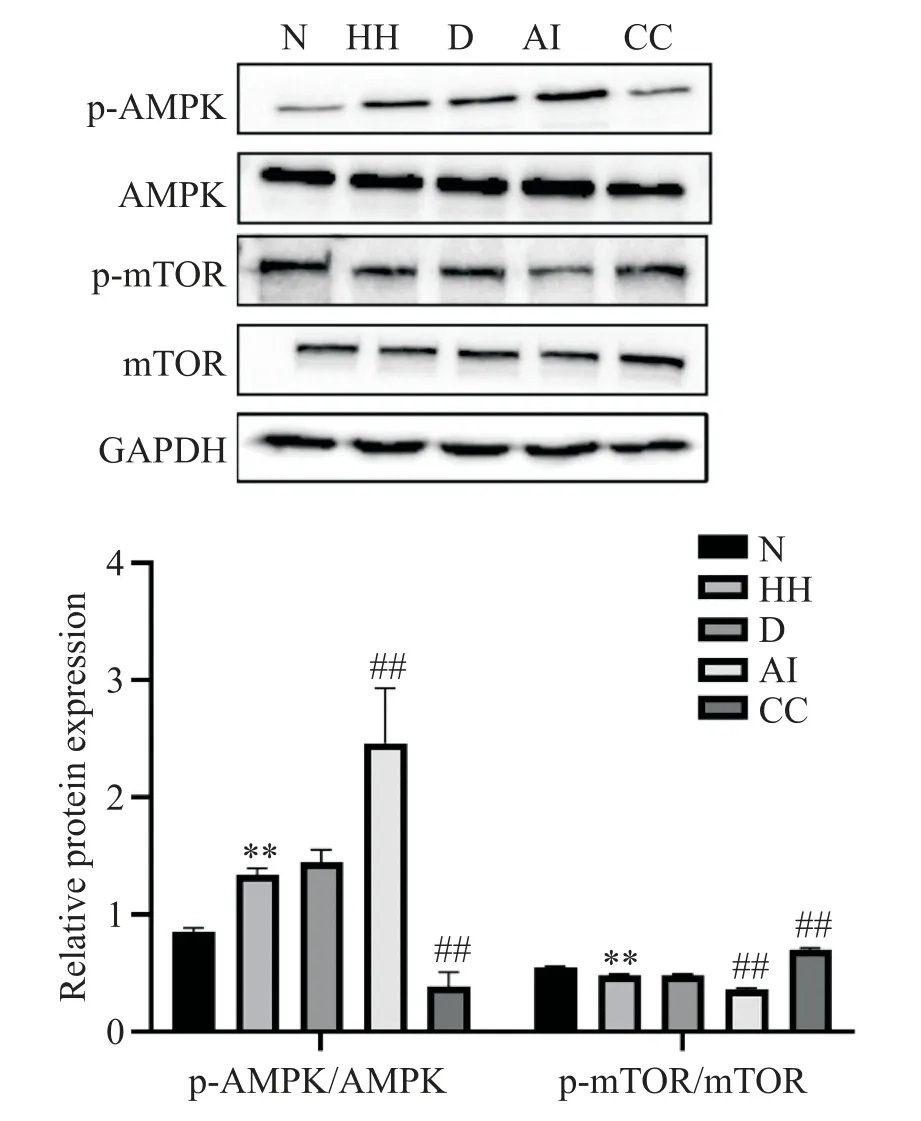
Figure 5.The protein levels of AMPK,p-AMPK,mTOR and pmTOR in PASMCs were detected by Western blot.Mean±SD. n=3.**P<0.01 vs N group;##P<0.01 vs HH group.图5 Western blot检测各组细胞中AMPK、p-AMPK、mTOR和p-mTOR蛋白水平
Western blot 实验结果显示,与N 组相比,HH 组LC3-II/LC3-I比值显著升高(P<0.01),p62和caspase-3 表达水平显著下降(P<0.01),PCNA 表达水平显著上升(P<0.01);D 组与HH 组相比LC3-II/LC3-I 比值及p62、caspase-3 和PCNA 蛋白水平的差异无统计学意义(P>0.05);AI 组LC3-II/LC3-I 比值和PCNA 蛋白水平与HH 组相比进一步提高(P<0.01),p62 和caspase-3 蛋白水平与HH 组相比显著降低(P<0.01);CC 组LC3-II/LC3-I 比值和PCNA 蛋白水平与HH 组相比显著降低(P<0.01),p62 和caspase-3 蛋白水平则显著升高(P<0.01),见图6。
7 各组细胞中的自噬小体
透射电镜观察结果显示,与N 组相比,HH 组自噬小体数量显著增多;与HH 组相比,D 组自噬小体数量相仿,AI 组自噬小体数量增多,CC 组自噬小体数量显著减少,见图7。
讨 论
肺动脉高压是一类以渐进性的肺动脉压力异常增高致使右心泵血能力受损引起右心衰的一种恶性病理生理状态。PASMCs 的增殖和迁移被认为是导致肺动脉高压中肺动脉重构的主要因素。肺血管重构一旦发生便无法逆转,所以这是肺动脉高压治疗的重点和难点。因此,阐明肺血管重构的机制对HHPH和肺源性心脏病的治疗具有重要意义。

Figure 6.The protein levels of LC3,p62,caspase-3 and PCNA in PASMCs were detected by Western blot.Mean±SD. n=3.**P<0.01 vs N group;##P<0.01 vs HH group.图6 Western blot检测各组细胞中LC3、p62、caspase-3和PCNA蛋白水平

Figure 7.Transmission electron microscopic observation of PASMCs in each group(×30 000).Arrows indicate autophagosomes.Mean±SD. n=3.**P<0.01 vs N group;#P<0.05,##P<0.01 vs HH group.图7 各组细胞的电镜观察
mTOR 属于磷脂酰肌醇激酶相关激酶(phosphatidylinositol kinase-related kinases,PIKKs)家族成员,是存在于真核生物中保守的蛋白质复合物,有蛋白激酶及信号传导的功能[13],包括对雷帕霉素敏感的mTORC1 和对雷帕霉素相对不敏感性的mTORC2 两种复合体,前者参与调节自噬[4,14]。AMPK 是由α 催化亚基和β、γ 调节亚基组成的异源三聚体[15];同时是一个重要的能量转换器,感受ATP/AMP 比例来调节细胞能量状态[15];低ATP 水平状态下(如饥饿或缺氧),AMPK 被启动。启动后的AMPK 可以通过磷酸化TSC2 抑制TSC1/TSC2 下游靶点mTORC1 而间接负性调控mTOR[16],也可通过磷酸化mTOR Raptor 直接抑制[6]。有文献报道,二甲双胍在大鼠模型上可以启动AMPK 而发挥抗低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)的作用[21]。也有研究发现,启动apelin 通路可以启动AMPK,改善低氧诱导的APJ(putative receptor protein related to the angiotensin receptor)表达下调,进而减少PASMCs 的增殖和迁移[22-23]。另外也有研究发现,在小鼠在体模型中使用AMPK 抑制剂可以抑制HPH 的发生;在离体实验方面,可以通过抑制AMPKα 促进低氧时PASMCs的死亡[24]。因此AMPK/mTOR 信号通路在肺动脉高压形成发展过程中的作用还未完全明确,有待更进一步的研究。
除了基因的调控,细胞的增殖和凋亡还受多种其他因素的影响,如细胞因子、微小RNA、自噬等,这些因素互相之间也会产生调控,但最终表现为细胞的增殖和凋亡。自噬是一种用于降解细胞内物质的消化途径,与细胞的存亡有着不可分割的联系。不同的细胞微环境和调控作用[7]控制着自噬发挥“促生存”或者“促死亡”的不同作用[8-9]。有研究发现,野百合碱可以通过活化eIF2α 启动自噬,促进PASMCs增殖和血管重构[10]。另有研究发现,葛根素可以以自噬依赖性的方式改善低氧诱导的肺动脉平滑肌细胞的增殖[11]。自噬抑制剂氯喹可以抑制肺动脉平滑肌细胞的增殖,其途径可能为通过抑制自噬途径和BMPRII 溶酶体的降解来产生的[20]。凋亡诱导因子TIGAR 作为P53 的下游靶点,可以通过抑制自噬和ROS 水平抑制小鼠和人肺动脉平滑肌细胞的增殖和迁移[21]。同时,又有研究发现,敲除羊的自噬基因Beclin-1 可以一定程度改善胎羊内皮细胞血管的新生,说明自噬有助于肺动脉高压的形成。关于为什么在PH 的过程中没有发生ACD(Autophagic cell death),学术界众说纷纭,其中一种说法是:SMC发生的自噬为选择性自噬,这种自噬既能清除受损的细胞器,为细胞提供能量,又能阻止ROS(主要来源于受损的线粒体)诱导的凋亡。综合上述作用产生的效应便是SMC不受机体控制不断增生[12]。
Lee 等[25]观察到人主动脉平滑肌细胞在脂质过氧化时自噬活动增强。Hill 等[26]认为自噬能够促进血管平滑肌细胞在脂质过氧化时的生存。研究证明,血管平滑肌细胞自噬受PI3K/Akt/mTOR、AMPK、NF-κB、MAPKs 等多种信号通路调节,且PI3K/Akt/mTOR、AMPK、NF-κB等信号通路参与了自噬调节血管平滑肌细胞表型转化的过程[27]。所以我们猜想,调低血管平滑肌细胞自噬水平,抑制其不断增殖,或许可以成为抑制肺血管重塑的作用靶点。
本实验结果显示,HH 条件下,大鼠PASMCs 增殖增加,凋亡减少,自噬水平上调。AICAR 作为AMPK的激动剂可以上调AMPK的磷酸化水平,降低mTOR 的磷酸化水平;CC 作为AMPK 的抑制剂可以抑制AMPK 的磷酸化水平,促进mTOR 的磷酸化。此结果提示mTOR 作为AMPK 的下游分子,参与了HH 环境下PASMCs 的自噬。这 与Shaw 等[16]和 张兴[17]的研究结果相同。
本实验结果还显示,HH 环境下,大鼠PASMCs中AMPK/mTOR 信号通路被启动,自噬水平上升。利用CC 抑制AMPK/mTOR 信号通路,可以下调PASMCs自噬水平,能够促进其凋亡,抑制其增殖;通过AICAR 激动AMPK/mTOR 信号通路可以增强细胞活力,促进PASMCs 的增殖,抑制其凋亡。这提示AMPK/mTOR 信号通路上调PASMCs 自噬可能是肺动脉高压发生发展时肺血管重构的诱因之一,通过抑制AMPK/mTOR 信号通路下调PASMCs 自噬可以抑制PASMCs 增殖,这与Zhou 等[18]的研究发现相类似。
综上所述,在HH 条件下,大鼠PASMCs 增殖增加,凋亡减少,而基于AMPK/mTOR 信号通路的自噬增强可能参与了PASMCs的增殖。
