川芎嗪通过Rac1/LIMK1通路减轻脂多糖诱导的小鼠急性肺损伤*
2022-09-01闵思敏刘小碣丁渡山张小楠陶伟婷
闵思敏,刘小碣,丁渡山,张小楠,陶伟婷,李 言,3△
(1蚌埠医学院病理生理学教研室,安徽蚌埠 233000;2蚌埠医学院第一附属医院,安徽蚌埠 233000;3常州大学,江苏常州 213000)
急性肺损伤(acute lung injury,ALI)是一种全身炎症反应综合征的肺部表现[1]。中性粒细胞积聚和促炎细胞因子作用于肺毛细血管内皮细胞,导致细胞间连接的破坏,例如紧密连接,肌动蛋白细胞骨架重塑,肺毛细血管内皮细胞发生渗漏,肺泡腔内富含蛋白的水肿液积聚,发生低氧血症[2-3]。Rho GTPase家族成员通过皮质肌动蛋白的形成动态调控细胞间连接和细胞骨架重塑。Ras 相关C3 肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)是Rho GTP 酶家族的Rac亚家族中的一员,通过调节肌动蛋白的细胞骨架来维持微血管屏障功能。在LPS刺激下,Rac1 增加,从而激活下游的调控因子p21 活化激酶(p21-activated kinases,PAKs),进而调控LIM激酶1(LIM kinase 1,LIMK1)的活性。LIMK1 在体外和体内又能使丝切蛋白(cofilin)在Ser3 位点特异性磷酸化,而这一磷酸化使cofilin 失活[4-5]。cofilin 的Ser3 位点的磷酸化是肌动蛋白动力学和细胞外信号的主要交集,调节肌动蛋白细胞骨架重组,导致内皮细胞收缩,内皮细胞间隙形成,细胞通透性增高[6]。
川芎嗪(tetramethylpyrazine,TMP)是中药川芎的主要有效成分,主要化学成分为四甲基吡嗪[7]。TMP 具有广泛的临床作用,包括扩张血管和保护内皮细胞[8]、通过抑制炎症反应和促进靶器官循环来减轻机体脓毒血症的临床症状[9]。但TMP 是否对ALI 具有保护作用还鲜有报道。本实验将TMP 与Rac1/LIMK1 信号通路及其磷酸化水平联系起来,通过构建脂多糖(lipopolysaccharide,LPS)诱导的ALI小鼠模型,探讨TMP在ALI中的作用及其机制。
材料和方法
1 动物
SPF 级雄性C57BL/6 小 鼠,6~8 周 龄,体重为(20±2)g,购于杭州子源实验动物科技有限公司,实验动物生产许可证号为SCXK(浙)2019-0004。小鼠饲养于SPF 级屏障环境12 h 光照黑暗交替、(24±2)℃、相对湿度(55±5)%下自由摄食饮水。
2 主要试剂
盐酸TMP 购自蚌埠医学院第一附属医院;地塞米松(dexamethasone,Dex)购自北京索莱宝科技有限公司;LPS购自Sigma;Rac1和LIMK1抗体购自Abcam;p-LIMK1 抗体购自Affinity;β-actin 抗体购自ABclonal;PhosSTOP 磷酸酶抑制剂购自Roche;蛋白酶抑制剂和RIPA 裂解液购自Biosharp;ELISA 试剂盒购自武汉博士德生物工程有限公司;BCA 检测试剂盒购于北京博奥森生物有限公司;ECL 化学发光显色液购于上海西唐生物科技有限公司;羊抗兔/鼠的II 抗购于武汉博士德生物技术有限公司;TUNEL细胞凋亡检测试剂盒购于碧云天。
3 实验方法
3.1 动物分组及造膜 将60 只C57BL/6 小鼠随机分为6 组:对照(control,CON)组、模型组(LPS 组)、Dex 组、低剂量(40 mg/kg)TMP(low-dose TMP,TMPL)组、中剂量(80 mg/kg)TMP(middle-dose TMP,TMP-M)组和高剂量(120 mg/kg)TMP(high-dose TMP,TMP-H)组,每组10 只。ALI 小鼠模型制备:实验前将LPS 配成0.5 g/L 和2 g/L 的溶液。每只动物第1 次腹腔注射LPS(2 mg/kg),第2 次气管滴注LPS(4 mg/kg),滴注后立即将动物直立并左右旋转进行造模。对照组小鼠第1 次腹腔注射与模型组等体积的生理盐水,第2 次气管滴注与模型组等体积的生理盐水。Dex 组及各剂量TMP 组在第1 次腹腔注射LPS 前30 min 和第2 次气管滴注LPS 后30 min 腹腔注射Dex(3 mg/kg)和TMP(40、80和120 mg/kg),对照组和模型组小鼠在Dex 组和各剂量TMP 组给药同时给予等体积的生理盐水。
3.2 肺组织湿干重比值(wet-to-dry weight ratio,W/D)检测 用滤纸轻轻吸干肺组织表面水分并精密称取湿重,在70 ℃鼓风干燥箱内烘烤48 h至恒重,精密称取干肺重量并按照公式计算W/D。
3.3 ELISA 试剂盒检测肺组织中IL-1β 和TNF-α 含量 切割一定重量的肺组织,加入一定量的组织蛋白萃取剂,在自动匀浆机中充分匀浆,3 000 r/min 离心20 min。按照ELISA 试剂盒方法,实验中设置空白对照孔和标准品孔,采用说明书进行规范加样,最后选择450 nm 波长检测吸光度,并根据标准品的吸光度值及相应的浓度值,制作标准曲线,根据标准曲线计算出待测样品的浓度值。
3.4 Western blot 取肺组织50 mg 置于预冷的1.5 mL EP 管中,剪碎,加入500 µL RIPA 裂解液(含1%蛋白酶抑制剂100×和10% PhosSTOP 磷酸酶抑制剂10×),经自动匀浆机充分匀浆裂解,以12 000 r/min离心15 min 后收集上清液;BCA 法测定蛋白浓度,与SDS-PAGE 蛋白上样缓冲液混匀,99 ℃煮5 min;每孔上样量为30µg,120 V电压跑胶60 min,200 mA电流转膜120 min 后经5%BSA 或脱脂牛奶摇床封闭2 h,Ⅰ抗置于冰箱4 ℃孵育过夜,TBST 洗涤3 次,每次5 min,Ⅱ抗常温摇床孵育2 h,TBST 洗涤3 次,每次5 min,用ECL 化学发光剂对膜进行显影,ImageJ 软件分析其灰度值。
3.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)获取和检测 检测脱颈处死小鼠,打开胸腔暴露气管,用预冷PBS(0.75 mL)冲洗4 次,2 500 r/min 离心5 min 沉淀细胞,取上清并将沉淀细胞重新悬浮在PBS 中,计算BALF 中白细胞总数及BALF 的蛋白浓度。
3.6 电镜观察肺组织超微结构变化 取右肺上叶组织,2.5%戊二醛预固定后,梯度乙醇脱水,包埋剂渗透,包埋、超薄切片,采用电子透射电镜观察并对比各组血管内皮细胞超微结构变化。
3.7 肺组织病理学检查及损伤评分 肺组织经4%多聚甲醛固定48 h,流水冲洗,乙醇脱水石蜡包埋,切片机制备5µm 石蜡切片,烤片2 h,烘片4 h,经梯度乙醇脱水,苏木精伊红染色,中性树胶封片,于光学显微镜下观察肺组织形态学改变。分别以肺泡内充血、肺泡出血、肺泡内中性粒细胞浸润或聚集在空气和血管壁、肺泡壁厚度增加和透明膜形成程度评分[10]:最小损害为0分,轻微损害为1分,中等损害为2 分,严重损害为3 分,最大损害为4 分,累计上述4项的分值即为肺组织损伤评分。
3.8 血液动力学的测量 使用PhysioSuite(Kent Scientific)测量心率和外周血氧饱和度(peripheral blood oxygen saturation,SpO2),测量在基线和实验结束时进行。各处理组动物均于LPS 第2 次气管滴注后24 h读数,取平均值进行分析。
3.9 TUNEL 染色检测细胞凋亡 肺组织经4%多聚甲醛固定48 h 后进行冰冻切片,冰冻切片机制备5µm 冰冻切片,使用TUNEL 检测试剂盒检测肺组织切片中是否存在凋亡细胞。
3.10 免疫组织化学染色 肺组织用4%多聚甲醛固定,石蜡包埋后将组织切成5 µm 的切片,然后脱蜡、水化后,PBS 洗涤,放入柠檬酸缓冲液中在95 °C下孵育10 min,再次PBS 洗涤,在室温下用3%过氧化氢封闭内源性过氧化物酶10 min 后,5%的牛血清蛋白液封闭30 min,加入p-LIMK1 和Rac1 单克隆抗体4 ℃孵育过夜,加入通用性II 抗室温下孵育30 min,滴加DAB 显色后用苏木精复染,中性树胶封片后显微镜下观察。
4 统计学处理
采用SPSS 18.0 软件进行统计分析。计量资料均进行正态性检验,采用均数±标准误(mean±SEM)表示。两组之间比较采用t检验(满足正态分布及方差齐性),多组之间比较采用单因素方差分析,进一步两两比较采用Brown-Forsythe 检验。以P<0.05 为差异有统计学意义。
结果
1 LPS对小鼠SpO2和心率的影响
我们用LPS 处理C57BL/6 小鼠建立ALI 小鼠模型(图1A),模型组小鼠在LPS 刺激后发生明显的肺水肿及炎症(图1B)。ALI 的诊断标准是通过动脉血气分析测定动脉血氧分压(PaO2)/吸入氧浓度百分比(FiO2)比值(PaO2/FiO2)来评估低氧血症的程度[11-12]。本研究的ALI 动物模型是在没有呼吸机支持的情况下构建的,于是我们主要选用显著、持续的SpO2下降代替PaO2/FiO2比值来衡量低氧血症的程度。本研究中24 h 内SpO2显著下降(>10%),心率明显增高(P<0.05),见图1C、D,表明该动物模型已被成功建立。
2 TMP对小鼠肺组织病理学的影响
HE 染色结果显示,对照组小鼠肺组织结构正常、组织轮廓清晰未见明显异常,而LPS 组小鼠肺泡腔和间质可见大量红细胞,肉眼可见片状血灶,肺组织肺泡壁明显增厚,肺组织损伤评分显著升高(P<0.01);TMP 各组及Dex 组小鼠肺组织红细胞浸润减少,肺泡腔渗出减轻,肺泡壁与LPS 组相比变薄,TMP-M 组和Dex 组肺组织炎症浸润减少最为显著,肺泡结构改善明显,片状血灶明显减少及肺组织损伤评分明显降低(P<0.01),见图2A。

Figure 1.LPS induced severe lung injury in mice.A:LPS administration process;B:the gross appearance of the lung was observed(white arrows:the space between the left and right lungs;blue arrows:the inflammation/redness of lung tissues;yellow arrow:the edema of lung tissues);C and D:peripheral blood oxygen saturation(SpO2)and heart rate,respectively.Mean±SEM. n=5.#P<0.05 vs control(CON)group.图1 LPS导致小鼠严重的肺损伤
HE 染色可见TMP 对LPS 导致的肺部病理损伤具有一定的保护改善作用,并且中剂量的TMP 治疗效果最好,所以我们想知道中剂量的TMP 对细胞凋亡是否也有作用。与CON 组相比,LPS 会导致肺组织中凋亡细胞数量显著增多;而中剂量TMP 治疗可以有效抑制细胞凋亡(P<0.01),见图2B。
3 TMP对小鼠血管通透性的影响
血管通透性增加时,血管渗漏发生,肺部发生水肿,蛋白渗出以及白细胞增多。与对照组相比,模型组W/D 升高(P<0.01);与模型组相比,TMP-M 组及Dex 组的W/D 显著降低,TMP-M 组降低最为明显(P<0.01),见图3A。
白细胞计数结果显示,与对照组相比,模型组小鼠BALF 中白细胞总数显著升高(P<0.01);与模型组比较,TMP 各组及Dex 组BALF 中白细胞总数显著降低,且TMP-M 处理组效果最明显(P<0.01),见图3B。
BCA法测定BALF中蛋白浓度结果显示,与对照组相比,模型组小鼠BALF 中蛋白浓度显著升高(P<0.01);与模型组比较,TMP 各组及Dex 组BALF 中蛋白浓度显著下降,且TMP-M 组的下降最明显(P<0.01),见图3C。这说明在40~120 mg/kg 剂量范围内,TMP的治疗效果并不呈剂量依赖性。
4 TMP 对ALI 小鼠肺组织中IL-1β 和TNF-α 的影响
ELISA 结果显示,与CON 组相比,模型组小鼠肺组织中IL-1β 和TNF-α 表达水平显著升高;与模型组相比,阳性对照Dex 组IL-1β 和TNF-α 的水平显著下降(P<0.05 或P<0.01),中、高剂量TMP 组的IL-1β水平显著下降(P<0.01),低剂量TMP 组与模型组相比差异无统计学意义,TMP 各组TNF-α 水平均显著下降(P<0.01),见图4。
5 TMP对ALI小鼠紧密连接的影响
上面实验已经证实TMP 可以改善LPS 诱导的小鼠毛细血管内皮细胞通透性的增加,且中剂量(80 mg/kg)TMP 的治疗效果较为理想。紧密连接是维持上皮细胞通透性的重要结构,紧密连接受损则通透性增加。因此我们通过电镜观察了对照组、LPS组和中剂量TMP组的细胞紧密连接。正常小鼠肺组织毛细血管相邻的内皮细胞可见连续条带状的紧密连接,细胞间未见缝隙;LPS 处理使部分内皮细胞连续的紧密连接受损,有的内皮细胞可见明显裂隙;TMP处理后可抑制LPS 对内皮细胞紧密连接的损伤,部分受损的紧密连接被修复,见图5。

Figure 2.HE staining and TUNEL assay results of mouse lung tissues.A:HE staining of lung tissues;B:the apoptosis of lung tissue sections.Mean±SEM. n=3.##P<0.01 vs CON group;**P<0.01 vs LPS group.图2 各组小鼠肺组织HE染色及TUNEL实验结果
6 TMP 抑制LPS 诱导的ALI 小鼠毛细血管内皮细胞Rac1/LIMK1通路的激活
Western blot 结果显示,与CON 组比较,LPS 组Rac1 蛋白表达水平显著上调(P<0.01);与LPS 组比较,低、中剂量TMP 组Rac1 蛋白表达水平显著降低(P<0.01),与阳性对照Dex组的结果趋势相一致(P<0.01),而高剂量组与LPS 组比较差异无统计学意义(图6A)。与CON 组比较,LPS 组p-LIMK1 蛋白水平显著上调(P<0.01);与LPS组比较,在各剂量TMP的预保护下p-LIMK1 蛋白水平显著降低(P<0.05 或P<0.01),与阳性对照Dex 组的结果趋势相一致(P<0.01);LPS 组与各处理组相比LIMK1 表达无显著差异,但p-LIMK1/LIMK1 水平与p-LIMK1 水平趋势相一致(图6B)。另外,免疫组化结果也显示,与CON组比较,LPS 组Rac1 蛋白表达水平显著上调,与LPS组比较,TMP 治疗后Rac1 蛋白表达水平显著降低,与阳性对照Dex 组的趋势相一致;与CON 组比较,LPS 组p-LIMK1 蛋白表达水平显著上调,与LPS 组比较,TMP 治疗后Rac1 蛋白表达水平降低,这也与阳性对照Dex组的趋势相一致(图6C)。这些结果表明TMP 可能是通过抑制Rac1/LIMK1 信号通路改善毛细血管通透性的。

Figure 3.Effects of TMP on total leukocyte count and protein concentration in BALF of mice.A:effect of TMP on lung wet-to-dry weight ratio in ALI mice;B:leukocyte suspension was used to suspend the cell precipitation in BALF and calculate the total number of leukocytes;C:BCA was used to measure the protein concentration in BALF.Mean±SEM. n=3.##P<0.01 vs CON group;**P<0.01 vs LPS group.图3 TMP对小鼠BALF中白细胞总数和蛋白浓度的影响

Figure 4.Effect of TMP on inflammatory factors in lung tissues of ALI mice.The content of IL-1β(A)and TNF-α(B)in lung tissues was detected by ELISA.Mean±SEM. n=3.##P<0.01 vs CON group;*P<0.05,**P<0.01 vs LPS group.图4 TMP对ALI小鼠肺组织炎症因子的影响

Figure 5.Effects of TMP on tight junctions in ALI mice.Red arrows represent tight junctions,and yellow boxes represent increased intercellular space.图5 TMP对ALI小鼠紧密连接的影响
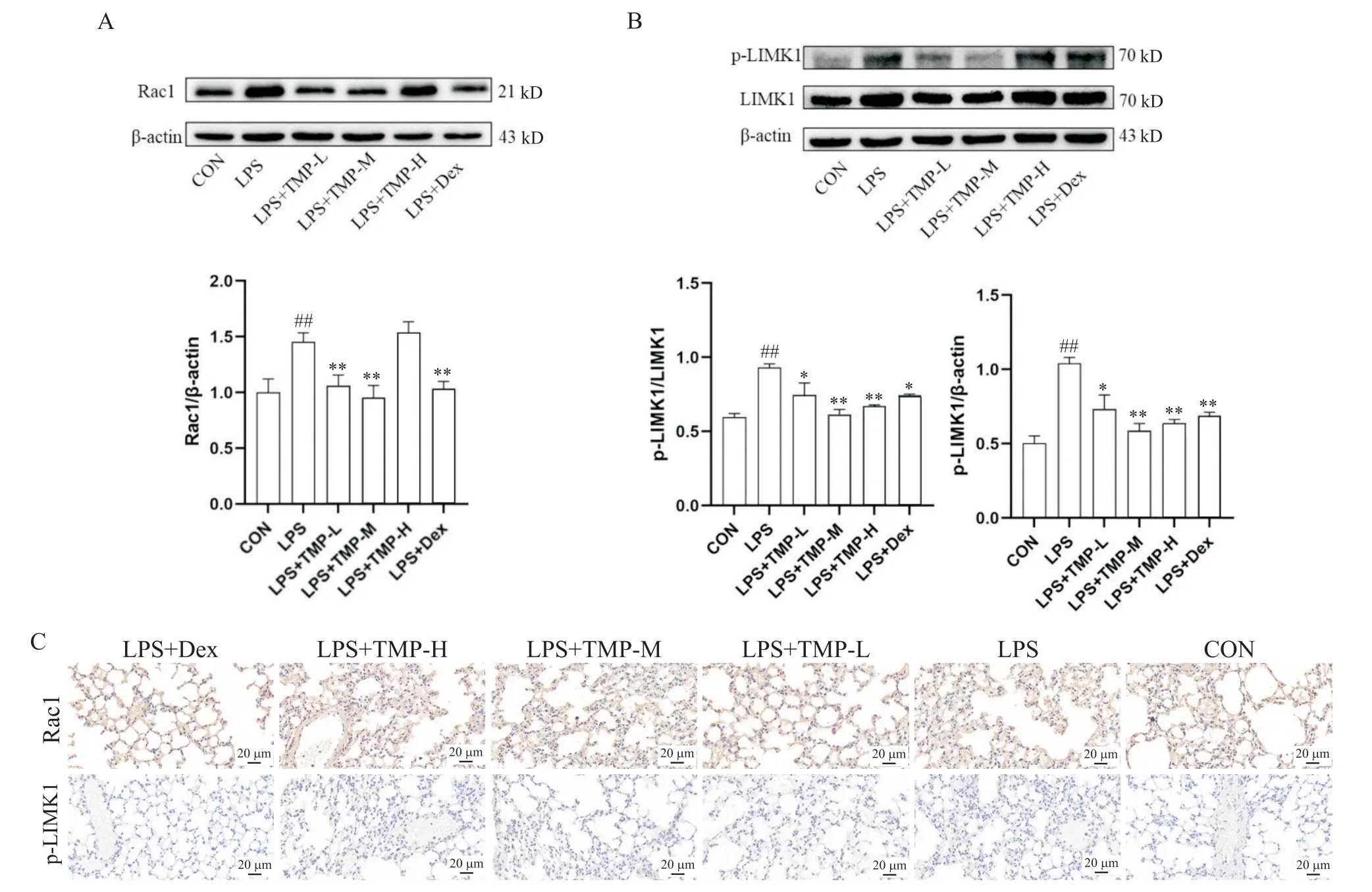
Figure 6.Effect of TMP pre-protection on the protein levels of Rac1,LIMK1 and p-LIMK1 in lung tissue of the mice with LPS-induced ALI.A and B:the protein levels of Rac1,LIMK1 and p-LIMK1 were determined by Western blot;C:the protein levels of Rac1 and p-LIMK1 were determined by immunohistochemical staining.Mean±SEM. n=3.##P<0.01 vs CON group;*P<0.05,**P<0.01 vs LPS group.图6 TMP预保护对LPS诱导的Rac1、LIMK1和p-LIMK1蛋白水平的影响
讨 论
ALI 是以肺组织发生急性炎症反应及毛细血管通透性增加为主要特点的临床综合征,ALI发生的标志是内皮细胞损伤引起的肺毛细血管膜通透性增加[13]。ALI可由多种病因导致,其中细菌感染是最常见的病因,LPS 是革兰阴性菌细胞壁的主要成分,能够诱导ALI[14]。本实验采用LPS 二次打击诱导ALI小鼠模型,因为课题组前期实验发现采用LPS 对小鼠进行二次打击建立的ALI 模型更接近临床ALI 的复杂病理生理机制[15]。
TMP 是中药川芎的根茎提取物,具有抗炎、改善微循环的作用,中药成分复杂,为避免其他成分的影响,我们实验采用的是TMP单体即四甲基吡嗪。Dex是一种糖皮质激素,常被用作抗炎药物[16-17];此外,已有研究证实Dex 可以通过干扰AKT/mTOR/RhoA 通路影响细胞骨架进而抑制细胞通透性增加,故我们选择Dex 作为阳性药物对照组[18]。通过综合文献及前期预实验我们确定了TMP 低、中、高三个梯度,探究TMP对ALI的保护机制。
肺组织HE 染色和ELISA 检测炎症因子实验结果表明,LPS 会导致肺部组织结构受损,中性粒细胞聚集,发生严重的炎症反应;TMP 预处理可改善肺泡腔渗出、炎性浸润减少,与阳性对照组作用一致。TUNEL实验证实了TMP可以抑制LPS诱导的细胞凋亡。本实验主要关注TMP 对LPS 诱导的肺通透性的影响。接下来的肺组织W/D 结果表明LPS 导致W/D明显增高,说明LPS 引起毛细血管内皮细胞及肺泡上皮细胞通透性增加,进而发生肺水肿;TMP 预处理后同Dex 组结果一致,可使内皮通透性降低,肺水肿减轻。随后检测BALF 中白细胞总数和蛋白浓度结果也显示,LPS导致内皮细胞及肺泡上皮细胞通透性增加,受损的细胞表面使蛋白质水肿液流入,炎症细胞尤其是中性粒细胞,在炎症因子,如IL-1β 和TNFα 等的影响下迁移到肺中,从而使BALF 中白细胞总数和蛋白浓度增加;TMP治疗后可降低BALF中白细胞总数和蛋白浓度,与Dex治疗效果一致。与Dex抗炎机制有所不同,本实验主要关注的是肺毛细血管内皮细胞通透性及TMP 的影响,结合电镜结果分析我们可以看到LPS 导致血管内皮细胞紧密连接受损,通透性增高;由于前面实验已经证实TMP-M 组治疗效果最好,所以我们观察了CON 组、LPS 组和TMP-M 组的紧密连接,发现TMP-M 组治疗后紧密连接受损程度明显减轻。
我们已知LPS 会导致Rac1/LIMK1 通路激活、细胞骨架重构,细胞内出现明显的应力纤维变粗、变短、排列紊乱,内皮细胞收缩,通透性增加,微血管漏发生;TMP 可减轻LPS 诱导的毛细血管内皮细胞通透性增高[19]。细胞骨架重构决定内皮细胞通透性。在之前的研究中,Rac1 被确定为决定细胞骨架稳定性的分子机制之一[20]。cofilin 的Ser3 磷酸化是肌动蛋白动力学和细胞外信号的主要交叉点,cofilin被其磷酸化抑制,被其去磷酸化重新激活[21-22]。Rac1 可以通过调节p21 蛋白活化激酶(p21-activated kinase,PAK)产生肌动球蛋白收缩,PAK是Rac1的下游调节器,可以调节LIMK1 的活性,LIMK1 磷酸化可促使cofilin磷酸化从而失活,所以磷酸化LIMK1增多使细胞骨架重构[23]。Western blot 结果显示LPS 会导致Rac1 增多,从而激活下游LIMK1,使p-LIMK1 增多,细胞骨架重构,细胞通透性增加,而TMP 可以抑制Rac1/LIMK1 信号通路来降低内皮细胞通透性(图7),保护ALI小鼠的作用与Dex组相比具有相同的疗效。但低、中、高剂量的TMP 对Rac1/LIMK1 信号通路的抑制作用并不呈剂量依赖性,这可能是高剂量的TMP对细胞有一定的毒性作用导致的。
综上所述,TMP 可以减轻ALI 小鼠的炎症反应,抑制内皮细胞通透性增加,对ALI 小鼠具有保护作用。Rac1/LIMK1 通路的激活可以诱导细胞骨架重构和通透性增高,这是参与和促进肺部炎症发生发展的重要环节。TMP 可以通过抑制Rac1/LIMK1 通路减轻内皮细胞骨架重构和内皮细胞通透性,进而减轻LPS 诱导的ALI,为临床使用TMP 治疗ALI 提供重要的实验和理论依据。

Figure 7.Rac1/LIMK1 signaling pathway activation stimulated by LPS,and TMP protective mechanisms in vascular endothelial cells.图7 LPS 刺激血管内皮细胞Rac1/LIMK1 信号通路激活和TMP的保护机制
