忍冬藤提取物抗结肠癌作用研究
2022-09-01陈灵蒋文婕姚昶李玉莲方明明
陈灵, 蒋文婕, 姚昶, 李玉莲, 方明明
结肠癌是一种由诸多因素诱发的结肠上皮来源消化道肿瘤,其发病早期无明显症状,但随着疾病进展,可能引起多种并发症如器官功能障碍、头晕头痛、黄疸、呼吸困难等[1-2]。目前,我国结肠癌的发病率及致死率逐渐上升,严重影响居民的生存质量及生活品质[3]。手术、化疗等为当前临床治疗结肠癌的常规治疗方法,但仍存在复发率高、不良反应大、成本高等缺点[2]。诸多证据显示,部分中药及其成分可发挥抗肿瘤作用,具有疗效确切和安全性高等特点[4]。传统中药忍冬藤又名老翁须、千金藤,药用历史十分悠久,最早记载于汉末的《名医别录》,其性甘味寒,尤善清热解毒,疏风通络[5]。忍冬藤中含有有机酸类、黄酮类、环烯醚萜类等多种类型代谢产物,可通过多种途径,作用于多种靶点,发挥解热镇痛、抗炎、抗菌等作用[6]。忍冬藤包括其活性成分对多种肿瘤亦有作用,但目前暂无其抗结肠癌作用的相关报道[5-7]。因此,本研究以结肠癌细胞HCT116和SW480为对象,从线粒体凋亡角度研究忍冬藤提取物的抗结肠癌作用,以期为忍冬藤及其组方临床用于治疗结肠癌提供实验依据。
1 材料
1.1 细胞株 购自ATCC的HCT116和SW480细胞株(人结肠癌)采用含10% FBS的DMEM培养于5%CO2、37 ℃的恒温细胞培养箱中。
1.2 药物及试剂 忍冬藤(批号:200911),购自南京市中西医结合医院,其基原经姚昶教授鉴定为忍冬科忍冬LonicerajaponicaThunb.的干燥茎枝;DMSO(批号:V900090)、DMEM培养基(批号:D6429)、AnnexinV-FITC/PI双染试剂盒(批号:APOAF),均购自德国默克sigma-aldrich公司;CCK8试剂盒(批号:CA1210),购自北京索莱宝公司;JC-1检测试剂盒(批号:BL711A),购自合肥白鲨公司;胎牛血清(批号:10099141C)、PVDF膜(批号:LC2002)、BCA蛋白定量试剂盒(批号:23246),均购自美国Thermo公司;一抗:Bcl-2(批号:bs-33411R)、Bax(批号:bs-0127R)、Cleaved Caspase-3(批号:bsm-33199M)、Cyt-C(批号:bs-0013R)、Cleaved PARP(批号:bsm-52408R)、p53(批号:bsm-33058M)和GAPDH(批号:bs-0755R)和二抗:IgG-HRP(批号:32935S),均购自北京博奥森公司;p53抑制剂PFT-α(批号:SY1065),购自北京百奥莱博。
1.3 主要仪器 ML-TS型电子天平,美国Mettler Toliedo公司;YK-1020型超声机,上海樱科设备有限公司;R-100型旋蒸仪,瑞士布奇公司;FD-250201型冻干机,杭州富瑞捷公司;CO2培养箱,德国IRM公司;E2-20TJ型水系统,南京EPED有限公司;TS100、TS2R型显微镜,日本尼康公司;Calibur型流式细胞仪,美国BD公司;MK3型酶标仪,美国Thermo公司;MINI-4小型垂直电泳仪,美国伯乐公司。
2 方法
2.1 忍冬藤提取物的制备 结合文献及前期基础[5],忍冬藤提取物的提取工艺为:取适量忍冬藤药材(粉碎,40目筛),加入甲醇(50%,2倍体积),静置1 h后超声50 min,滤渣重复上述操作,合并两次滤液,浓缩挥干甲醇后冻干,随后用含10%胎牛血清的DMEM培养基复溶,得到生药浓度为1 g/ml的忍冬藤提取物,临用前以10%胎牛血清的DMEM培养基稀释至相应浓度。
2.2 CCK8法检测细胞存活率 收集对数生长期的HCT116和SW480细胞接种于96孔板中(100 μl,5×103个),24 h后各加入浓度为0(0.1% DMSO)、2、5、10、20、40、60和80 g/L“2.1项”忍冬藤提取物。24 h后按CCK8说明书步骤操作,在450 nm处测定吸光值并计算存活率,计算方法与文献报道一致[5]。
2.3 Hochest法检测凋亡 收集对数生长期的HCT116和SW480细胞接种于24孔板中(500 μl,2.5×104个),24 h后结合“2.2项”结果各加入浓度为0(0.1% DMSO)、15、25和35 g/L“2.1项”忍冬藤提取物。24 h后弃液,PBS洗涤3次,加入300 μl染液,避光孵育10 min后PBS洗涤2次,随后加入300 μl PBS,最后使用荧光倒置显微镜观察处理后的细胞并拍照。
2.4 Annexin V/PI法检测凋亡率 收集对数生长期的HCT116细胞接种于6孔板中(2 ml,4×105个),24 h后处理同“2.3项”,在此基础上增加0(0.1% DMSO)、35 g/L“2.1项”忍冬藤提取物、35 g/L忍冬藤提取物与5 μmol/L p53抑制剂PFT-α联用处理。24 h后依据凋亡双染试剂盒说明书步骤处理,最后采用流式细胞仪检测处理后的细胞凋亡情况。
2.5 JC-1法检测线粒体膜电位变化 细胞培养及接种同“2.2项”,细胞处理同“2.3项”。24 h后依据JC-1试剂盒说明书步骤处理,最后使用荧光倒置显微镜观察处理后的细胞并拍照。
2.6 Western Blot法检测相关蛋白表达 细胞培养及接种同“2.4项”,细胞处理同“2.3项”。24 h后提取总蛋白,按BCA试剂盒说明书步骤定量,按每孔30 μg蛋白量进行SDS-PAGE电泳,结束后转膜至PVDF膜,5%脱脂奶粉溶液(0.1% TBST配制)封闭2 h。0.1% TBST 1∶1 000稀释相应一抗,4 ℃孵育过夜,0.1% TBST润洗。0.1% TBST 1∶10 000稀释HRP标记的二抗,室温孵育1 h,0.1% TBST润洗。加入显影液,反应结束后吸干显影液。曝光、显影并扫描图像。最后导入相应分析软件分析并计算相应蛋白的相对表达水平。
3 结果
3.1 忍冬藤提取物对结肠癌细胞增殖的影响 如图1所示,忍冬藤提取物干预24 h后,HCTII6和SW480细胞存活率明显下降,并且该效果呈现一定的浓度依赖性。24 h后的IC50值分别为25.34和37.53 g/L。因此,后续实验选择IC50附近的15、25和35 g/L为忍冬藤提取物的实验浓度。这一结果亦表明HCT116细胞较SW480细胞对忍冬藤提取物更为敏感,故后续实验主要选择HCT116细胞进行深入探讨。
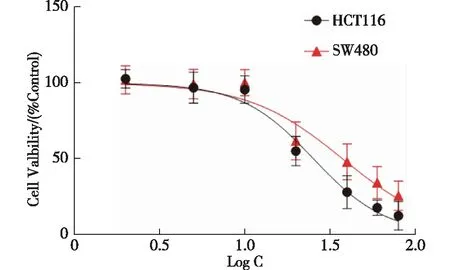
图1 忍冬藤提取物对结肠癌细胞存活率的影响
3.2 忍冬藤提取物对结肠癌细胞形态的影响 如图2所示,空白组HCT116和SW480细胞呈上皮细胞样贴壁生长,细胞形态为有触角不规则形;随着忍冬藤提取物的干预,部分细胞变成折光率更高的类圆形,体积缩小并与周围细胞脱离。结果表明,忍冬藤提取物可对HCT116和SW480细胞产生杀伤作用。
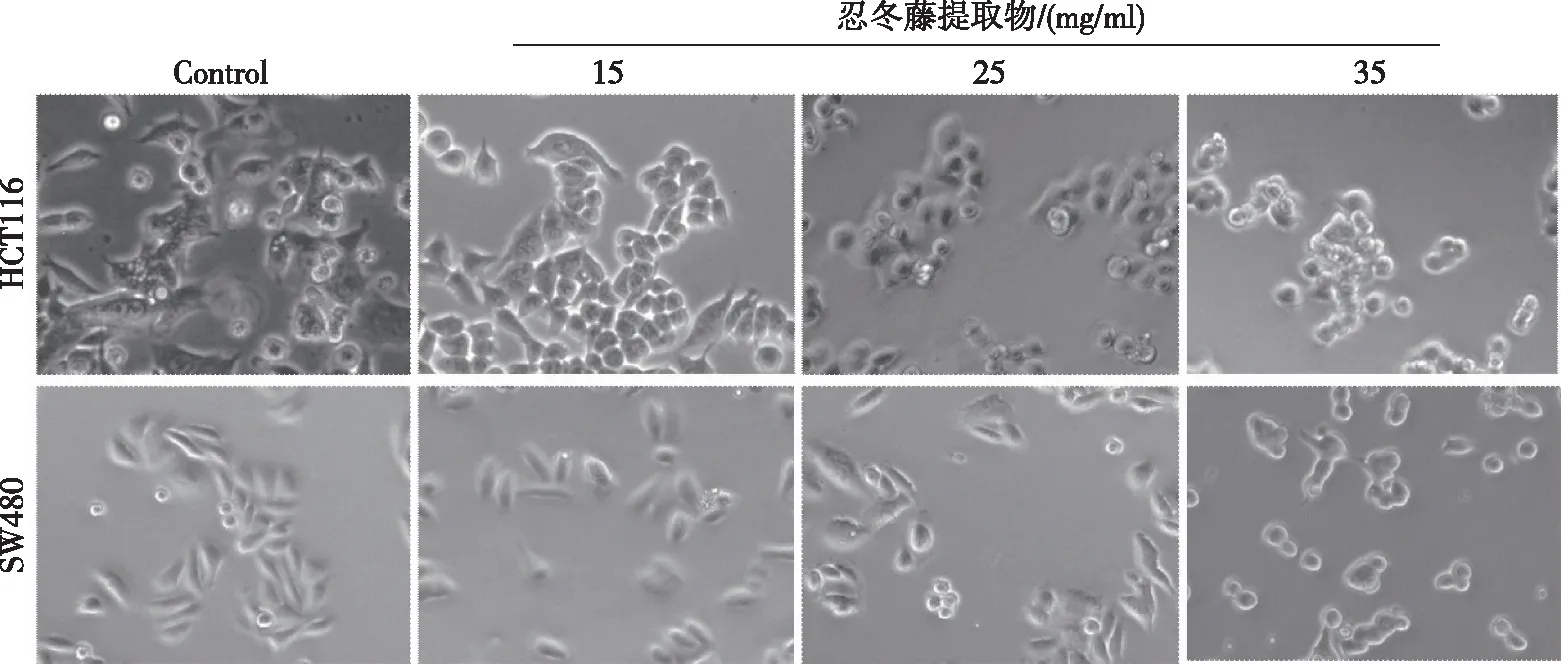
图2 忍冬藤提取物对结肠癌细胞形态学的影响
3.3 忍冬藤提取物对结肠癌细胞凋亡的影响 如图3所示,空白组HCT116和SW480细胞核表现状态正常;随着忍冬藤提取物的干预,HCT116和SW480细胞核出现明显的凋亡特征(浓染致密的颗粒块状蓝色荧光)。结果表明,忍冬藤提取物可诱导HCT116和SW480细胞凋亡。
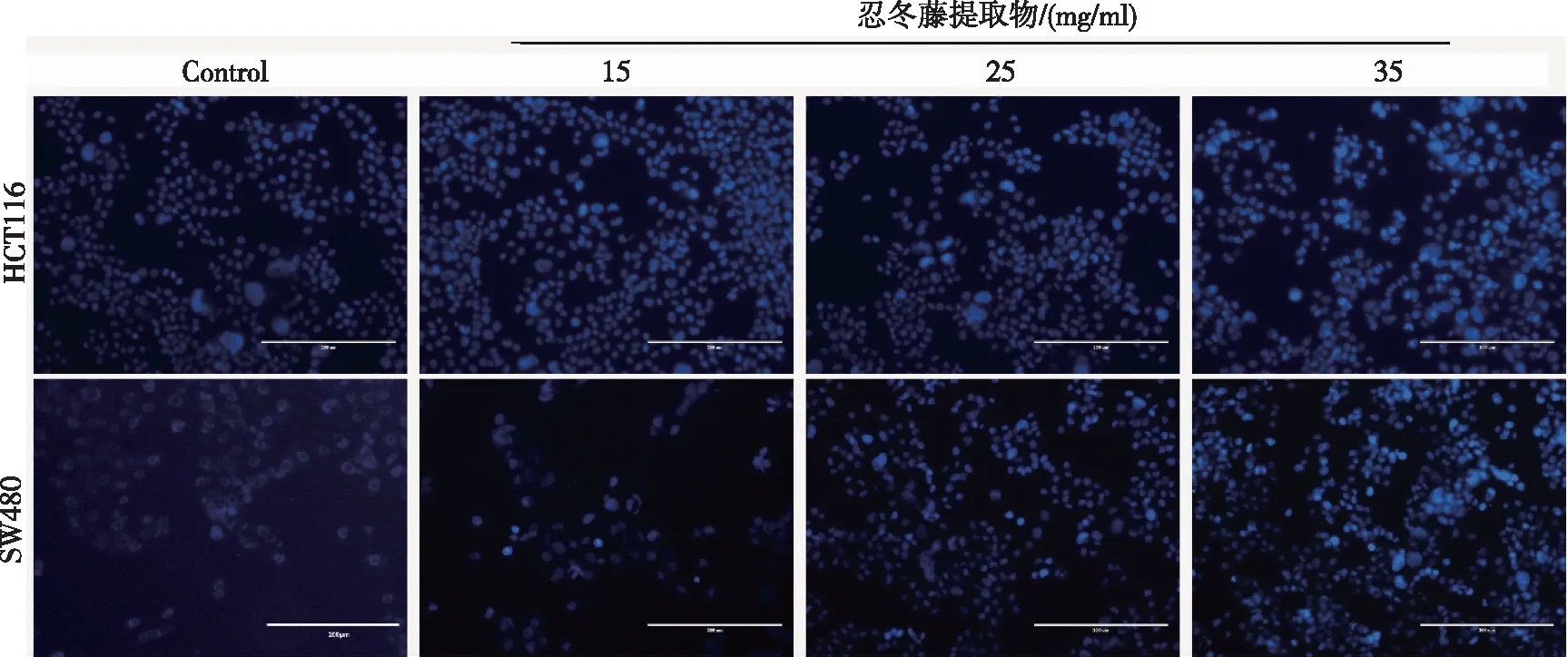
图3 忍冬藤提取物对结肠癌细胞凋亡的影响
如图4所示,相较于空白组,忍冬藤提取物干预后,HCT116细胞凋亡率明显增加(P<0.01)。结果表明,忍冬藤提取物可诱导HCT116细胞发生凋亡。
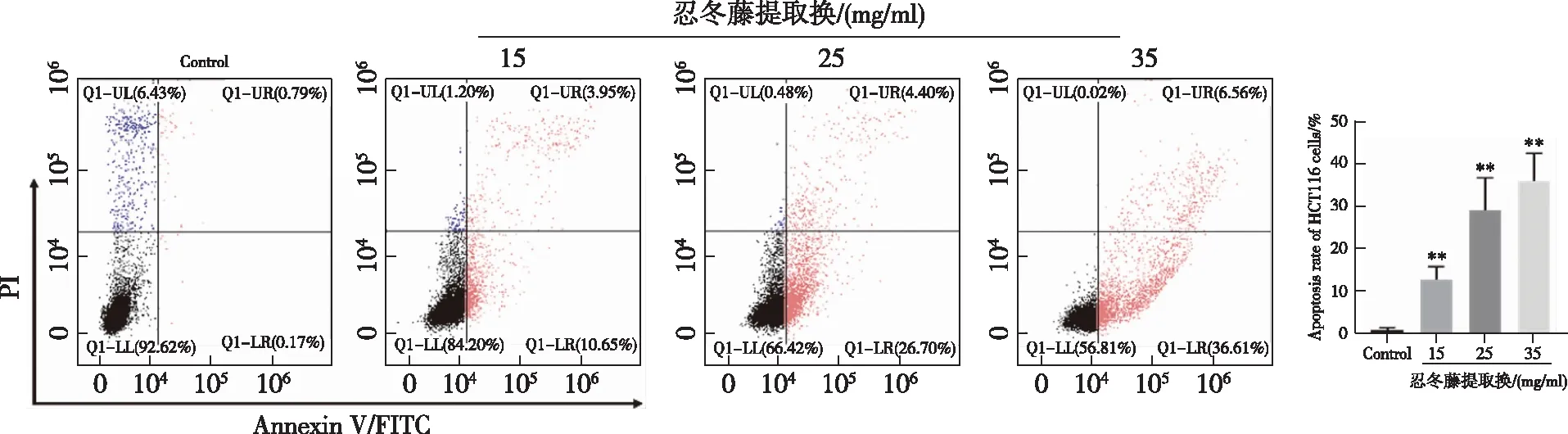
注:相较于空白组(Control),**P<0.01
3.4 忍冬藤提取物对HCT116细胞线粒体膜电位的影响 如图5所示,空白组HCT116细胞红色荧光较强;随着忍冬藤提取物的干预,HCT116细胞红色荧光逐渐变弱,绿色荧光逐渐加强,Merge亦呈现变绿趋势。结果表明,忍冬藤提取物可促进HCT116细胞线粒体膜电位坍塌。
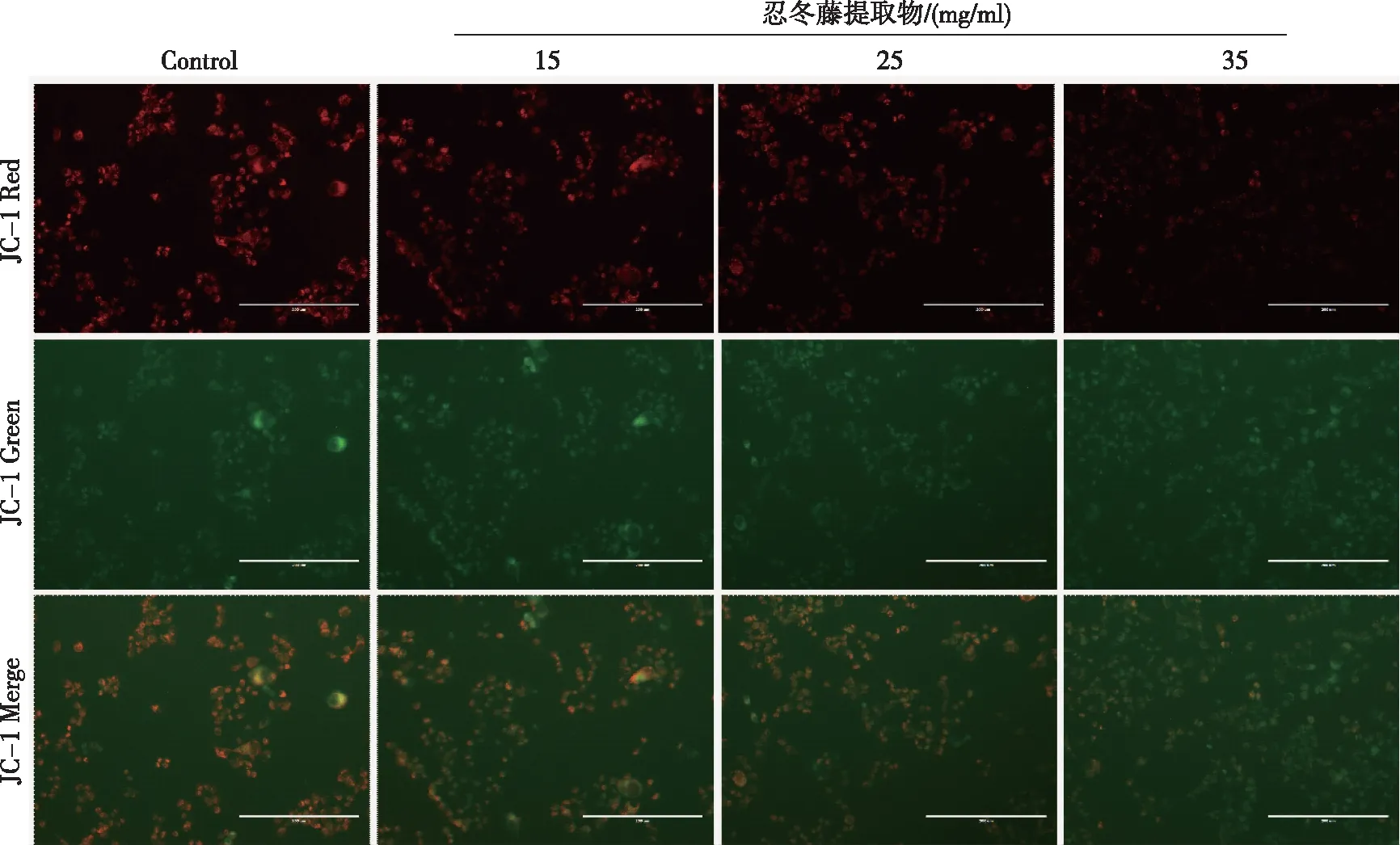
图5 忍冬藤提取物对HCT116细胞线粒体膜电位的影响
3.5 忍冬藤提取物对HCT116细胞线粒体凋亡相关及p53蛋白表达的影响 如图6所示,相较空白组,忍冬藤提取物干预后,HCT116细胞Bax/Bcl-2比值明显上调(P<0.01),Cleaved Caspase-3、Cleaved PARP、Cyt-C和p53蛋白表达明显增加(P<0.05,P<0.01)。结果表明,忍冬藤提取物可诱导HCT116细胞发生线粒体凋亡。
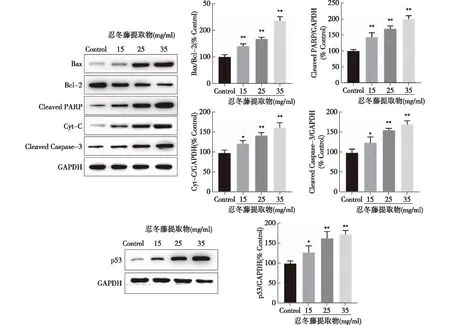
注:相较于空白组(Control),*P<0.05,**P<0.01
3.6 p53抑制剂PFT-α对HCT116细胞凋亡的影响 为了验证忍冬藤提取物是否通过调控p53依赖的线粒体途径诱导HCT116细胞的凋亡,选用p53抑制剂5 μmol/L PFT-α与35 g/L忍冬藤提取物联用。如图7所示,相较于忍冬藤提取物组,PFT-α可明显逆转忍冬藤提取物诱导的HCT116细胞凋亡(P<0.01)。
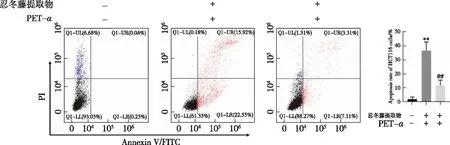
注:相较于空白组(Control),**P<0.01;相较于忍冬藤提取物组,##P<0.01
4 讨论
我国绝大多数传统中药来源于药用植物,其原植物的初生和次生代谢产物十分复杂,这种复杂性体现在代谢产物的结构类型各不相同,复杂的代谢产物正是中药发挥多种药理作用和多方面功效的重要基础[8]。忍冬藤中含有绿原酸、异绿原酸等有机酸类,木犀草素、木犀草苷、槲皮素等黄酮类,断氧马钱苷、獐牙菜苷等环烯醚萜类等多种类型代谢产物[6]。据报道,绿原酸可通过IFN-γ信号通路抑制食管癌体内及体外模型的PD-L1的表达,从而发挥抗食管癌作用[9]。木犀草素可通过抑制Akt/mTOR信号通路H3K27Ac和H3K56Ac的水平调节MMP-9表达,从而抑制受体阳性的三阴性乳腺癌的增殖和转移[10]。獐牙菜苷可通过诱导线粒体凋亡、干预细胞周期和靶向JNK/p38信号通路,最终获得抗胶质母细胞瘤的作用[11]。以上可知,忍冬藤及其代谢产物可通过多种途径发挥抗肿瘤作用。本研究中,忍冬藤提取物可剂量依赖地抑制HCT116和SW480细胞增殖并改变其细胞形态。因此,忍冬藤提取物具有明确的体外抗结肠癌作用。
细胞凋亡是细胞通过激活多种基因并促进其表达,最终有序结束自身生命的一种程序性死亡方式[12]。同时,诱导肿瘤细胞进入凋亡程序是大部分临床一线化疗药物包括顺铂、奥沙利铂等发挥抗肿瘤作用的重要途径[13]。在本研究中,忍冬藤提取物可诱导HCT116和SW480细胞凋亡。此外,流式细胞术结果进一步确认忍冬藤提取物能够剂量依赖地诱导HCT116细胞凋亡。这些结果提示,诱导凋亡可能是忍冬藤提取物抗结肠癌作用的重要途径。
线粒体凋亡是细胞凋亡发生的主要途径之一,线粒体膜电位的坍塌是其发生的重要标志之一。本研究中,忍冬藤提取物可促进HCT116细胞线粒体膜电位坍塌。Bcl-2家族中的Bax与Bcl-2蛋白分别发挥促凋亡和抗凋亡作用,能够调控线粒体凋亡,二者的表达变化可导致线粒体膜电位降低及通透性增加[14],导致线粒体内部凋亡因子如Cyt-C的释放。Cyt-C释放后可以与凋亡因子作用形成凋亡复合体,活化Caspase-9,进一步活化凋亡最终执行蛋白Caspase-3,最终启动线粒体凋亡途径[5,15]。本研究中,忍冬藤提取物可剂量依赖地上调Bax/Bcl-2比值,以及Cleaved PARP、Cyt-C和Cleaved Caspase-3蛋白表达,以上提示忍冬藤提取物通过诱导线粒体凋亡发挥抗结肠癌作用。
p53对细胞凋亡具有关键的调控作用,其激活后从胞质进入胞核中,进而诱导凋亡进展。在本研究中,忍冬藤提取物可剂量依赖地上调p53蛋白表达。进一步研究显示,p53抑制剂PFT-α可逆转忍冬藤提取物诱导的HCT116细胞凋亡,说明忍冬藤提取物可能通过诱导p53依赖的线粒体凋亡发挥抗结肠癌作用。
综上,忍冬藤提取物可通过诱导p53依赖的线粒体凋亡发挥抗结肠癌作用,此次研究结果可为忍冬藤及其组方临床治疗结肠癌提供一定实验依据。
