家族性腺瘤性息肉病的诊疗进展
2022-09-01方媛张宇刘伟臻张夏青朱勇
方媛, 张宇, 刘伟臻, 张夏青, 朱勇
家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)是一种以结肠、直肠多发(数百至数千个)腺瘤性息肉为主要表现的常染色体显性遗传病,具有极高结直肠癌(colorectal cancer,CRC)风险(约100%),常合并多种结直肠外疾病。Bodmer等[1]首先于1987年发现家族性腺瘤性息肉病由肿瘤抑制基因——大肠腺瘤性息肉病(adenomatous polyposis coli,APC)基因突变引起。减毒家族性腺瘤性息肉病(attenuated familial adenomatous polyposis,AFAP)是FAP的一种变体。相较于FAP,AFAP结肠直肠腺瘤性息肉数目较少(多为数十至百)且腺瘤出现的年龄较晚。但AFAP仍有极高癌变风险(约50%),且有可能出现在FAP的家族成员中[2]。在针对呈现相似表型的患者,特别是AFAP患者的研究中发现,患者存在MUTYH基因而无APC基因突变[3]。后进一步研究发现该基因也与多发性腺瘤的发生有关,有较高癌变风险,即被称为MUTYH相关息肉病(MUTYH-associated polyposis,MAP),为一种常染色体隐性遗传病。
1 发病机制与遗传学
1.1 APC基因 APC基因位于染色体5q21-22,由15个编码外显子和3个非编码外显子组成[4]。外显子15含有突变簇区(mutation cluster region,MCR),是APC基因种系和体细胞突变最常见的区域。约60%APC基因突变为种系突变,主要表现为C端截短蛋白缺乏,使β-连环蛋白(β-catenin)和微管无法与之结合,该表现被认为是引发结直肠癌发生的关键[5]。
1.2 APC基因突变的致癌途径 APC基因突变通过激活Wnt信号通路关键蛋白——β-连环蛋白(β-catenin)的转录活性,促进胃肠道细胞增殖和分化[6]。研究发现突变的APC基因对G0、G1向S期的细胞周期进程的抑制作用较未突变的APC基因小[7],同时允许具有排列缺陷的纺锤体及染色体的细胞继续有丝分裂[8],间接导致了异常细胞增殖。APC基因突变也可导致有丝分裂纺锤体和染色体排列出现缺陷,而不阻止细胞有丝分裂,从而增加了染色体的不稳定性和肿瘤细胞的发展。
APC基因可能通过控制APC,影响β-连环蛋白和上皮细胞钙黏蛋白(E-cadherin)在细胞质和细胞膜之间的分布来调节细胞黏附,使细胞黏附丧失,从而促进肿瘤的发生[9]。突变的APC基因抑制了碱基切除修复蛋白的组装和DNA双链断裂的修复,积累了肿瘤相关的基因改变[10-11]。
随着肿瘤的进展,细胞逐渐依赖突变的APC基因来增殖或维持其表型(致癌基因成瘾),从而利于肿瘤细胞的增殖分化[12]。突变的APC基因通过各种途径促进了肿瘤细胞的发生和发展,其中Wnt信号通路是目前研究最成熟的影响通路。APC基因突变致癌途径的研究对FAP患者延长生存期及寻找新的药物靶点有着非常重要的意义。
1.3 APC基因的检测 约80%FAP患者可检测出APC基因突变。大部分APC基因突变是点突变,其中直接测序法灵敏度最高,因此实验室多把DNA直接测序(Sallger和NGS测序法)列为标准方法。约20%种系突变包含大范围缺失、插入和复杂的基因重排,可用基因靶向aCGH分析方法分析。被确认携带APC基因突变的个体应在10~12岁开始进行每年的结直肠环境监测[13]。APC基因的p.I1307K错义突变可增加CRC的易感性(10%~20%),建议存在此突变的个体进行早期筛查。目前有研究认为,p.E1317Q错义突变也可能与结直肠腺瘤及CRC易感性相关[14]。
APC基因突变的检出可能与人种和息肉数量相关。研究发现非白种人在腺瘤或CRC诊断年龄比高加索人小且总体APC突变率更高[15]。Grover研究团队发现在≥1 000个腺瘤的个体中,80%存在致病性的APC基因突变,而在100~999个腺瘤的个体中,只有56%是APC突变基因的携带者。在≥1 000个腺瘤的个体中,仍有18%未检测出致病性APC或MUTYH基因突变[16],提示APC基因突变的检出可能与息肉数量相关,且可能存在尚未鉴定的相关基因突变。
在APC基因突变阴性的FAP患者中,杨军等[17]发现许多同义突变SNP(synonymous SNP,sSNP)重复出现,并不同程度的干扰了APC外显子的剪切过程。目前也有研究把胸腺嘧啶乙二醇DNA糖基化酶1基因相关性息肉(NTHL1-associated polyposis,NAP)和聚合酶校对相关性息肉(polymerase proofreading-associated polyposis,PPAP)纳入腺瘤性息肉病综合征中,认为以上都属于肿瘤易感性基因,但其与MUTYH基因突变是否存在相关性并表现出家族聚集性还缺乏研究数据,仍需进一步讨论[18]。
2 临床表现
FAP的常见症状为腹泻和大便带血,发病率约为0.01%[19]。息肉的数量和年龄因分型不同而出现差异(表1)[20]。典型的病程特征常见于20岁左右,发现全结肠出现超过100个息肉。
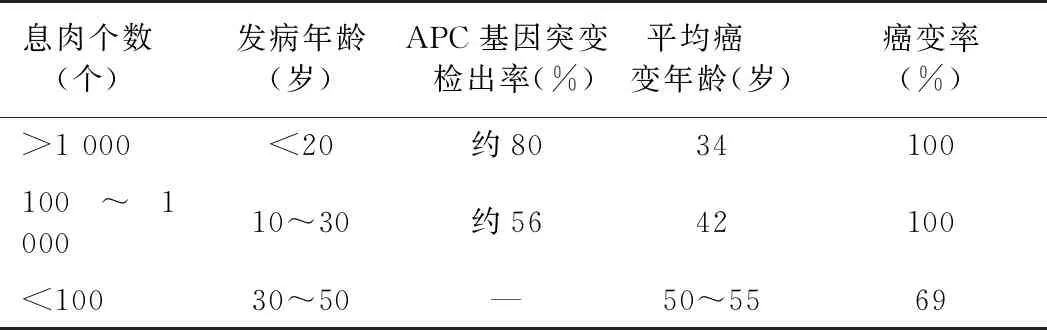
表1 家庭性腺瘤性息肉病的临床特征
2.1 肠内表现 FAP患者肠镜下最显著的特征是全结直肠内见大量息肉,数量成百上千不等,直径2~5 mm,一般不超过10 mm;组织病理学表现最常见的为管状腺瘤,也可见管状绒毛、绒毛腺瘤及增生性息肉。息肉数量超过1 000枚的严重FAP患者往往发生肿瘤的年龄更早, 70%~80%的肿瘤发生在结肠的左侧,且更易出现FAP相关的肠外表现[19]。随着息肉体积的增大和数目的增加,患者常出现便血合并腹痛,部分出现便次增多、黏液便、贫血、体重减轻等症状,少数患者还出现肠梗阻或肠套叠[21]。目前尚未发现上述症状与体征的特异性,肠镜是FAP患者主要的诊断依据和复查方式。
2.2 肠外表现 先天性视网膜色素上皮肥大(congenital hypertrophy of the retinal pigment epithelium,CHRPE)可能在出生时即在FAP人群中出现,在FAP患者和相关APC基因突变患者中的患病率高达90%,是普通人群的20倍(1.2%~4.4%),被认为是FAP最常见和最早的肠外表现[22]。CHRPE可单侧或双侧发生,大小形状各不相同,多与视盘相似,无恶变潜能。
十二指肠腺瘤性息肉发生在30%~70%的FAP患者身上,易进展为十二指肠及壶腹周围癌,成为FAP患者第二大死亡原因[22]。在北京协和医学院报道的45例FAP患者中,有33%合并十二指肠腺瘤,略低于国外报道[23]。约30%~88%的FAP患者发生胃底腺息肉(fundic gland polyp,FGP),其中高达50%的患者病理提示为低度凹陷发育不良,这在散发FGPs患者中是罕见的。胃腺瘤也可以在整个胃中发现,仅占胃息肉的约10%。随访发现亚洲FAP患者胃癌的发生率更高,且发病与年龄呈正相关,建议患者进行长期的胃部监测(每年1次),对50岁以上的患者缩短监测时间(每半年1次)[24]。
约50%的FAP患者可发现良性皮肤肿瘤改变,包括表皮囊肿、纤维瘤病、脂肪瘤和毛母质瘤。虽特异性不强,但侵袭性纤维瘤因生长速度快且呈浸润性生长已成为FAP个体的第三大常见死亡原因[25]。
FAP合并骨瘤的发生率是46%~93%,是普通人群发生率的20倍(4%~16%),且数量常>3个,好发于颌骨、副鼻窦、长骨[26]。研究发现APC基因也是人类牙齿生长的关键基因[27],30%~75%FAP患者发生牙齿异常,其中包括牙齿缺失、多生、复合牙等。
当APC基因突变发生在密码子697和1 224之间时,FAP患者患脑肿瘤的风险增加了3倍,患髓母细胞瘤的风险则增加了13倍[21]。
FAP相关的甲状腺癌发病率在1%~2%,其形态学上除了多病灶的特点,病理学还有其非常独特的筛状桑椹状改变[28]。
肝母细胞瘤是最常见的儿童恶性肿瘤。研究发现携带种系APC突变的FAP患者与正常人群相比,肝母细胞瘤发展的风险增加了750~7 500倍。肝母细胞瘤可能是FAP患儿的第一个表现[29]。但目前国内未见相关报道。
3 诊断
FAP的临床诊断标准需同时满足以下3个条件:①患者结直肠腺瘤性息肉>100个,具有较早的发病年龄(通常在10~20岁长出息肉,在20岁后出现胃肠道症状);②常伴有肠外表现,如CHRPE、骨瘤和硬纤维瘤等;③常染色体显性遗传[30]。
4 FAP治疗
目前针对FAP的治疗以手术为主,采用的手术方法有:全大肠切除术(total proctocolectomy,TPC)联合回肠末端造瘘术、TPC联合回肠储袋肛管吻合术(ileal pouch-anal anastomosis,IPAA)和全结肠切除术(total abdominal colectomy,TAC)联合回肠直肠吻合术(ileorectal anastomosis,IRA)。
全直肠切除回肠袋肛管吻合术(TPC+IPAA)被认为是治疗FAP的最佳术式。但由于其对生育(尤其是女性生育)及性功能的影响[31-32],部分轻表型FAP患者(直肠息肉≤20个,结肠息肉≤1 000个)和(或)孕前女性建议采取全结肠切除回肠直肠吻合术(TAC+IRA)[33]。对于多发直肠息肉,年龄>25岁和(或)APC突变位于密码子1 309的患者,Vasen等研究更倾向于选择行全直肠切除回肠袋肛管吻合术(TPC+IPAA)[34]。行TAC+IRA的患者,建议术后每6个月进行1次直肠镜检查及活检,该术式保留部分直肠术后仍有发生直肠癌的风险(2%~12%)[24]。定期随访发现接受IPAA的患者生存期要更长,较IRA长约1.8年[35],但存在吻合口瘘及吻合口出血、储袋炎、柱状移行区黏膜癌变、生育功能障碍、肛门功能受损等并发症,严重影响患者术后生存质量。
TPC+IPAA和TAC+IRA两种术式并非完全独立,在IRA患者术后肠镜随访中发现高度不典型增生的腺瘤和(或)肠镜下无法完全切除的大量息肉者,可追加行IPAA,但若在第2次术后再次随访中发现癌变,则必须行腹会阴联合直肠癌根治术(Miles术)[33],并进入直肠癌管理流程进一步治疗。
FAP患者最终手术术式的选择及术后内镜随访方案取决于患者术前的临床表现、患者的意愿和医生的综合评估,图1。
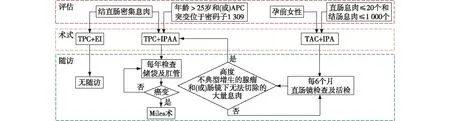
图1 家庭性腺瘤性息肉病手术及随访策略
5 FAP预防
5.1 抗炎药的使用 非甾体类抗炎药在用于治疗FAP很早即显示出了其优势。Giardiello等[36]发现,与服用安慰剂的患者相比,服用舒林酸患者息肉的平均数量和平均直径均有下降,且未发现使用舒林酸的恶性事件。5名内镜专家组成的研究组发现,在每天2次使用塞来昔布治疗6个月后,患者十二指肠息肉减少。在针对FPA患者的回顾性研究中也发现塞来昔布组到达主要终点(进展)的患者较少。塞来昔布最终成为FDA批准的第一种用于治疗FAP患者结肠直肠息肉的预防药物。但由于存在其存在心血管血栓、胃肠道出血等不良反应,阻碍了塞来昔布作为预防FAP药物的广泛应用[37-39]。
Ishikawa等[40]在观察使用美沙拉嗪控制FAP的临床疗效时发现其更倾向于减少FAP男性受试者结肠息肉的数量并在溃疡性结肠炎兼有FAP的患者中观察到息肉数量减少,考虑上述疗效可能与美沙拉嗪抗炎作用相关,但样本量小,仍需进一步研究。朱求实等[41]回顾性分析73例确诊FAP患者,提出COX-2、Survivin蛋白在癌变组患者中呈高表达,可作为防治FAP的有效靶点。2018年遗传性结直肠癌临床诊治和家系管理中国专家共识认为长期小剂量服用阿司匹林可以减少腺瘤性息肉的发病率及术后复发率[20]。刘玉兰等[42]回顾非甾体类抗炎药在治疗FAP的临床疗效后也支持NSAIDs在治疗FAP患者时有较好的耐受性。然而Murff等[43]认为虽然使用低剂量阿司匹林、常规阿司匹林、非阿司匹林非甾体抗炎药和COX-2抑制剂可降低腺瘤性息肉的风险,但联合使用两种抗炎药物需要考虑相关不良反应。
5.2 表皮生长因子抑制剂 表皮生长因子受体(epithelium growth factor receptor,EGFR)的活性可能与通过上皮钙黏蛋白复合物调节的肿瘤细胞黏附有关,认为允许细胞呈黏附状态需要EGFR野生型具有活性,从而使该细胞在邻近的正常组织中完整和持续地建立微腺瘤。遗传学结果表明,在APC缺失和微腺瘤的形态学发展之后,微腺瘤形成并扩展为大腺瘤之前,暂时需要Egfr维持具有活性的阈值水平[44]。Samadder等[45]发现在舒林酸-厄洛替尼治疗组获得的7个息肉中,磷酸化EGFR蛋白存在很少或未表达,表明舒林酸-厄洛替尼治疗有效地限制了EGFR活化。临床在使用表皮生长抑制剂时显示了出长期的毒不良反应,因而未获批用于治疗FAP,但针对较早发现癌变且微息肉密集的患者也可以考虑使用该种药物,但需注意观察早期皮肤病变。
5.3 补充维生素D及钙 在腺瘤-癌序列中,发现APC和上皮细胞钙黏蛋白的表达显著降低,β-连环蛋白的表达增加[46-47]。多个研究团队观察发现补充维生素D可降低β-连环蛋白促进增殖信号的潜力,补充钙剂可适度上调上皮细胞钙黏蛋白的表达,从而认为两者可作为潜在的结直肠腺瘤化学预防剂[48-49]。肠道特异性维生素D受体有助于维持肠道屏障功能,同时小鼠实验证实维生素D在与其受体结合时,可以通过上调CYP3A4抑制相关炎性反应[50]。炎性反应被认为是息肉发生发展的重要前期表现,因此适量补充维生素D及钙或可在腺瘤发生及发展的关键环节获效。
6 中医药治疗
目前尚无针对FAP患者的中药方剂研究。张扬等[51]以益气养阴、化瘀解毒为治,发现欣胃颗粒可以上调胃癌前病变模型大鼠胃黏膜组织Wnt信号通路中Axin、APC基因的表达。龚艳青等[52]发现左金丸能够通过提高APC蛋白的表达及降低甲基转移酶的活性影响大鼠大肠癌发生的基因和表观遗传机制。也有研究发现中药地榆能够抑制Wnt通路,并对该通路上的关键β-连环蛋白有明显下调[53]。
Meta分析显示腺瘤患者临床证型多以脾胃虚弱、血瘀内停、大肠湿热为主,中药使用以健脾药物为主,方剂则以参苓白术散加减为主,表明中药口服对降低内镜下切除大肠腺瘤复发率有效,同时也可改善术后腹痛腹泻症状[54]。总结各家经验,发现四妙散、乌梅丸等也可在肠息肉复发上获效。中医药具有多基因、多靶点、多途径、多层次调控的优势,但目前仍需基础研究进一步证实。
7 小结
综上所述, FAP的诊断主要为镜下诊断并结合基因检测。但APC基因突变存在多样性,且部分突变缺乏大样本数据支持。即使典型FAP患者,仍有20%无法从基因检测中获益。当患者出现反复便血和(或)粪便性状改变时,追问家族史,筛查FAP是必要的。FAP患者进展为CRC的概率近100%,指南推荐尽早进行手术,并根据不同手术方式定期随访,同时筛查治疗相关并发症。目前针对FAP的化学预防存在对患者随访间期太短,无法评估长期疗效及不良反应等问题。此外,对选择性COX-2治疗及预防FAP的相关研究仅单从息肉大小和数量进行观察并不能准确预测疾病的发展。
