低聚果糖对C57BL/6小鼠肥胖预防及其肠道菌群的调节作用
2022-09-01王国盼郝占西高船舟黄金莉李华军
李 瑶,王国盼,郝占西,黄 娟,高船舟,黄金莉,李华军,*
(1.大连医科大学微生态学教研室,辽宁 大连 116044;2.量子高科(广东)生物有限公司,广东 江门 529081;3.大连医科大学肿瘤干细胞研究院,辽宁 大连 116044)
近年来,全球肥胖发生率不断上升,2016年世界卫生组织的数据显示,约39%的成年人超重,其中肥胖占13%。在过去的40 年里,我国居民肥胖患病率迅速上升,成人肥胖人数增加了3 倍,超重人数增加了1 倍,到2020年,我国成年居民超重肥胖比例超过50%,6~17 岁儿童青少年肥胖比例接近20%,6 岁以下儿童肥胖比例达到10%。肥胖是一种慢性、复杂的疾病,与当前社会中常见的疾病如高脂血症、2型糖尿病、脂肪肝、心血管疾病、癌症等密切相关,是由不健康饮食、缺乏身体活动和环境决定因素驱动的,这些因素可以被遗传易感性、社会心理因素、环境致肥源和不良的早期生活暴露等并发的潜在风险因素放大或改变。肥胖管理的主要目标也不再局限于减肥,还包括解决并存疾病和改善整体健康状况。因此,控制和预防肥胖是许多慢性疾病管理的重要研究领域。
肠道菌群与人体之间关系复杂,在能量平衡和代谢中发挥作用,有证据表明,肠道菌群在不同胖瘦人群之间存在差异,肥胖人群中肠道菌群与宿主之间的关系由“共生”变成了“失调”,从而扰乱宿主代谢,有益菌群可以帮助人体消化、构建免疫体系的平衡,而有害菌群比例的增多会导致肠道菌群的紊乱,极易引发肥胖。双歧杆菌作为益生菌之一,可以减少脂肪、胆固醇的生成量和体质量,并改善血糖,而在一些报道中肥胖的第一特征是有益菌(如双歧杆菌)数量的减少。
低聚果糖又名蔗糖低聚糖、果寡糖等,是以蔗糖为原料,通过现代生物工程技术转化精制而成,存在于上千种人们常食用的天然植物当中,如香蕉、黑麦、大蒜、马铃薯、洋葱等。低聚果糖具有多种优良生理功能,可以促进双歧杆菌增殖、降血糖、改善血清脂质等,定期摄入低聚果糖可以诱导肠道菌群的改变,如增加双歧杆菌等益生菌水平,并降低能量的摄入、限制体质量增加和脂肪储存、增强免疫力等。低聚果糖作为益生元,定期摄入可以诱导肠道菌群发生改变,从而预防和控制肥胖。奥利司他是目前较流行的减肥产品,于1998年在欧洲获批,是唯一获得美国食品药品监督管理局批准的长期治疗肥胖的药物,可抑制胃肠道和胰腺的脂肪酶发挥作用,阻断甘油三酯的水解,减少摄入脂肪的吸收。
肥胖作为世界范围的流行性疾病,越来越被重视,人们也在一直探索肥胖的预防和治疗手段,但现有的治疗方法并不十分理想。在以往的研究中,益生元等功能性食物进入大众视野,具有副作用小、健康治疗的优点。本实验通过C57BL/6小鼠食用高脂饲料建立肥胖模型,同时灌胃给予实验组不同剂量的低聚果糖或奥利司他。通过检测小鼠各项肥胖指标并结合肠道菌群16S rRNA基因高通量测序分析,探讨低聚果糖通过影响肠道菌群控制肥胖发展的机制,这将为低聚果糖在肥胖预防方面的应用提供一定实验依据。
1 材料与方法
1.1 材料与试剂
SPF级C57BL/6小鼠,雄性5 周龄,平均体质量(22±2)g。正常组小鼠普通饲料购自大连医科大学重大疾病基因工程模式动物研究所;实验组小鼠60%高脂饲料购自北京华阜康生物科技股份有限公司。实验环境为大连医科大学模式动物研究所SPF级动物屏障系统(独立通气笼盒系统)。
低聚果糖 量子高科(广东)生物有限公司;奥利司他 重庆华森制药股份有限公司;脂多糖(lipopolysaccharide,LPS)、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)、酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)试剂盒 江苏酶标生物科技有限公司;Stool DNA Isolation Kit试剂盒 成都福际生物技术有限公司;质量分数4%多聚甲醛 北京索莱宝科技有限公司;总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)检测试剂盒 南京建成生物研究所。
1.2 仪器与设备
LX-200型离心机 海门市其林贝尔仪器制造有限公司;YXQ-LS-50SII型高压蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;SK-1型混匀器 常州澳华仪器有限公司;Sorvall Legend Micro-21R型低温冷冻离心机美国赛默飞世尔科技公司;FYY-1001-P型超纯水机青岛富勒姆科技有限公司;CX43型光学显微镜 奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 动物模型建立与分组
实验动物在适应环境1 周左右后被随机分为5 组,每组10 只,正常组(N组)喂养普通饲料,其他组喂养60%高脂饲料。N组和模型组(M组)每天灌胃给予0.2 mL生理盐水,低聚果糖低剂量组(FL组)灌胃0.2 mL含1.7 g/(kg·d)低聚果糖的生理盐水溶液;低聚果糖高剂量组(FH组)灌胃0.2 mL含8.5 g/(kg·d)低聚果糖的生理盐水溶液;阳性对照组(Y组)灌胃0.2 mL含120 mg/(kg·d)奥利司他的生理盐水溶液。灌胃处理6 周。
1.3.2 肥胖指标分析
1.3.2.1 体质量增量及附睾脂肪指数的计算
在实验开始时,给已禁食12 h的小鼠空腹称质量,作为初始体质量;在灌胃处理6 周后禁食12 h,处死之前称量小鼠空腹体质量,作为最终体质量,根据公式(1)计算小鼠体质量增量。处死小鼠后,取出完整的附睾脂肪称质量,根据公式(2)计算附睾脂肪指数。

1.3.2.2 Lee’s指数及体质量指数的测定
灌胃结束分别测量大鼠最终体质量和体长。根据公式(3)、(4)分别计算Lee’s指数和体质量指数(body mass index,BMI)。

1.3.3 血清脂质浓度的测定
血清TC、HDL-C和LDL-C浓度测定按照试剂盒说明操作,血清脂质与试剂反应生成的化合物颜色的深浅与脂质浓度成正比,在波长为546 nm条件下测定吸光度。
1.3.4 血清LPS水平和TNF-α质量浓度测定
小鼠禁食12 h后摘取眼球采血,血样室温静置60 min,3 000 r/min离心15 min,吸取血清置于小试管内,按照试剂盒说明操作测定血清LPS水平和TNF-α质量浓度。
1.3.5 肝脏组织和附睾脂肪组织病理学分析
处死小鼠后,取小鼠肝脏和附睾脂肪,置于质量分数4%多聚甲醛溶液中固定、石蜡包埋、切片、脱蜡、苏木精-伊红(hematoxylin-eosin,HE)染色,封片在光学显微镜下观察各组小鼠肝脏组织和附睾脂肪组织的结构变化。
1.3.6 小鼠肠道内容物的菌群分析
处死小鼠后,采用2 mL的无菌离心管收集小鼠盲肠内容物,用DNA提取试剂盒提取盲肠内容物的DNA,送于上海美吉生物医药科技有限公司扩增后进行肠道菌群16S rRNA基因高通量测序。通过单样本的Alpha多样性如Sobs、Ace、Chao1指数分析微生物群落的丰富度。分析门水平和属水平上的肠道菌群差异,并通过计算Spearman相关系数分析临床指标与不同属相对丰度之间的相关性。
1.4 数据处理与分析
实验数据以平均值±标准差表示,用SPSS 25.0软件对实验数据进行统计学分析,多组间比较采用单因素方差分析,两两样本之间采用最小显著差异法的多重比较,<0.05表示差异显著。
2 结果与分析
2.1 低聚果糖干预后对肥胖小鼠体质量变化的影响
由图1可知,与N组相比,M组体质量增长迅速,差异极显著(<0.01)。与M组相比,Y组和FH组的体质量增量差异极显著(<0.01),FL组的体质量增量差异显著(<0.05)。可见低聚果糖对于肥胖小鼠体质量增量有较好的控制效果。

图1 低聚果糖干预对肥胖小鼠体质量增量的影响Fig. 1 Effect of fructooligosaccharides intervention on body mass gain in obese mice
2.2 低聚果糖对肥胖小鼠附睾脂肪指数的影响
由图2可知,与N组相比,M组的附睾脂肪指数显著升高(<0.05),表明高脂饲料喂养后小鼠肥胖模型构建成功。与M组相比,经过6 周的奥利司他、低聚果糖的灌胃,Y、FH、FL组的附睾脂肪指数均显著下降(<0.05),表明低聚果糖与奥利司他都能有效地控制肥胖,降低附睾脂肪指数。

图2 低聚果糖干预对肥胖小鼠附睾脂肪指数的影响Fig. 2 Effect of fructooligosaccharides intervention on epididymal fat index of obese mice
2.3 低聚果糖对小鼠肥胖指标BMI和Lee’s指数的影响
BMI是目前国际上常用的衡量胖瘦程度以及是否健康的一个标准,Lee’s指数是目前评价小鼠肥胖程度的有效指数。如图3所示,与N组相比,M组的BMI和Lee’s指数都显著升高(<0.05),表示小鼠肥胖模型构建成功。图3A中,与M组相比,Y、FL组的BMI显著下降(<0.05)。图3B显示,与M组相比,Y、FH、FL组的Lee’s指数均显著下降(<0.05),可见奥利司他和高、低剂量的低聚果糖都能对小鼠的Lee’s指数产生影响。

图3 低聚果糖干预对小鼠肥胖指标BMI和Lee’s指数的影响Fig. 3 Effect of fructooligosaccharides intervention on BMI and Lee’s index in mice
2.4 低聚果糖干预对肥胖小鼠血清脂质的影响
如图4所示,与N组相比,6 周的高脂饮食喂养会导致M组血清TC、LDL-C浓度显著增加(<0.05)和HDL-C浓度降低,表明在肥胖小鼠中存在血脂异常情况。在进行干预后,发现低聚果糖和奥利司他在短时间内对TC浓度的影响较小(图4A);图4B中,与M组相比,FH组的LDL-C浓度显著下降(<0.05),Y组和FL组有明显下降趋势;图4C中,与M组相比,FL组和FH组的HDL-C浓度均显著上升(<0.05)。可见低聚果糖的干预可以调节高脂饲料喂养肥胖小鼠的血脂异常。
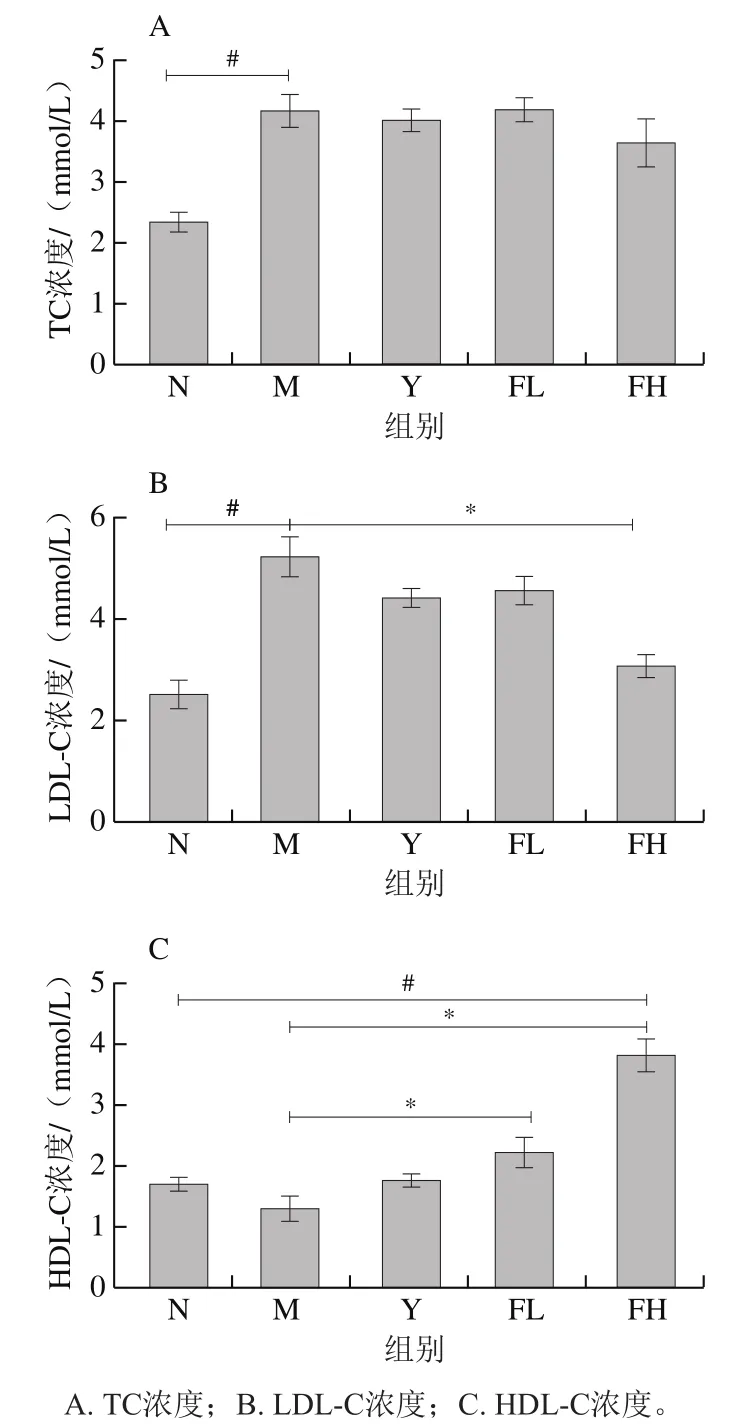
图4 低聚果糖干预对肥胖小鼠血清脂质水平的影响Fig. 4 Effect of fructooligosaccharides intervention on serum lipids of obese mice
2.5 低聚果糖干预对肥胖小鼠血清中炎症因子的影响
与N组相比,M组小鼠血清LPS水平(图5A)和TNF-α质量浓度(图5B)均显著升高(<0.05);经奥利司他、高剂量低聚果糖灌胃干预后,肥胖小鼠血清中的LPS水平、TNF-α质量浓度显著降低(<0.05)。
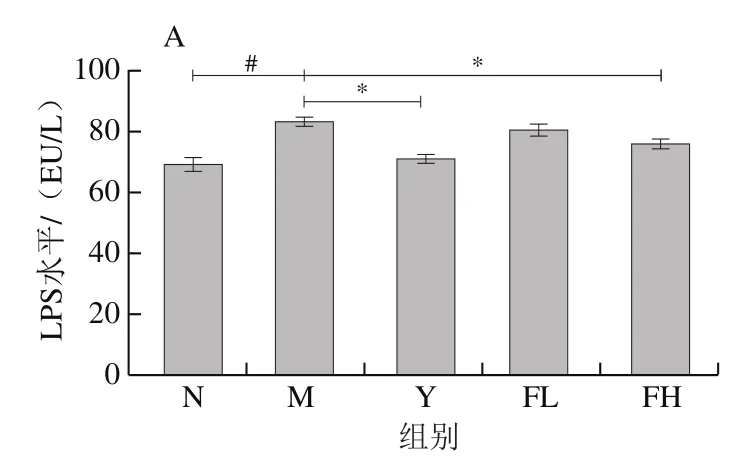
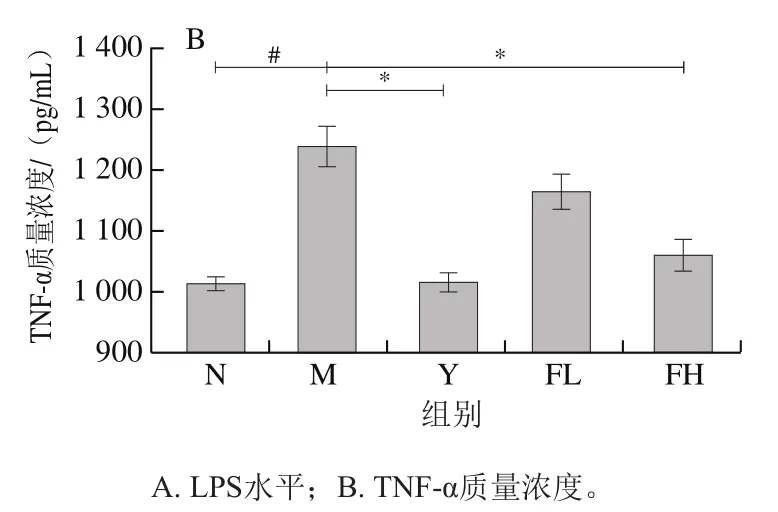
图5 低聚果糖干预对肥胖小鼠血清中炎症因子的影响Fig. 5 Effect of fructooligosaccharides intervention on serum inflammatory cytokines in obese mice
2.6 低聚果糖干预对肥胖小鼠肝脏组织结构的影响
血脂异常通常与肝脂肪代谢异常同时发生,肝脏外观如图6A所示,M组小鼠的肝脏外观发白,边缘有油腻质感,而其他组小鼠的肝脏颜色正常。光学显微镜下观察小鼠肝脏组织切片,如图6B所示,M组小鼠的肝脏HE切片出现大量脂滴,正常结构遭到破坏;与M组相比,经过奥利司他和高剂量低聚果糖灌胃干预后,FH组和Y组脂滴较小,肝脏结构较为正常。说明低聚果糖可以在一定程度上改善高脂饲料喂养肥胖小鼠的肝脏脂肪积累。

图6 小鼠肝脏组织结构Fig. 6 Morphology of liver tissues in mice
2.7 低聚果糖干预对肥胖小鼠附睾脂肪组织结构的影响
如图7所示,根据HE染色结果发现,M组小鼠的附睾脂肪HE切片脂滴较大,FL组的小鼠附睾脂肪切片与M组相比没有较大改变,FH和Y组的小鼠附睾脂肪HE切片与M组相比,脂滴较小,较为正常。

图7 小鼠附睾脂肪组织形态Fig. 7 Morphology of adipose tissue in mice epididymis
2.8 低聚果糖对肥胖小鼠肠道菌群的影响
2.8.1 低聚果糖对肥胖小鼠的肠道菌群Alpha多样性的影响
从表1可知,与N组相比,M组Sobs、Ace、Chao1指数均显著降低(<0.05),可见肥胖小鼠M组的菌群丰富度和物种多样性显著降低。但Y、FL、FH组的Sobs、Ace、Chao1指数与M组均无显著差异(>0.05),可见,低聚果糖和奥利司他对于肥胖小鼠肠道物种多样性无明显影响。

表1 低聚果糖干预对肥胖小鼠肠道菌群Alpha多样性的影响Table 1 Effect of fructooligosaccharides intervention on alpha diversity of intestinal microbiota in obese mice
2.8.2 肠道菌群物种组成与差异性分析
2.8.2.1 门水平上的菌群组成与差异性分析
如图8所示,在门水平上,与N组比,M组的厚壁菌门(Firmicutes)相对丰度显著升高(<0.05),拟杆菌门(Bacteroidota)相对丰度显著降低(<0.05);M组的弯曲杆菌门(Campilobacterota)相对丰度明显降低,脱硫弧菌门(Desulfobacterota)相对丰度明显升高。与M组比,Y、FL、FH组的Firmicutes相对丰度有降低趋势,Campilobacterota相对丰度有升高趋势;FH组的Desulfobacterota相对丰度有降低趋势;Y、FL组的Bacteroidota相对丰度有升高趋势,但无统计学意义。图8E显示,与N组相比,M组Bacteroidota/Firmicutes(B/F)比值显著降低(<0.05)。与M组相比,各干预组B/F比值无显著差异(>0.05)。
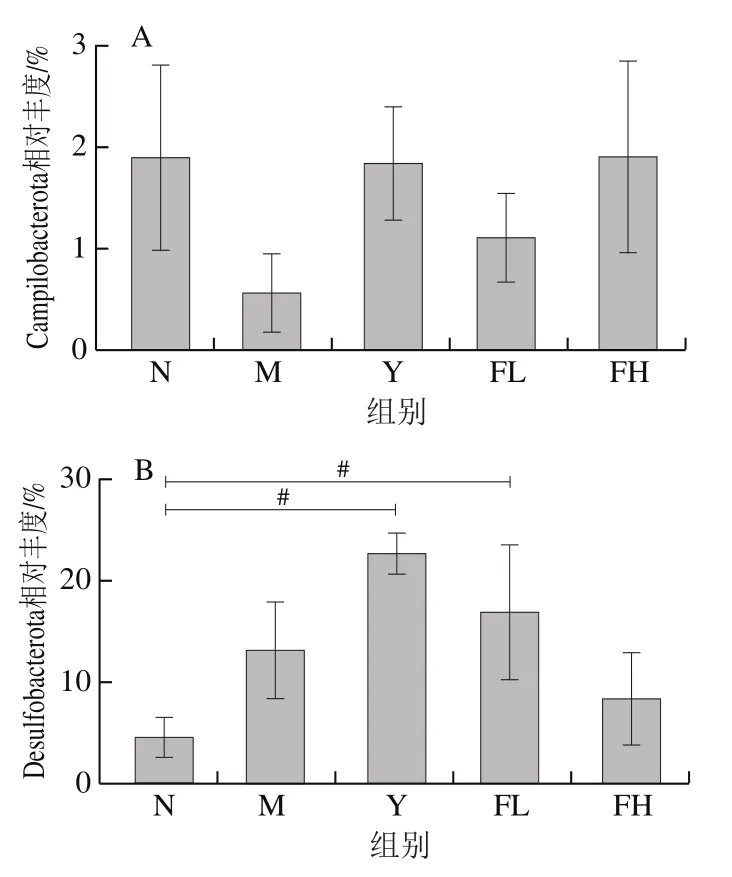
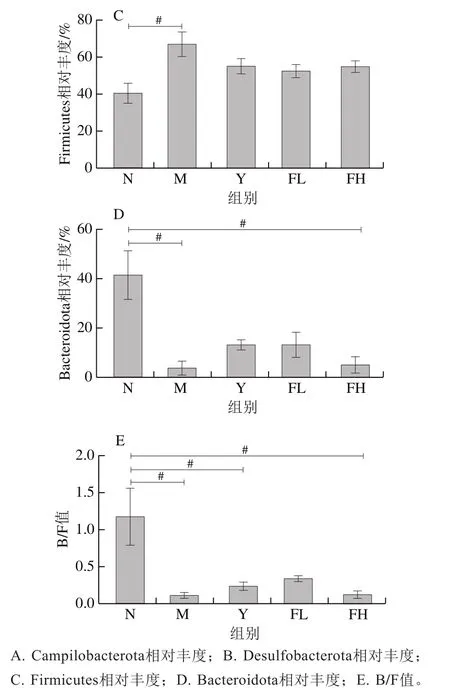
图8 低聚果糖干预对肥胖小鼠肠道菌群门水平上菌群组成的影响Fig. 8 Effect of fructooligosaccharides intervention on the composition of intestinal microflora at phylum level in obese mice
2.8.2.2 属水平上的菌群组成与差异性分析
如图9所示,在属水平上,与N组相比,M组的双歧杆菌属()和乳杆菌属()相对丰度有降低趋势,结肠杆菌属()相对丰度明显升高,但无统计学意义。与M组相比,FH、FL、Y组相对丰度明显降低、相对丰度明显升高,FH、Y组相对丰度明显升高,但无统计学意义。
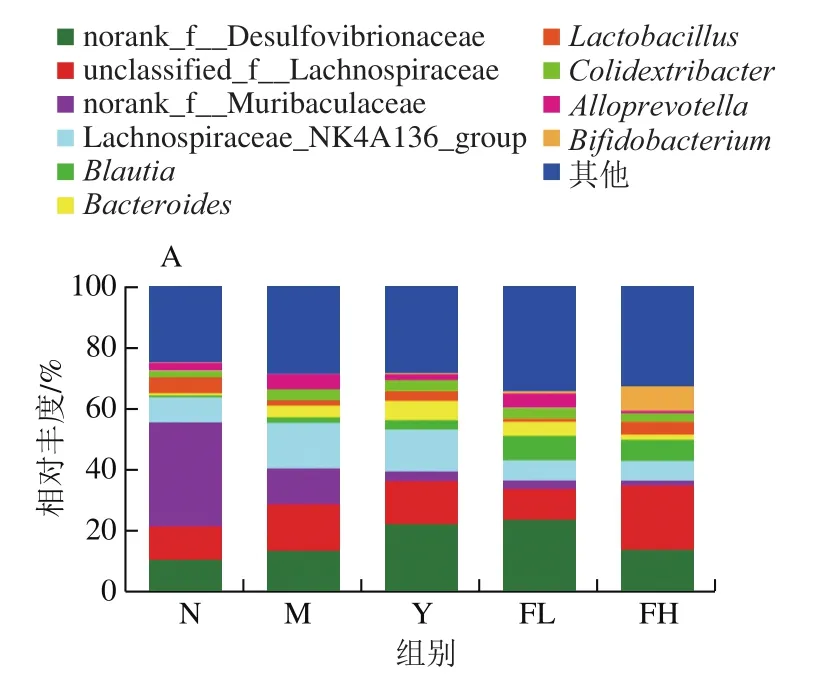
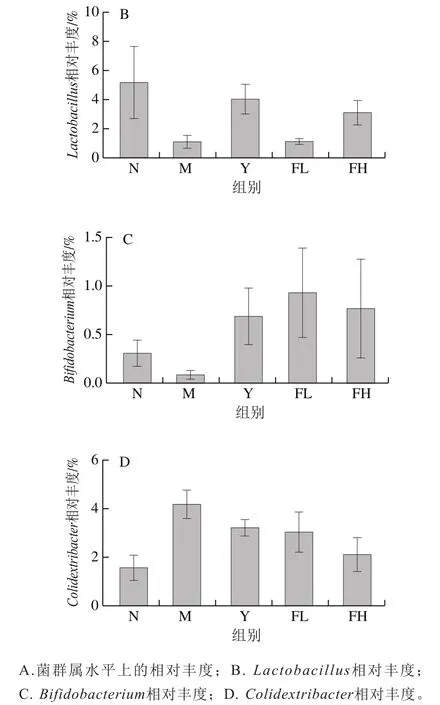
图9 低聚果糖干预对肥胖小鼠肠道菌群属水平上菌群组成的影响Fig. 9 Effect of fructooligosaccharides intervention on intestinal microflora composition at genus level in obese mice
2.8.3 低聚果糖干预的肥胖小鼠肠道菌群相对丰度与临床指标的关联性分析
如图10所示,对肠道菌群属水平进行临床因子关联性分析,相对丰度与临床指标BMI、TC浓度呈极显著正相关(<0.01),M组的相对丰度较高,经低聚果糖干预后降低,从而对肥胖指标BMI、TC浓度产生影响,在肥胖控制方面发挥作用;相对丰度与临床指标TC浓度呈极显著负相关(<0.01),FH组和Y组的相对丰度较M组升高,可见高剂量的低聚果糖和奥利司他可降低TC水平,控制肥胖;相对丰度与临床指标HDL-C浓度呈显著正相关(<0.05),FL、FH组和Y组的水平升高较明显,相对丰度的升高对肥胖有着良好的控制作用。

图10 低聚果糖干预的肥胖小鼠肠道菌群与临床因子关联性分析Fig. 10 Correlation analysis of intestinal microflora and clinical factors in obese mice treated with fructooligosaccharides
3 讨 论
肥胖现已成为中国人口健康的一个重大挑战,由于通常与高血压、血脂异常等代谢性疾病联系在一起,肥胖越来越被认为是一种需要长期治疗护理的慢性疾病,是众多不良疾病的诱发因素。肠道菌群对于获取营养和营养调节发挥重要作用,作为关键性因素参与肥胖和代谢性紊乱的发生发展,而益生元可调节肠道微生物群,从而改善肥胖。低聚果糖作为功能性低聚糖,在大量研究中显示,低聚果糖对非酒精性脂肪肝的治疗有协同作用,可预防结肠直肠癌的发生,有益于肠道疾病的早期预防和增加免疫力,可以引起肠道菌群的改变。但低聚果糖作为一种常见天然植物中可以提取的功能性成分,其改变肠道菌群与改善肥胖相关联的研究却很少。本实验通过高脂饲料喂养小鼠建立肥胖模型,给予低聚果糖干预,对干预后的小鼠进行肠道菌群分析,并与肥胖指标相联系进行研究。
本研究发现,与建立的肥胖模型相比,低聚果糖干预会显著降低肥胖小鼠的体质量增量、Lee’s指数以及附睾脂肪指数,可见对于肥胖的表观指标,低聚果糖可以发挥重要调节作用。本研究Y组的干预药物奥利司他,被公认为是控制体质量的减肥药,而低聚果糖与奥利司他可以达到相似的减肥效果。另外,脂质代谢异常在肥胖患者中普遍存在,约60%~70%的肥胖患者存在血脂异常,包括血清甘油三酯、LDL-C浓度、载脂蛋白B水平等的升高,而HDL-C浓度通常含量较低,本研究证实了血脂异常与脂质代谢密切相关。研究表明,减肥手术可显著减轻体质量并对血脂水平产生显著影响,而在本研究中低聚果糖的干预对血脂异常情况也存在一定的改善作用,低聚果糖可以显著降低肥胖小鼠的LDL-C浓度,并升高HDL-C浓度。除此之外,血脂异常通常与肝脂肪代谢异常同时发生,通过病理切片染色镜下观察,低聚果糖可以有效减少肝脏脂滴量,减少肥胖患者患心血管疾病等肥胖并发症的风险。
人体肠道内的菌群参与宿主的新陈代谢,与宿主存在着共生关系,而肥胖作为一种复杂的代谢性疾病,在新出现的证据中,肠道微生物有助于维护肠道屏障的完整性,进而影响宿主的代谢和肥胖,在慢性疾病或慢性炎症状态下,肠道屏障功能会减弱。本研究表明,肥胖模型小鼠的肠道结构破坏严重,血清炎症因子LPS水平和TNF-α质量浓度显著升高。对肥胖小鼠肠道菌群进行Alpha多样性分析可知,M组肥胖小鼠的Sobs、Ace指数和Chao1指数显著降低(<0.05),可见肥胖小鼠的肠道菌群丰富度和物种多样性显著降低,而低聚果糖干预组的Sobs、Ace指数和Chao1指数有恢复趋势。其中,M组肠道中Firmicutes、Desulfobacterota和相对丰度升高,Bacteroidetes、Campilobacterota、和相对丰度降低。低聚果糖作为不可消化的多糖,可以保护肠屏障完整性并促进有益菌的生长,缓解肠道内的菌群失调。本研究表明,经过高剂量低聚果糖的干预治疗后,M组血清中LPS水平和TNF-α质量浓度显著下降,可见低聚果糖的干预会在一定程度上缓解肠道菌群失调引起的内毒素血症,使肠道菌群构成得到一定程度的恢复,特别是升高相对丰度。双歧杆菌被认为是肠道菌群中的有益菌,研究表明其相对丰度与抗肥胖相关。另外,对肠道菌群进行临床因子关联性分析结果表明,相对丰度与HDL-C浓度存在明显正相关,与TC浓度存在极显著负相关,更加有力地说明了低聚果糖可以通过调节肠道菌群增加有益菌相对丰度减少有害菌相对丰度,进而控制肥胖。
4 结 论
低聚果糖可降低肥胖模型小鼠的体质量增量,改善血脂异常,并对肝脏脂质代谢异常也有一定的缓解作用。同时,低聚果糖促进了和的生长,并抑制了Firmicutes、Desulfobacterota和的生长。低聚果糖益生元可通过改变肠道菌群来影响宿主的代谢,进而预防和控制肥胖,减少肥胖并发症的发生,但是低聚果糖通过肠道菌群中哪些菌对肥胖及代谢产生作用及具体机制还需要进一步的研究。
