乳酸菌产苯乳酸对指状青霉的抑菌活性及作用机理
2022-09-01郭宇逍邓丽莉曾凯芳
郭宇逍,洪 阳,邓丽莉,2,曾凯芳,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
柑橘是我国重要的经济作物之一,具有丰富的营养价值和药用价值。柑橘果实在采摘、包装、贮存和运输的整个过程中都可能会受微生物侵染而发生腐烂。其中,由指状青霉()引起的绿霉病是柑橘采后主要病害之一,在干旱地区和亚热带气候区造成了严重的经济损失,约占柑橘采后损失总量的90%。目前已有的防控方法中,多菌灵和咪唑类等化学杀菌剂使用最广泛也最有效,但化学杀菌剂会引起环境污染、损害人体健康、使病原菌产生抗性等一系类问题,因此,亟待寻求一种绿色安全无污染的处理方式来减少或替代化学杀菌剂的使用。
乳酸菌在食品体系中作为生物保护菌所具有的抗真菌特性能够有效防治草莓、苹果、圣女果等果蔬采后真菌病害,其重要机制之一是能产生有机酸,主要包括乳酸、乙酸、苯乳酸(phenyllactic acid,PLA),此外还包括羟基苯乳酸和吲哚-3-乳酸等。有机酸分子在较低的pH值环境下具有抑菌活性,且具有亲脂性,可穿过细胞质膜进入细胞发生解离并释放出质子和阴离子,从而破坏膜的质子动力,抑制细胞的正常代谢活动,导致ATP产量下降。有机酸对病原菌的抑制作用还可能包括对酶活性的抑制,以及有机酸的非解离组分对病原菌细胞膜的破坏。
PLA作为乳酸菌产生的有机酸之一,可通过乳酸菌高效发酵的方式低成本大量获得,且具有广谱抑菌性,不仅能抑制肠道沙门氏菌、大肠杆菌、金黄色葡萄球菌等多种细菌生长,对青霉、黄曲霉、黑曲霉等真菌同样具有良好的抑制效果。前人研究表明,PLA主要作用于细胞膜。Liu Fang等分析发现,PLA处理改变了细胞形态,且破坏了浮游细胞细胞膜完整性,导致细胞发生不同程度的ATP泄漏并严重受损。类似的,Ning Yawei等通过流式细胞仪和透射电子显微镜分析,证明PLA处理能破坏蜡样芽孢杆菌细胞膜的完整性和形态。但也有研究认为,PLA还能够作用于细胞壁、DNA。PLA对不同病原菌的抑制效果及抑制机理不同,且目前鲜见深入研究其抗病机制的报道。
因此,本实验选择本课题组前期在泡菜中分离筛选得到的两株乳酸菌CKXP13和CWXP24作为实验菌株,这两株菌对柑橘绿霉病都有良好的控制效果。但有关乳酸菌CKXP13和CWXP24所产生的抑菌活性物质研究尚少,也鲜有研究其抑菌活性物质产量及抑菌物质作用机理的相关报道。综上所述,本实验旨在探究乳酸菌CKXP13和CWXP24的产酸能力和PLA的产量,并通过研究PLA对离体指状青霉孢子的影响初步揭示PLA的抑菌机理,同时验证PLA对柑橘绿霉病的防治效果,以期为控制柑橘采后绿霉病和抑制柑橘采后病原菌提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
丰脐橙(L. Osbeck)摘自重庆市北碚区。挑选无机械伤、无病害、成熟度和大小基本一致的果实,预冷后放至4 ℃冷库中备用。
指状青霉()为本实验室保藏,于马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基中25 ℃培养7 d,得到孢子悬浮液后用无菌蒸馏水调至所需浓度。CKXP13和CWXP24为本实验室前期实验分离保藏。色谱纯PLA上海阿拉丁生化科技有限公司。
1.2 仪器与设备
PB-10酸度计 德国赛多利斯股份有限公司;JSM-6510LV扫描电子显微镜 日本JEOL公司;SYNERGYH1MG全自动酶标仪 美国Bio-Tek公司;LC-20A高效液相色谱 日本岛津公司;DDS-307A电导率仪 上海INESA公司。
1.3 方法
1.3.1活化、发酵及产酸能力的测定
乳酸菌活化/乳酸菌悬浮液制备:从-40 ℃冰箱中取出已筛选鉴定的两株乳酸菌CKXP13和CWXP24,按1%(以体系体积计,下同)的接种量加入20 mL MRS肉汤中,37 ℃恒温培养24 h,活化2 次后待用。
乳酸菌无菌发酵液制备:以1%的接种量接种乳酸菌培养液于MRS肉汤中,37 ℃静置培养48 h。每株菌的培养液于4 ℃条件下5 000 r/min离心15 min,上清液用0.22 μm孔径水系滤头过滤除菌,4 ℃冰箱保存备用。
产酸能力的测定参照Ma Jiahong等的方法并作一定的修改,同时测定生长曲线。取活化后的两株乳酸菌培养液各1 mL加入至100 mL MRS肉汤中,37 ℃静置培养72 h,每6 h测定pH值与OD各一次,重复3 次。
1.3.2 高效液相色谱法测定无菌发酵液中PLA质量浓度
液相色谱条件:选用LC-20A高效液相色谱仪、液相色谱C柱(150 mm×4.6 mm,5 μm),Prominence SPD-M20A二极管阵列检测器。流动相A:体积分数0.05%三氟乙酸-水溶液,流动相B:体积分数0.05%三氟乙酸-甲醇溶液。流速1 mL/min、柱温30 ℃、检测波长210 nm、进样量10 μL。
梯度洗脱程序:0~20 min由10% B线性变化至100% B,20~23 min保持100% B,23~25 min由100% B线性变化至10% B,25~40 min保持10% B。
1.3.3孢子存活率的测定
在无菌蒸馏水中加入PLA,使其终质量浓度分别为2.5、5.0、10.0 mg/mL,再加入不同浓度的孢子悬浮液,使其终浓度为1×10个/mL,25 ℃环境下静置16 h,取50 μL混合液于PDA培养基上涂布培养2 d,记录培养基上的菌落总数。以无菌蒸馏水替代PLA作为对照,重复3 次。按式(1)计算孢子存活率。

1.3.4菌落直径的测定
在PDA培养基中加入适量PLA,使其终质量浓度分别为2.5、5.0、10.0 mg/mL,再接种5 μL孢子悬浮液(1×10个/mL),25 ℃环境下培养8 d,每天观察并测量菌落直径。以无菌蒸馏水替代PLA为对照,重复3 次。
1.3.5菌丝表面形态的观察
菌丝表面形态的观察参照Tao Nengguo等的方法并稍作调整,将孢子悬浮液(1×10个/mL)接种于PDB液体培养基中,25 ℃、160 r/min培养48 h,5 000 r/min离心15 min,无菌蒸馏水洗3 次,收集菌丝体,用不同质量浓度的PLA溶液(2.5、5.0、10.0 mg/mL)处理48 h,以无菌蒸馏水代替PLA作为对照。处理结束后,收集菌丝体,置于体积分数2.5%戊二醛溶液(含0.1 mol/L磷酸缓冲液,pH 6.8)中,存放于4 ℃冰箱中过夜固定。固定结束后除去固定液,用磷酸缓冲液(0.1 mol/L、pH 6.8)清洗3 次,再用乙醇梯度脱水,分别用体积分数30%、50%、70%、90%、95%乙醇溶液脱水处理一次,每次10 min;用无水乙醇脱水处理3 次,每次10 min。脱水处理之后,依次加入体积分数50%、70%、90%、95%叔丁醇溶液进行置换处理一次,每次10 min;用无水叔丁醇置换处理两次,每次10 min。最后,将样品放入恒温干燥箱65 ℃过夜干燥,挑取样品组织块粘到金属台上,进行喷金、镀膜后在扫描电子显微镜(放大倍数5 000 倍、80 kV)下观察并拍照。
1.3.6菌丝胞外电导率的测定
菌丝胞外电导率的测定参照Wang Wenjun等的方法并稍作调整,将10 mL含有孢子悬浮液(1×10个/mL)的PDB培养基置于25 ℃、160 r/min条件下振荡培养48 h。培养结束后5 000 r/min离心15 min收集菌丝体,无菌蒸馏水洗3 次,重悬于无菌蒸馏水中。取适量PLA溶液加入菌丝悬浮液中,使悬浮液中PLA终质量浓度分别为2.5、5.0、10.0 mg/mL。在处理0、3、6、9、12、24、48 h时测定胞外电导率,每组处理重复3 次,以无菌蒸馏水替代PLA作为对照。
1.3.7 柑橘果实绿霉病干预实验
柑橘果实绿霉病干预实验参照Ma Jiahong等的方法并稍作调整,柑橘果实先用体积分数2%的次氯酸钠溶液浸泡2 min,用清水冲洗后于室温下自然晾干。所有果实随机分为3 组,打孔接种前用乙醇擦拭消毒。用无菌打孔器在果实赤道部位对称打两个孔(直径3 mm、深3 mm),每个孔接种10 μL孢子悬浮液(1×10个/mL)。待果实吸收孢子悬浮液后,每个孔接种20 μL不同质量浓度PLA溶液(10、20 mg/mL)并置于室温条件下。无菌蒸馏水替代PLA作为对照,每组处理10 个果实,每个处理重复3 次。待处理液充分吸收后,将果实单果包装,贮藏于25 ℃、相对湿度95%的环境中。每天统计果实发病情况,发病率和病斑直径分别按式(2)和式(3)计算。

1.4 数据处理与分析
运用Excel 2016软件统计分析所有得到的数据,应用GraphPad Prism 8软件、Adobe Photoshop CS6软件绘制图表;运用SPSS 21.0软件对数据进行方差分析,利用Duncan’s多重比较进行差异显著性分析,<0.05表示差异显著。
2 结果与分析
2.1 L. plantarum产酸能力分析结果
如图1所示,随着培养时间的延长,两株乳酸菌数量均逐渐增加,有机酸产物不断积累,导致培养基pH值不断降低,并在72 h培养结束时均稳定在4左右。生长曲线结果表明,两株在培养6 h后均进入生长对数期,相应地,培养基pH值急剧下降,CKXP13在培养36 h后达到稳定期,CWXP24在培养42 h后达到稳定期,菌株达到稳定期后,pH值变化逐渐平缓,并最终趋于稳定。两株均具备较强的产酸能力,且有机酸产量与两株的生长趋势一致。

图1 两株乳酸菌发酵液pH值变化及生长曲线Fig. 1 pH change of cultured broth and growth curves of two strains of L. plantarum
2.2 L. plantarum无菌发酵液中PLA质量浓度
如表1所示,根据标准品的高效液相色谱结果得到标准曲线方程为=25 720+37 660,=0.998 1,再计算出无菌发酵液中的PLA质量浓度。结果表明,两株的无菌发酵液中均有PLA产生,且CWXP24显示出较高的PLA合成能力,产量可达91.9 mg/L,CKXP13的PLA合成能力相对较弱,为42.4 mg/L。

表1 两株L. plantarum无菌发酵液中PLA的产量Table 1 Concentration of PLA in cell-free culture supernatants of two strains of L. plantarum
2.3 PLA对P. digitatum的体外抑菌机理
2.3.1 PLA对孢子存活率的影响
如图2所示,PLA在2.5~10.0 mg/mL范围内均表现出对孢子较强的致死能力,且随着质量浓度的增大,对的致死能力也不断增强。2.5 mg/mL及5.0 mg/mL PLA处理组的孢子存活率分别为对照组的43.6%和18.9%,当PLA质量浓度达到10 mg/mL时,平板上已无孢子萌发,孢子存活率几乎降低至0。
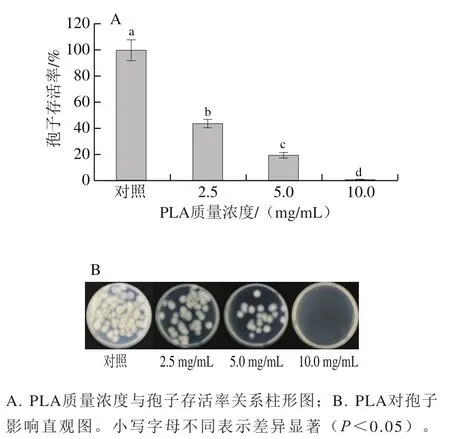
图2 PLA对P. digitatum孢子存活率的影响Fig. 2 Effects of PLA on spore viability of P. digitatum in vitro
2.3.2 PLA对菌丝生长的影响
如图3所示,在菌丝的整个生长过程中,不同质量浓度PLA均表现出对菌落生长较强的抑制能力,且随着质量浓度的增大,其对菌落生长的抑制能力也不断增强。当PLA质量浓度达到10.0 mg/mL时,菌丝生长完全被抑制。2.5 mg/mL及5.0 mg/mL处理组的菌落直径在培养8 d后分别为对照组的66.2%和28.5%。
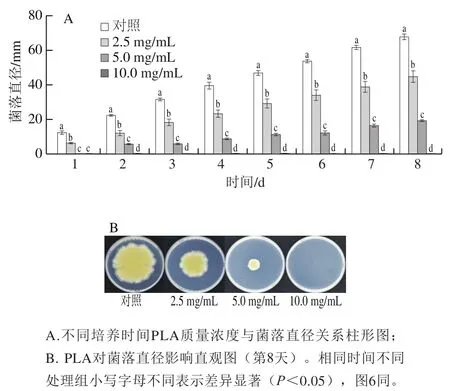
图3 PLA对P. digitatum菌丝生长的影响Fig. 3 Effect of PLA on mycelial growth of P. digitatum in vitro
2.3.3 PLA对菌丝形态的影响
如图4A所示,对照组的菌丝分布均匀,生长正常,菌丝表面平整光滑。2.5 mg/mL PLA处理组菌丝结构发生明显变化,菌丝整体分布不均匀,表面变得粗糙,出现褶皱(图4B)。高质量浓度的PLA处理组形态变化更加明显,菌丝整体分布更加不规则,并相互缠绕、扭曲,表面褶皱更加明显,出现塌陷和树瘤状凸起的情况(图4C、D)。由此推测PLA可对细胞膜结构造成破坏,从而使内容物泄漏。
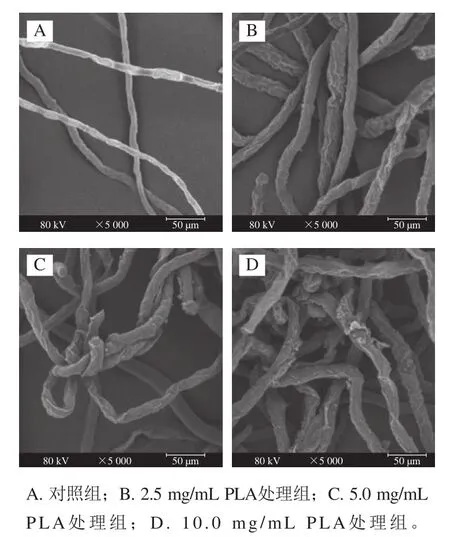
图4 不同质量浓度PLA处理对P. digitatum菌丝形态的影响(×5 000)Fig. 4 Effect of PLA on mycelial morphology of P. digitatum (× 5 000)
2.3.4 PLA对菌丝胞外电导率的影响
如图5所示,随着处理时间的延长,所有组别的电导率均逐渐升高。10.0 mg/mL PLA处理3 h时,其电导率急剧上升,达到71.0 μS/cm,明显高于对照组(27.0 μS/cm)和其他处理组。2.5 mg/mL PLA处理组在前6 h与对照组差异不明显,5.0、10 mg/ mL PLA处理48 h时,其电导率分别达到74.3、154.0 μS/cm,均明显高于对照组(57.3 μS/cm)。电导率分析结果进一步证明PLA处理可破坏菌丝细胞膜的通透性,细胞内容物向外释放,导致胞外电导率升高。

图5 PLA对P. digitatum菌丝胞外电导率的影响Fig. 5 Extracellular conductivity of P. digitatum mycelia treated with PLA
2.4 PLA对柑橘果实绿霉病的控制效果
如图6所示,10 mg/mL和20 mg/mL PLA处理均可有效控制对柑橘果实的侵染,接种后5 d内能够不同程度地抑制柑橘果实绿霉病的发生。接种后5 d,20 mg/mL PLA处理显著抑制了柑橘果实病斑直径增长,且两处理组均有效控制了柑橘果实发病初期的发病率。相对于对照组,20 mg/mL PLA处理组接种后第3天病斑直径与发病率分别显著降低了90.4%与78.0%;接种后第5天病斑直径显著降低了33.3%。10 mg/mL PLA处理组接种后第3天病斑直径与发病率分别显著降低了57.8%与49.9%;接种后第5天病斑直径降低了15.2%。
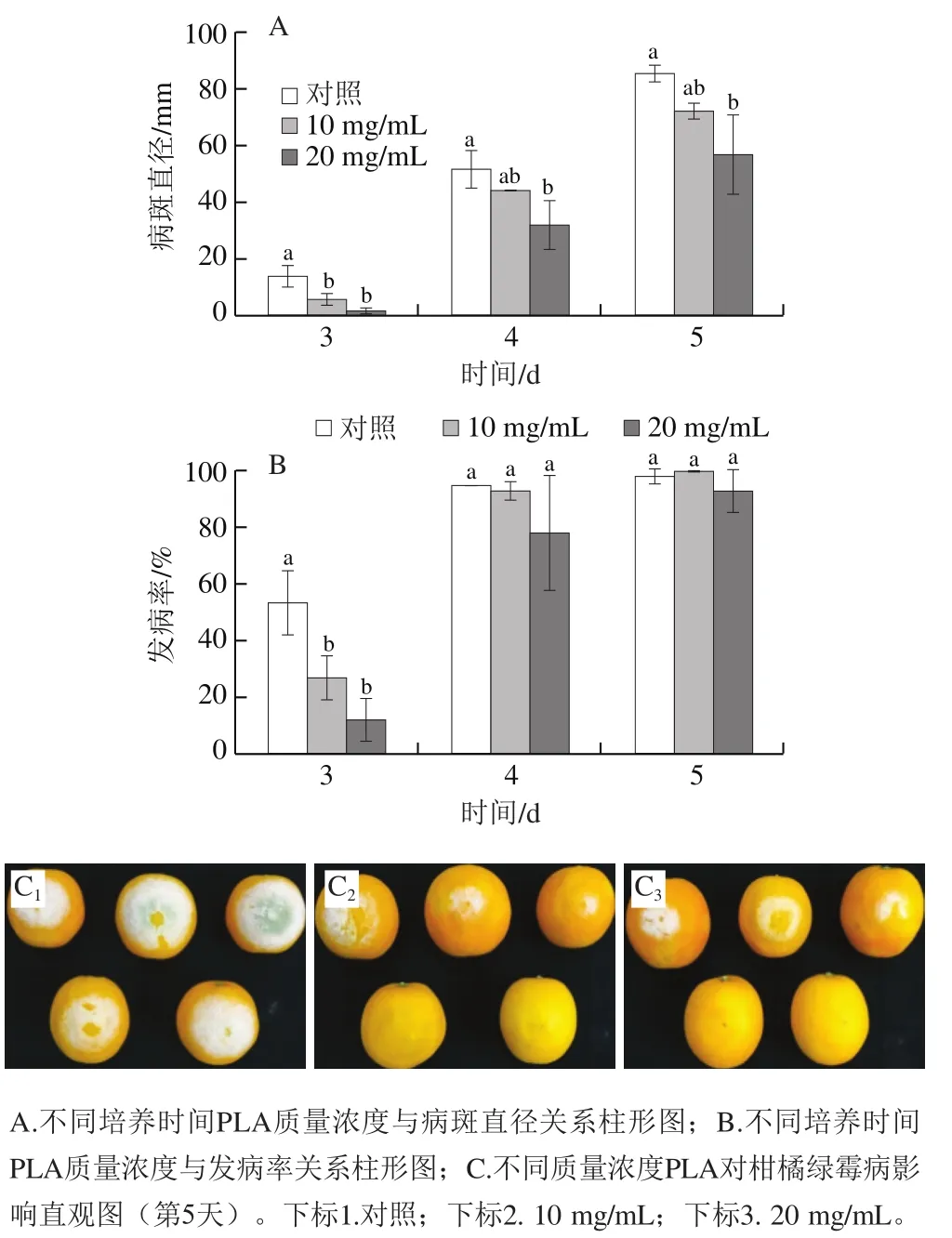
图6 PLA对柑橘采后绿霉病病斑直径和发病率的影响Fig. 6 Effect of PLA on lesion diameter and disease incidence of citrus fruit infected by P. digitatum
3 讨 论
PLA作为具有抑菌活性的天然物质,可利用乳酸菌以高效发酵的方式进行低成本的自然生产,在果蔬采后贮藏领域显示出极大的应用潜力。本研究证明了CKXP13和CWXP24均能产PLA,且PLA能有效抑制指状青霉生长,控制柑橘果实绿霉病。
PLA主要由化学合成法和生物合成法两种方法制备。相比于化学合成法,生物合成法成本低、操作简单、条件温和、对环境友好,因而受到广泛关注。其中乳酸菌中已有多个菌属被发现可产PLA,但大多乳酸菌的PLA合成量较低。本实验中两株均能分泌产生PLA,其中CWXP24在没有任何优化培养的条件下产量高达91.9 mg/L,但CKXP13产量较低,仅为42.4 mg/L,以往研究也表明,同一菌种不同菌株间的PLA产量可能存在显著差异。
本实验发现PLA质量浓度对孢子的致死效果和对菌丝生长的抑制效果呈正相关,类似地,Guimarães等发现,PLA质量浓度在0.1~8.0 mg/mL范围内,的菌落直径随PLA质量浓度升高而减小,当PLA质量浓度升至8 mg/mL时,菌落直径减小为对照的50%。本实验还对PLA可能的抑菌机理进行了初步研究,证明PLA处理对菌丝表面结构造成了严重破坏,使其发生明显改变,这一结果与前人研究PLA处理对李斯特菌的影响所得结论相似,未使用PLA处理的李斯特菌细胞分布均匀、表面平滑,0.625 mg/mL的PLA处理后细胞外表面呈不规则褶皱,PLA质量浓度增至1.25 mg/mL时细胞膜上出现孔洞或局部破裂,部分胞内物质从细胞膜渗出,形成聚集和黏附,当PLA处理质量浓度持续升高至2.5 mg/mL,细胞损伤更为严重,大部分细胞表面坍塌甚至破碎成细胞碎片,进一步说明菌丝的这些变化可能是由于细胞通透性的增加,进而导致小分子物质和离子的泄漏、细胞代谢下降,最终抑制病原菌的生长。本实验也发现PLA处理质量浓度越高,菌丝的胞外电导率增加幅度越明显,证明PLA能够增加菌丝细胞膜的通透性,使细胞内容物发生泄漏,这可能是PLA抑菌机理的重要组成部分。细胞膜作为病原菌细胞能量运输及物质传递的屏障,既能够保证细胞本身代谢稳定,又能起到调控物质在细胞内外进出与交换的作用。PLA本身为两亲性小分子,且带有正电荷,PLA的化学结构决定了其更容易吸附在细胞膜表面,与细胞膜发生作用,所以细胞膜一般作为PLA与病原菌作用的第一个靶点。但袁景环等发现,PLA处理的金黄色葡萄球菌和荧光假单胞菌培养液OD值和菌落总数均下降,说明PLA除了具有杀菌作用,还具有溶菌作用,通过扫描电子显微镜和透射电子显微镜观察还发现PLA处理后的菌体严重变形、固缩或破裂,细胞内容物外泄,推测PLA对这两种细菌的作用位点之一为细胞壁。这与Dieuleveux等报道的PLA对单核细胞增生李斯特菌的抑菌机理类似,但也可能存在其他作用靶位,因此未来还需对PLA的抑菌机制进一步研究。此外,本实验对PLA控制柑橘果实采后绿霉病的效果进行验证,发现20 mg/mL乳酸处理可显著减小柑橘果实的病斑直径,且有效控制了柑橘果实的初期发病率,这一结果表明PLA对柑橘果实采后绿霉病具有一定的抑制作用。
综上所述,本实验所选用两株乳酸菌均能产PLA,可为产PLA的乳酸菌的开发和利用提供理论参考,且PLA作为一种新型绿色保鲜剂,应用于柑橘果实采后保鲜具有一定的经济价值。
