不同品种山药蒸制过程中淀粉消化率及抗氧化活性
2022-09-01余佳浩倪晓瑜黄秀彦冯思敏
余佳浩,倪晓瑜,黄秀彦,冯思敏,邵 平,*
(1.浙江工业大学食品科学与工程学院,浙江 杭州 310014;2.金华市食品药品检验检测研究院,浙江 金华 321015)
山药是薯蓣的块茎,是继木薯、马铃薯和甘薯之后的世界第四大块根类作物。山药富含多种营养物质,特别是淀粉,约占山药总生物量的45%~64%(以干质量计)。此外,山药还富含黏蛋白、多酚、脂肪酸、胆碱、薯蓣皂苷等生物活性成分。因此,山药被广泛认为是一种能够改善脾胃、调节肠道功能的药食两用食材。蒸汽蒸煮是食品加工常用的方法之一,也是最传统的熟制方式。山药经过蒸制后,内含的某些化学成分可能会发生相互作用,导致性状、品质等改变,且不同的加工条件也会对生理活性物质的含量有不同影响。
不同品种山药块茎间营养成分含量不同,蒸食品质也存在较大差异,市场上常见的山药品种主要有铁棍山药、淮山药、麻山药、大和长芋山药及糯山药等。新鲜山药的含水量高、贮藏稳定性差,常温贮藏易变质,会对其品质和口感造成不利影响。李彬对山药淀粉加工品质进行了系统的研究,发现山药淀粉颗粒主要呈椭球形或扁圆形,结晶结构为C型,但其并未分析不同品种山药的淀粉消化率及抗氧化能力在加工中的变化。李煜芳研究发现烹饪加工会破坏紫山药淀粉的结构,进而提高其消化率,且加工的紫山药样品结构和消化特性受加工方式和时间的影响。然而,其他品种山药在热处理过程中其微观结构和淀粉消化品质变化的内在联系还不清楚。Chen等研究了不同加热温度对山药抗氧化活性的影响,结果表明,随加热温度升高,所有品种山药粗提物的总酚含量及抗氧化活性均降低。综上,热处理会影响山药淀粉结构和消化率、酚类等活性成分含量及其抗氧化活性。
一般而言,常规蒸制处理不可避免地会造成山药组织软化破碎,从而可能导致山药中营养(尤其是淀粉)、活性成分的流失或破坏。天然基质和微观结构的破坏也会促进消化过程中淀粉等化合物的释放、转化和吸收。另外,多酚和黄酮化合物很可能与淀粉形成复合物,从而会影响淀粉的消化,如荞麦中存在的大量芦丁和槲皮素会结合淀粉分子形成复合物,从而抑制淀粉酶的催化,降低消化速率。酚类化合物也是山药中主要的抗氧化活性成分,能减轻细胞应激损伤,维持细胞结构。然而,蒸制处理很可能对它们产生一定负面影响。以藜麦为例,蒸煮过程会破坏其组织结构,导致酚类、黄酮类成分大量流失,使其抗氧化能力下降。综上,酚类化合物不仅是山药的抗氧化活性成分,而且对于维持细胞结构和淀粉的消化特性都有重要的影响。
目前鲜见关于蒸制对不同品种山药淀粉消化率、理化性质和生物活性等方面影响的系统研究。本实验以铁棍山药、淮山药和糯山药为原料,以未经蒸制处理的生山药为对照,系统研究不同品种山药的淀粉消化率、总黄酮和总酚含量、抗氧化活性和微观结构在蒸制过程中的变化,为山药的加工及在相关食品中的应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
铁棍山药、淮山药、糯山药均购于浙江杭州德胜菜市场,新鲜无损伤。
葡萄糖淀粉酶(100 000 U/mL)、-淀粉酶(3 700 U/mL)、葡萄糖氧化酶/过氧化物酶试剂盒北京索莱宝科技有限公司;猪胰腺-淀粉酶(13 U/mg)、淀粉葡糖苷酶(70 U/mg)、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、没食子酸标准品、芦丁标准品 上海源叶生物科技有限公司;酶制剂均为生物制剂;其他试剂均为国产分析纯。
1.2 仪器与设备
X’Pert PRO型X射线衍射仪 荷兰PANalytical公司;SU8010型场发射扫描电子显微镜 日本Hitachi公司;Nicolet 6700型傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;R-1001VN型旋转蒸发仪 郑州长城科工贸有限公司;Synergy2型多功能酶标仪 美国Bio-Tek公司;TGL-16型台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;WHA-4142A多功能电热锅浙江奥克斯集团有限公司。
1.3 方法
1.3.1 山药蒸制预处理
分别取铁棍山药、淮山药、糯山药3 个品种的山药块茎各100 g,清洗、去皮、切片(厚约0.3 cm)。每个品种山药平均分为4 组,每组25 g,其中一组不经任何处理,标记为Raw。另外3 组样品进行蒸制处理:不锈钢锅中加入1 000 mL水,加热至沸腾,将3 组样品分别放置在蒸笼上,设置3 组样品的蒸制时间分别为10、15、20 min,分别记为S-10、S-15和S-20。将处理好的3 种山药样品按蒸制时间分别密封在12 个聚乙烯袋中,标记后低温存放备用。
1.3.2 山药淀粉相关理化性质测定
1.3.2.1 总淀粉、表观直链淀粉和可溶性直链淀粉含量的测定
总淀粉含量测定:根据Jiang Xue等报道的方法,采用酶促水解法来测定山药样品的总淀粉含量。于620 nm波长处测定吸光度,并绘制葡萄糖质量-吸光度()标准曲线。游离葡萄糖和总葡萄糖含量分别用每100 g干基中的葡萄糖质量表示。样品的总淀粉(total starch,TS)含量(以干质量计,后同)按式(1)计算。

式中:为总淀粉含量/(g/100 g);为总葡萄糖含量/(g/100 g);为游离葡萄糖含量/(g/100 g)。
山药样品表观直链淀粉和可溶性直链淀粉含量的测定均参照Sun Qingjie等提出的方法进行,不溶性直链淀粉含量为表观直链淀粉含量与可溶性直链淀粉含量之差。
1.3.2.2 快速消化淀粉、缓慢消化淀粉与抗性淀粉含量的测定
根据戚明明等使用的体外模拟酶水解法测定淀粉的体外消化性。快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)含量分别按公式(2)~(4)计算。
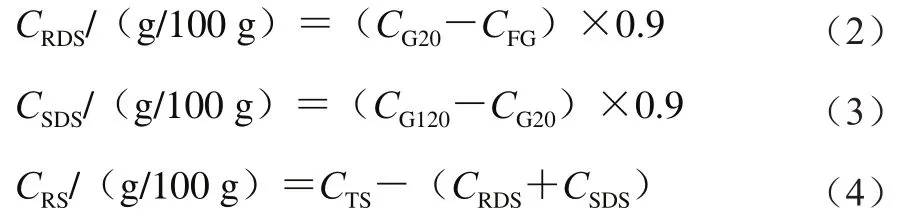
式中:为水解20 min后的葡萄糖含量/(g/100 g);为水解120 min后的葡萄糖含量/(g/100 g);为水解0 min时的游离葡萄糖含量/(g/100 g);为样品的总淀粉含量/(g/100 g)。
1.3.2.3 持水力的测定
持水力的测定参考Chen Xuetao等的方法稍加修改。称取山药样品2.5 g,加入至37.5 mL蒸馏水中,将悬浊液在恒温恒速磁力搅拌器上搅拌(20 ℃、860 r/min)1 h,随后3 000 r/min离心10 min,弃去上层清液,然后称取湿山药样品沉淀的质量。持水力按式(5)计算。
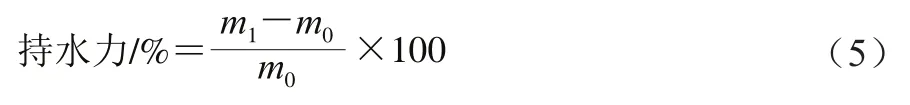
式中:为山药样品沉淀的质量/g;为初始质量/g。
1.3.2.4 溶解度的测定
参考Jiang Qianqian等的方法测定溶解度。将配制好的山药样品水悬浮液分别于50、60、70、80 ℃和90 ℃下水浴振荡加热1 h,3 000 r/min离心15 min,样品冷却至室温。上清液倒入蒸发皿中,并在110 ℃的烘箱中干燥至恒质量。溶解度按式(6)计算。

式中:为上清液干燥后的质量/g;为山药样品的干质量/g。
1.3.2.5 微观结构观察
使用扫描电子显微镜分析山药样品的表面形貌。将山药样品铺在金属片上,10 mA喷金40 s以使样品导电,将样品固定在扫描电子显微镜样品托上,抽真空,工作电压10 kV,扫描拍照。使用Image-Pro Plus软件分析图像。
1.3.2.6 X射线衍射观察
使用全解析X’Pert-PRO X射线衍射仪,在工作电压40 kV、工作电流40 mA下,以经过Ni过滤的CuKα辐射(=1.540 56 Å),并对山药样品的X射线衍射图进行分析。在4°~45°(2)的角度范围内检测,扫描速率为2(°)/ min,步长为0.04°。样品的结晶度用MDI Jade 6软件进行定量。该软件可通过峰拟合自动计算相对结晶度,即X射线衍射图上衍射曲线与基线之间的结晶区面积与总面积的比值。
1.3.2.7 傅里叶变换红外光谱分析
将山药样品与溴化钾按1∶100的质量比混合,充分研磨。取约60 mg混合粉末压片,作为测试样品。以溴化钾压片作为背景,将测定样品置于红外光谱仪的样品室,光谱分辨率为10 cm,扫描范围为4 000~500 cm,信号扫描累加32 次。通过Omnic 8.2软件对得到的光谱进行标峰与分析,并用Origin 8.0软件作图。
1.3.3 山药样品中生物活性物质含量测定
1.3.3.1 总黄酮含量测定
按照Jiang Guihun等的方法测定总黄酮含量。总黄酮含量以每克干质量样品中所含的芦丁质量表示,单位为mg/g。
1.3.3.2 总可溶性多酚含量测定
总可溶性多酚含量测定参考Jiang Guihun等的方法。总可溶性多酚含量以每克干质量样品中所含没食子酸质量表示,单位为mg/g。
1.3.4 山药样品的抗氧化活性测定
1.3.4.1 铁离子还原力测定
铁离子还原力测定参考Chen等的方法,以每克干质量样品中所含抗坏血酸物质的量表示铁离子还原力,单位为μmol/g。
1.3.4.2 DPPH自由基清除能力测定
DPPH自由基清除率的测定参考Chandrika等的方法。
1.3.4.3 羟自由基清除能力测定
羟自由基清除率的测定参考Chandrika等的方法。
1.4 数据处理与分析
实验测定均重复3 次,取平均值,实验数据用Microsoft Excel 2007软件计算标准偏差,采用SPSS 20.0软件进行方差分析,用Duncan’s多重差异显著分析,以<0.05表示差异显著;并用Origin 8.0软件作图。
2 结果与分析
2.1 蒸制对山药淀粉相关理化性质的影响
2.1.1 蒸制对山药总淀粉、快速消化淀粉、缓慢消化淀粉与抗性淀粉含量的影响
3 种山药样品的总淀粉含量在62.25~76.87 g/100 g范围内,与生山药样品相比,蒸制山药的总淀粉含量显著降低,且随蒸制时间延长,淀粉含量呈下降趋势(表1)。其中,铁棍山药S-20的总淀粉含量最低(62.25 g/100 g)。山药经过不同时间的蒸制处理后,抗性淀粉含量降低,而快消化淀粉和慢消化淀粉含量升高。经蒸制处理后,各品种山药的抗性淀粉含量范围为28.53~44.61 g/100 g,明显低于生山药样品中的抗性淀粉含量(52.53~58.68 g/100 g)。
2.1.2 蒸制对山药表观直链淀粉、可溶性直链淀粉和不溶性直链淀粉含量的影响
如表1所示,3 种山药样品经蒸制处理后的表观直链淀粉含量范围为10.66~14.12 g/100 g,生山药样品的表观直链淀粉含量范围为9.55~12.28 g/100 g,且每个品种生山药中的表观直链淀粉含量均低于相应品种的蒸制山药;而蒸制山药中的可溶性直链淀粉含量范围为3.20~7.65 g/100 g,均低于相应品种的生山药(7.20~9.27 g/100 g)。另外,蒸制处理后山药样品中的不溶性直链淀粉含量显著增加。
2.1.3 蒸制对山药样品水分结合能力和溶解度的影响
与生山药相比,蒸制处理后所有山药样品的持水力呈上升趋势(表1)。其中,糯山药的持水力从149.54%增加至172.81%~180.92%,说明蒸制处理提高了山药样品的持水力。如表2所示,受试山药样品的溶解度随温度的升高而增加,且山药样品经蒸制处理后的溶解度降低。生糯山药在50~90 ℃的溶解度最高,溶解度范围为24.86%~41.57%;溶解度最低的是铁棍山药S-20,溶解度范围为12.64%~21.09%。

表2 不同蒸制时间处理山药样品的溶解度Table 2 Solubility of yam samples steamed for different periods of time
2.1.4 蒸制对山药微观结构的影响
图1是3 种生山药样品及经不同蒸制时间处理山药样品的扫描电子显微镜图。观察发现,尽管一些颗粒的形状不规则,但未经蒸制处理的山药样品颗粒仍大多为椭球形或球形,颗粒的表面大多比较光滑,在Yu Bin等的研究中也观察到了相似的结果。而经蒸制处理过的山药样品,颗粒呈特征性的块状和不规则的结构,有些淀粉颗粒被分解成小块,但大多数淀粉颗粒已变成大块,且表面粗糙有裂缝。随蒸制时间延长,这种不规则性愈加明显,表面更粗糙,说明蒸制破坏了山药的表面形态。


表1 不同蒸制时间处理的山药样品中淀粉含量及持水力Table 1 Starch contents and water-binding capacity of yam samples steamed for different periods of time

图1 不同蒸制时间处理山药样品的扫描电子显微镜图Fig. 1 Scanning electron microscopic images of yam samples steamed for different periods of time
2.1.5 蒸制对山药样品结晶度的影响
3 种生山药样品及经不同蒸制时间处理的山药样品X射线衍射图如图2所示,各样品呈现出明显的特征衍射峰。生糯山药样品呈现典型的C型结晶结构(A型和B型多晶物的结合),即在2分别为15°、17°、18°附近有特征吸收(典型的A型特征吸收),在22°~24°附近有双峰(典型的B型特征吸收)(图2C)。而生铁棍山药和生淮山药样品呈现典型的A型结晶结构(图2A、B)。随蒸制时间延长,铁棍山药和淮山药样品在2为15°和17°处的衍射峰逐渐变宽,峰强度逐渐变弱,22°~24°处的二重峰分辨率逐渐清晰,这两种山药样品的晶型由A型衍射峰变为C型衍射峰。同时,蒸制造成了相对结晶度显著降低,且蒸制时间越长,相对结晶度越小。经蒸制处理的山药样品结晶度在5.12%~19.58%范围内,均低于生山药的结晶度(23.15%~33.62%)(表3)。

图2 不同蒸制时间处理山药样品的X射线衍射图Fig. 2 X-ray diffraction patterns of yam samples steamed for different periods of time

表3 不同蒸制时间处理山药样品的相对结晶度Table 3 Relative crystallinity of yam samples steamed for different periods of time
2.1.6 蒸制对山药样品结晶结构的影响
淀粉的傅里叶变换红外光谱对分子水平(短程有序)的结构变化(如链构象和双螺旋次序的变化)敏感。受试山药样品在4 000~500 cm波数范围内的红外光谱如图3所示。在3 440 cm(3 050~3 770 cm)处的宽峰为O—H伸缩振动所引起,2 929cm处的尖峰是次甲基—CH中的C—H伸缩振动所引起。而在1 632 cm处的尖峰则归因于羰基—C=O的伸缩振动。此外,在800~1 200 cm范围内有以下主要吸收峰:995、1 022 cm和1 047 cm。在1 047cm和1 022 cm处的吸收峰分别与淀粉的有序结构和无定形结构有关,而995 cm处的吸收峰与单螺旋晶体结构有关。
1 047 cm与1 022 cm处的吸收峰强度比值()是红外光谱图的重要参数,用来表示淀粉有序结构和无序结构的比例,比例越高表示淀粉的结晶结构越多。由图3可以看出,生淮山药样品的最大(1.043 3),而淮山药S-20的最小(1.006 1)。与生山药样品相比,经蒸制山药样品的较小,且随蒸制时间延长,逐渐降低,这与相对结晶度的变化趋势一致。
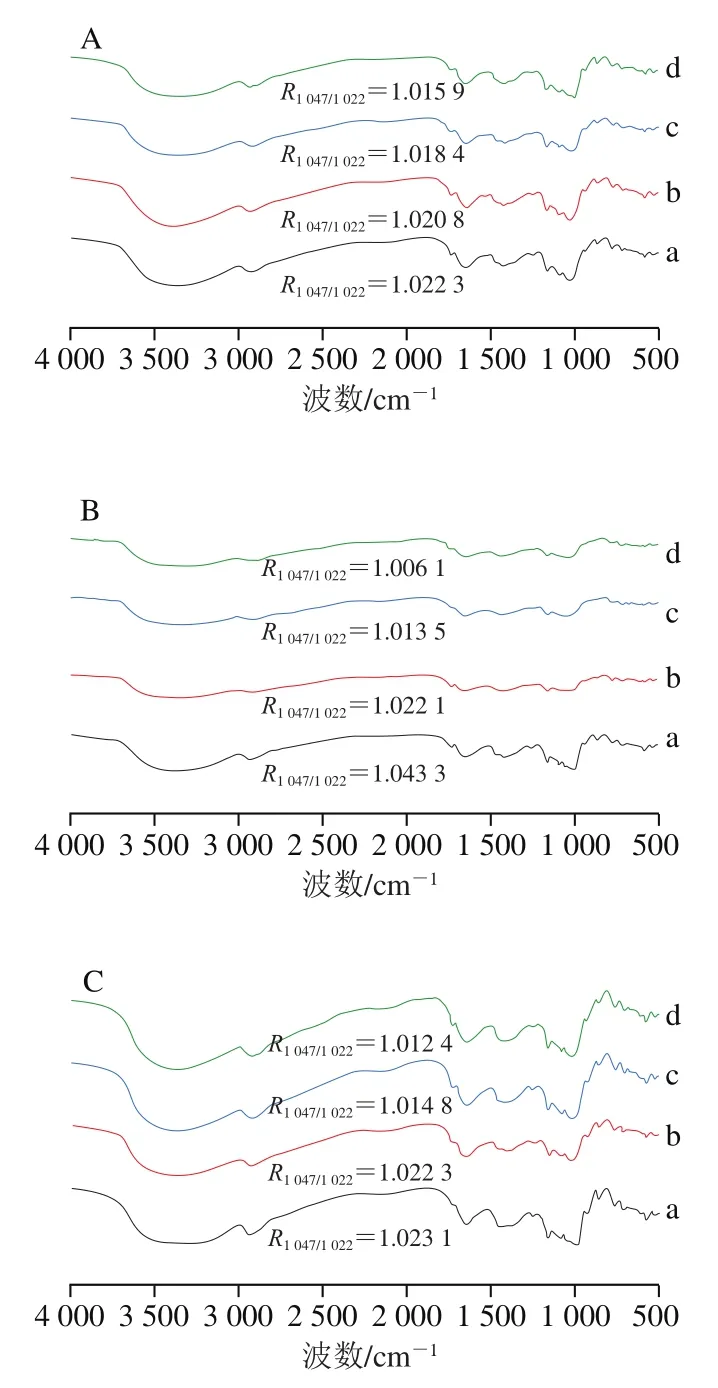
图3 不同蒸制时间处理山药样品的红外光谱图Fig. 3 Infrared spectra of yam samples steamed for different periods of time
2.2 蒸制对山药样品中生物活性物质和抗氧化能力的影响
2.2.1 蒸制时间对山药样品中生物活性物质的影响
多酚和黄酮是山药中的主要活性物质,与山药的抗氧化活性紧密相关,其在烹饪过程中的含量变化如图4所示。随蒸制时间延长,相同品种蒸制山药的总可溶性多酚与总黄酮的含量均呈先上升后下降的趋势;与生山药样品相比,蒸制显著提高了这两种活性成分的含量,其中淮山药S-15的可溶性多酚和总黄酮的含量最高,分别为1.04 mg/g和0.83 mg/g。生糯山药样品的可溶性酚和总黄酮含量最低,分别为0.62 mg/g和0.36 mg/g。

图4 不同蒸制时间处理山药样品的活性成分含量Fig. 4 Bioactive components of yam samples steamed for different periods of time
2.2.2 蒸制时间对山药样品抗氧化能力的影响
本实验中山药样品的抗氧化能力通过铁离子还原力、DPPH自由基清除率和羟自由基清除率来表示。如图5所示,与生山药相比,蒸制后的3 种山药样品均显示出较高的抗氧化性能。随蒸制时间延长,3 种山药的抗氧化活性均呈先上升后下降的趋势,这与可溶性多酚和黄酮含量的变化趋势一致。同样的蒸制时间,淮山药样品的铁离子还原力始终是3 个品种中最高的,淮山药S-10、S-15和S-20的铁离子还原力分别为118.15、165.56、137.15 μmol/g。同时,淮山药S-15的DPPH自由基清除率也最高(58.15%),DPPH自由基清除率最低的是生铁棍山药(16.93%)。相同蒸制时间处理的3 种山药中,淮山药S-15的羟自由基清除率最高(82.26%),糯山药的羟自由基清除率比其他两种略低,生糯山药样品的羟自由基清除率仅为39.21%。
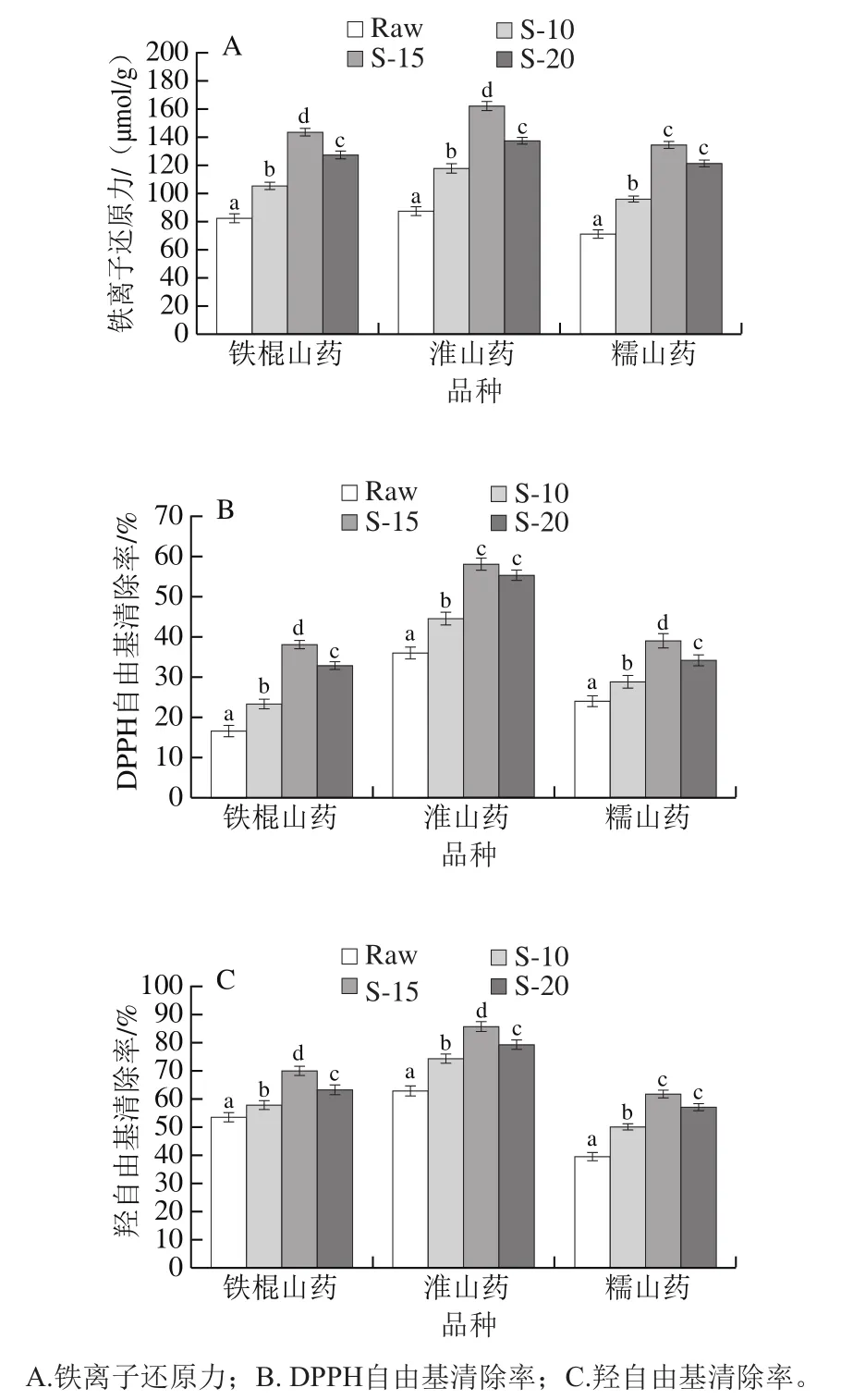
图5 不同蒸制时间处理山药样品的抗氧化性能Fig. 5 Antioxidant activity of yam samples steamed for different periods of time
3 讨 论
3.1 蒸制对山药样品淀粉相关性质的影响
蒸制是食品加工烹饪过程中的常用手段,不同的蒸制温度、压强或时间等都可能影响食品的理化性质和生物活性成分含量。山药中含有大量淀粉,高温会使淀粉糊化进而引起相关性质发生改变,不同品种山药样品中的淀粉性质变化也有所差异。同时,山药样品中含有的多酚、黄酮等生物活性成分也是影响山药抗氧化性能的主要因素。
本实验结果表明,蒸制处理后3 种山药中的总淀粉含量和抗性淀粉含量均减少,但可消化淀粉含量显著增加。这可能是因为生山药样品的淀粉表面较光滑,淀粉与酶的结合位点数量较少。蒸制后山药样品快速升温,抗性淀粉颗粒结构被破坏,虽有一些淀粉颗粒被细胞壁包裹,但较长时间的高温处理使细胞壁破碎,暴露出更多的结合位点;另外,蒸汽凝结所形成的水也会冲刷掉一小部分淀粉,造成淀粉损失。直链淀粉溶解相关酶的活性最佳温度在55 ℃和60 ℃之间,而蒸汽温度较高,能够使山药样品中的部分酶失活,降低了蒸制山药中可溶性直链淀粉的含量。蒸制过程中直链淀粉的降解和重排导致直链淀粉-直链淀粉、直链淀粉-支链淀粉链间以及直链淀粉-脂质的相互作用增强。这些因素都可能使山药样品中的不溶性直链淀粉含量增加,也是引起蒸制样品溶解度降低的主要原因。Cooke等提出淀粉颗粒的稳定性取决于其双螺旋层结构是否稳定。蒸制导致山药样品淀粉双螺旋结构打开、淀粉颗粒的稳定性下降,进而引起淀粉溶解度下降。
通过山药样品的扫描电子显微镜图发现蒸制样品的大部分淀粉颗粒已经糊化,这是由于直链淀粉从原淀粉中溶出,淀粉颗粒重新结合形成较大块状,其表面形态被严重破坏。糊化后的淀粉吸水溶胀,是引起蒸制后山药样品持水力增强的主要原因。当蒸汽遇冷凝结成水珠后会提供淀粉凝胶化所需要的水分,破坏了山药结构。淀粉结晶度的不同是由于支链淀粉双螺旋结构的定向排列顺序、支链淀粉的平均链长以及支链淀粉中短链成分的物质的量比有所不同。Wang Shujun等报道在淀粉糊化的过程中会发生两大转变,结晶在较低的温度下向各向同性或各向异性转变,在更高的温度下向螺旋线圈转变,这些转变导致结晶度降低。
3.2 蒸制对山药粉生物活性成分及抗氧化性的影响
热处理导致山药结构破坏,有利于酚类物质的溶出和提取,刺激与大分子结合的多酚类物质的释放,形成游离的酚类化合物。但加热过程中细胞破裂会引起氧化和水解酶的释放,若蒸制时间过长则会使部分酚类物质被氧化或发生热降解。研究表明,蒸制提高了冷冻蔬菜中的总酚含量和总抗氧化能力。黄酮含量的变化原因与可溶性酚类似,温和的加热过程在一定程度上有利于结合态黄酮的释放。在蒸制初期,温度上升较快,导致淀粉糊化,从而使与大分子物质结合的黄酮类物质释放出来,随蒸制时间的延长,结合黄酮受热分解,一部分转化成游离态黄酮,从而导致含量降低。山药中抗氧化活性物质主要有酚类物质(主要是黄酮)、VE、VC、超氧化物歧化酶,其中酚类物质起主要作用。目前蒸制对食品抗氧化活性的影响研究结果不一,但绝大多数文献报道其能够增强抗氧化活性,这是因为对助氧化剂起主要作用的氧化酶在高温下会失活。由于非酶褐变反应也会生成一些抗氧化物质,蒸制后总酚含量虽下降,但游离酚含量却会上升。另外,黄酮糖苷衍生物也会分解为相应的抗氧化能力更强的配基体。总地来看,抗氧化性的变化趋势与总酚和黄酮含量的变化趋势一致,说明蒸制在一定程度上可以提高山药的抗氧化性,但应合理地控制蒸制时间。
4 结 论
本实验结果表明,蒸制增加了山药中可溶性多酚和总黄酮的含量,提高了山药的抗氧化活性。然而,高温导致山药淀粉发生很大程度的糊化,破坏了山药淀粉颗粒的结构特征,降低了山药样品的结晶度,这些因素使山药淀粉链在受到酶的攻击后暴露出更多结合位点,提高了山药淀粉消化率。总之,蒸制对山药理化性质的影响很大程度上与淀粉颗粒的功能性和结构改性有关。适度蒸制处理能提高山药的淀粉消化率和抗氧化活性。因此,在实际生产加工过程中应注意合理控制蒸制时间。
