QuEChERS-UPLC-MS/MS法同时测定刺梨中11 种农药残留
2022-09-01姚小龙刘旭东安华明吴小毛
姚小龙,韩 磊,刘旭东,罗 跃,吴 琼,安华明,吴小毛,*
(1.贵州大学作物保护研究所,贵州 贵阳 550025;2.贵州省植保植检站,贵州 贵阳 550001;3.贵州省果树工程技术研究中心,贵州 贵阳 550025)
刺梨(Tratt.)学名缫丝花,属蔷薇科蔷薇属植物,又名山王果、刺莓果、佛朗果、茨梨、木梨子,别名刺菠萝、送春归、刺酸梨子、刺梨蔷薇、九头鸟、文先果、刺石榴(陕西),是一种稀有的、滋补健身的营养珍果。刺梨主要以贵州、四川、云南、湖北、湖南分布面积大,产量多,其中贵州省的野生刺梨分布最多,也是该省特有的优势资源。刺梨果实富含多种维生素、氨基酸和微量元素以及胡萝卜素、有机酸、黄酮、-谷甾醇、超氧化物歧化酶(superoxide dismutase,SOD)等,其中,每100 g刺梨果肉中,含VC 2 054~2 725 mg、VP 5 980~12 895 mg、SOD活力32 100 U,远超过猕猴桃、柑橘、树莓等水果,是当之无愧的“VC之王”和“三王之果”,也是目前世界上第三代水果之冠。
近年来,随着刺梨栽培面积的不断扩大,各种病害如刺梨白粉病、褐斑病、烟煤病、茎腐病、病毒病等,虫害如梨小食心虫、小实蝇、蚜虫、粉虱、介壳虫等,杂草如马塘、酢浆草、牛筋草、狗尾草、马齿苋等病虫草害问题逐渐凸显。虽然中国农药信息网并未登记有农药可在刺梨生产上使用,但通过对贵州刺梨主产区进行调研发现,果农为了保产,常使用苯醚甲环唑、吡虫啉、吡唑醚菌酯、敌草隆、啶虫脒、多菌灵、腈菌唑、氯虫苯甲酰胺、醚菌酯、嘧菌酯、三唑酮等杀虫剂、杀菌剂以及除草剂以达到快速防治病虫草的目的。在即将实施的GB 2763—2021《食品中农药最大残留限量》标准中也未规定有关刺梨的农药最大残留限量,所以上述农药在刺梨生产上长期施用,是否会有残留,残留量多少以及对刺梨的质量安全会不会造成影响,都有待研究。因此,有必要开展刺梨上常用农药快速分析方法的研究,为刺梨上农药的使用、监管提供技术支撑。
目前,水果中常用的农药检测方法有气相色谱法、气相色谱-串联质谱法、液相色谱法、液相色谱-串联质谱法。常用的样品前处理技术有QuEChERS(quick, easy, cheap, effective, rugged and safe)法、固相微萃取法、微波萃取法等,其中QuEChERS法从诞生之初就被用作果蔬中农药残留的前处理方法,由于其快速简便的特点,逐渐被推广至更大的检测范围和基质中,成为了农药残留快速前处理技术的首选。如今QuEChERS法已广泛应用于色谱-串联质谱分析果蔬中农药残留的研究。目前已有文献报道气相色谱-串联质谱法分析刺梨中多种有机氯农药残留的研究,但根据实际调研结果看,有机氯类农药在刺梨生产上并不常用,而且气相色谱不易分析一些极性强、热稳定性差的农药,所以急需建立一种可靠性高、稳定性好、检测范围广的液相色谱-串联质谱法。同时由于刺梨样品基质复杂,含有较多的维生素、SOD、有机酸以及刺梨苷和黄酮类活性物质,会对农药的提取产生干扰,提取率低,并会产生较强的基质干扰而对检测结果的准确性产生影响,导致刺梨中农药残留的提取和净化更复杂,所以常规的QuEChERS方法已不能满足刺梨中农药残留检测的需求。本研究拟在充分调研刺梨生产上常用典型农药的基础上,通过优化QuEChERS前处理方法和测定条件,结合超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)检测,建立一种同时快速检测刺梨中11 种常用农药的多残留分析方法,能满足刺梨农药多残留分析检测需求,为刺梨生产上常用典型农药的检测、刺梨农药合理使用以及安全性监测工作提供技术支撑。
1 材料与方法
1.1 材料与试剂
供试11 种农药标准品:苯醚甲环唑(纯度>98%)、吡虫啉(纯度>98%)、敌草隆(纯度>99%)、啶虫脒(纯度>99%)、多菌灵(纯度>99%)、腈菌唑(纯度>98%)、嘧菌酯(纯度>99%)、三唑酮(纯度>99%) 上海阿拉丁生化科技有限公司;吡唑醚菌酯(纯度>99%)、醚菌酯(纯度>97%) 德国Dr. Ehrenstorfer公司;氯虫苯甲酰胺(纯度>95%) 上海毕得医药科技有限公司。
C(40~60 μm)、-丙基乙二胺(primary secondary amine,PSA)(40~60 μm) 天津博纳艾杰尔科技有限公司;弗罗里硅土(Florisil)(100~200 目) 国药集团化学试剂有限公司;石墨化碳黑(graphitized carbon black,GCB) 上海阿拉丁生化科技有限公司;无水硫酸镁(分析纯) 天津市永大化学试剂有限公司;氯化钠、甲醇、甲酸、乙酸乙酯、二氯甲烷、冰醋酸(均为分析纯) 天津市科密欧化学试剂有限公司;氨水(分析纯) 重庆川东化工有限公司;乙腈(分析纯) 上海阿拉丁生化科技有限公司;乙腈(色谱纯) 德国默克公司;甲酸(色谱纯)上海麦克林生化科技有限公司;纯净水 娃哈哈集团有限公司;0.22 μm滤头 广州彼西络有限公司;1 mL注射器 江西益康医疗器械集团有限公司;2 mL样品瓶美国Agilent公司。
1.2 仪器与设备
UPLC-MS/MS仪(包括1290 Infinity II超高效液相色谱仪和6470三重四极杆质谱仪) 美国Agilent公司;MS200多管涡旋混匀仪 杭州瑞诚仪器有限公司;1-16小型高速离心机 德国Sigma公司;CK2000高通量组织研磨仪 北京托摩根生物科技有限公司;BY-400B型离心机 北京白洋医疗器械有限公司;AL104分析天平上海梅特勒-托利多公司。
1.3 方法
1.3.1 样品前处理
称取10.0 g经粉碎后的刺梨样品置于50 mL离心管,加入15 mL经筛选的提取剂(乙腈)溶液振荡提取10 min,然后依次加入1.0 g氯化钠、4.0 g无水硫酸镁,振荡5 min,再4 000 r/min离心5 min。取1.5 mL上清液至装有150 mg无水硫酸镁+经筛选净化剂(50 mg PSA+5 mg GCB)的2 mL离心管中,2 000 r/min涡旋3 min,12 000 r/min离心5 min,用1 mL注射器抽取上清液过0.22 µm滤膜,供UPLC-MS/MS检测。
1.3.2 标准溶液的配制
11 种农药标准品母液(100 μg/mL):分别准确称量(精确到0.001 g)11 种农药标准品,用乙腈溶解,分别配制成100 μg/mL的标准母液,于4 ℃冰箱冷藏保存。
标准混合溶液(1 μg/mL):准确移取11 种农药标准母液各0.1 mL于10 mL容量瓶中,用乙腈定容至10 mL,于4 ℃冰箱冷藏保存。
溶剂标准工作曲线:分别向1 mL容量瓶中加入1、5、10、20、40 μL 1 μg/mL的混合标准储备液,用乙腈定容至刻度,配制成0.001、0.005、0.01、0.02、0.04 μg/mL的溶剂标准混合工作溶液,现配现用。
基质标准工作曲线:分别向1 mL容量瓶中加入1、5、10、20、40 μL 1 μg/mL的混合标准储备液,用空白样品提取液定容至刻度,配制成0.001、0.005、0.01、0.02、0.04 μg/mL的溶剂标准混合工作溶液,现配现用。
1.3.3 仪器条件
1.3.3.1 色谱条件
色谱柱:Agilent Eclipse Plus C柱(2.1 mm×50 mm,1.8 µm);柱温:30 ℃;流速:0.4 mL/min;进样量:5 µL;流动相:A为0.1%甲酸溶液,B为乙腈,洗脱程序见表1;运行时间:5 min。
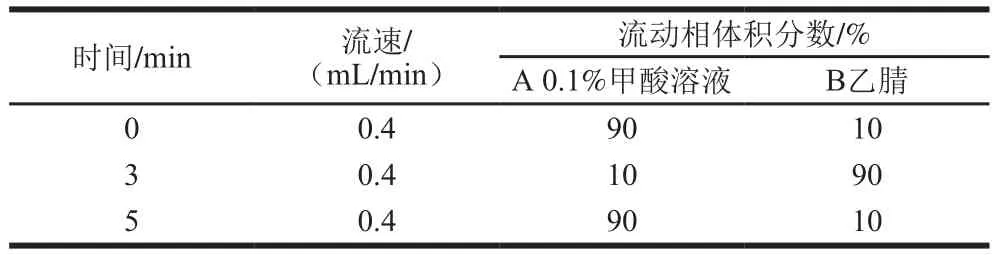
表1 UPLC梯度洗脱程序Table 1 Gradient elution program for UPLC
1.3.3.2 质谱条件
离子源:带有安捷伦喷射流技术的电喷雾电离源;离子扫描模式:正离子扫描模式;扫描方式:多反应监测(multiple reaction monitoring,MRM)模式;鞘气温度和流速:250 ℃和11.0 L/min;喷嘴电压:500 V;毛细管电压:4 000 V;雾化气压力:45 psi;干燥气温度和流速:300 ℃和5 L/min;干燥气、雾化气、碰撞气、鞘气均为高纯氮气。
1.3.4 样品前处理条件的优化
1.3.4.1 提取
称取10.0 g匀浆空白刺梨样品置于50 mL离心管(每个处理3 个平行),添加标准物静置30 min后,加入15 mL提取剂溶液振荡提取10 min,然后加入1.0 g氯化钠,4.0 g无水硫酸镁,振荡5 min,然后4 000 r/min离心5 min,取上清液过0.22 µm检测,通过计算11 种农药的回收率考察提取效果。接着再以0.1%甲酸-乙腈、1%甲酸-乙腈、0.1%冰醋酸-乙腈、1%冰醋酸-乙腈、1%氨水-乙腈作为提取剂,考察常用缓冲剂对农药提取率的影响,实验步骤同上。
1.3.4.2 净化
在优化的提取条件下,提取完成之后离心,取1.5 mL上清液至装有150 mg无水硫酸镁和不同净化材料的2 mL离心管中,先2 000 r/min涡旋3 min,再12 000 r/min离心5 min,用1 mL注射器抽取上清液过0.22 µm滤膜检测,通过计算11 种农药的回收率考察不同净化材料对农药的吸附情况。
1.4 数据分析与图表绘制
所有数据均在Agilent公司的MassHunter Data Acquisition 10.0软件下采集,采用MassHunter Quantitative Analysis 10.0软件进行定量分析,采用Qualitative Analysis 10.0软件进行定性分析,采用Python编程语言配合Matplotlib第三方库进行绘图。
2 结果与分析
2.1 质谱条件的优化
优化碎裂电压、碰撞能量、驻留时间、加速电压等仪器条件设置,筛选能产生高响应、特异离子对的质谱条件,采用正离子扫描和MRM模式的方式一针进样完成对所有目标物的检测,结果见表2,优化后11 种农药的MRM定量离子色谱图如图1所示。
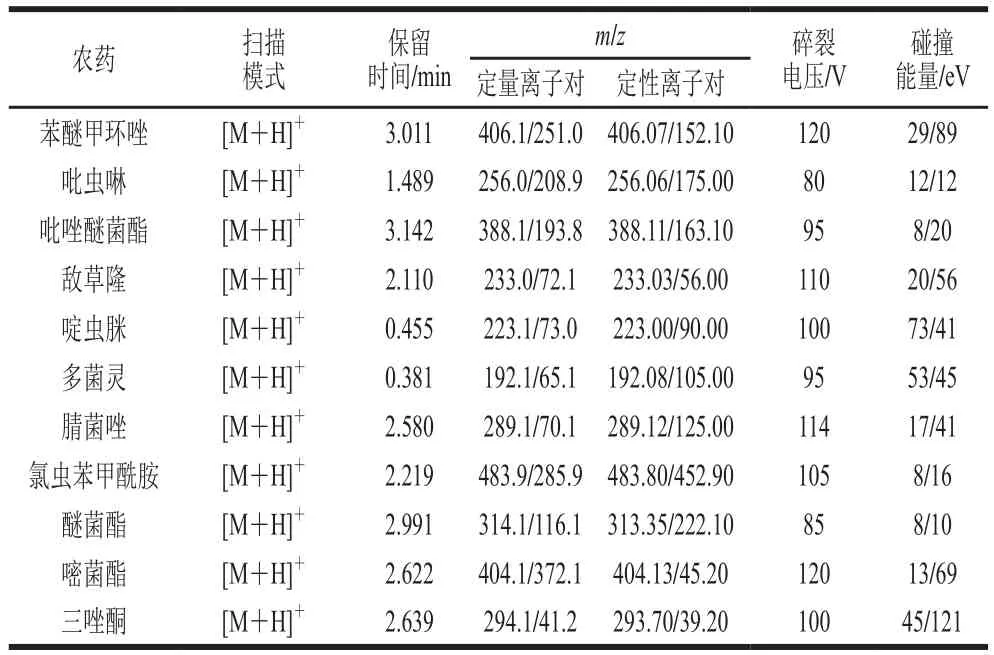
表2 11 种农药的质谱参数Table 2 Mass spectrometric parameters of 11 pesticides
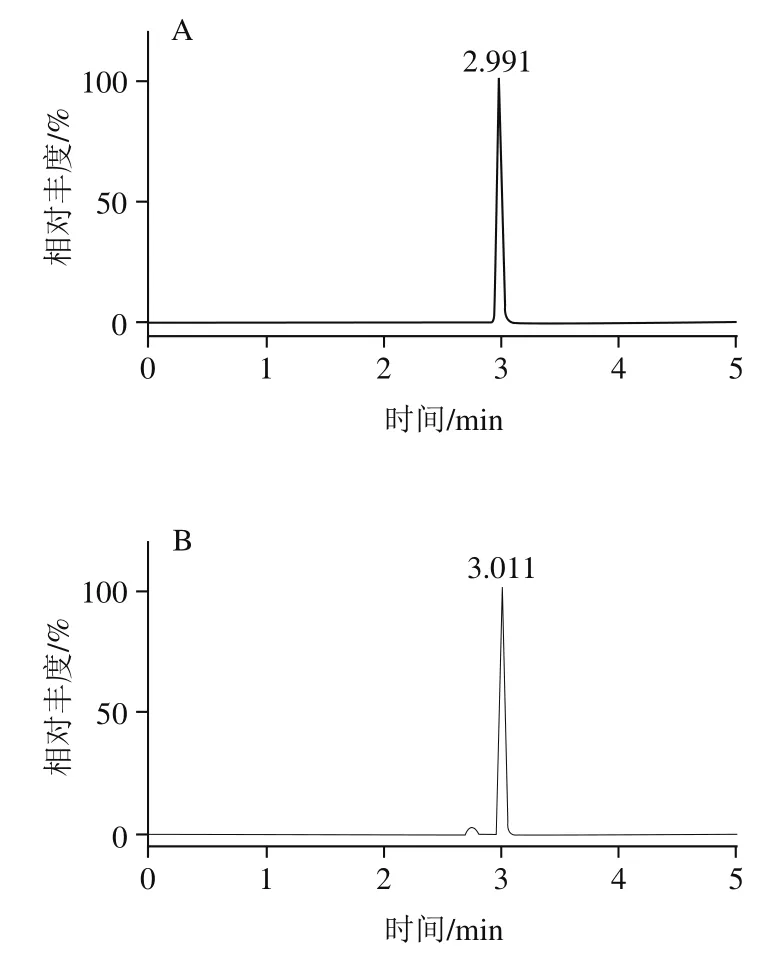
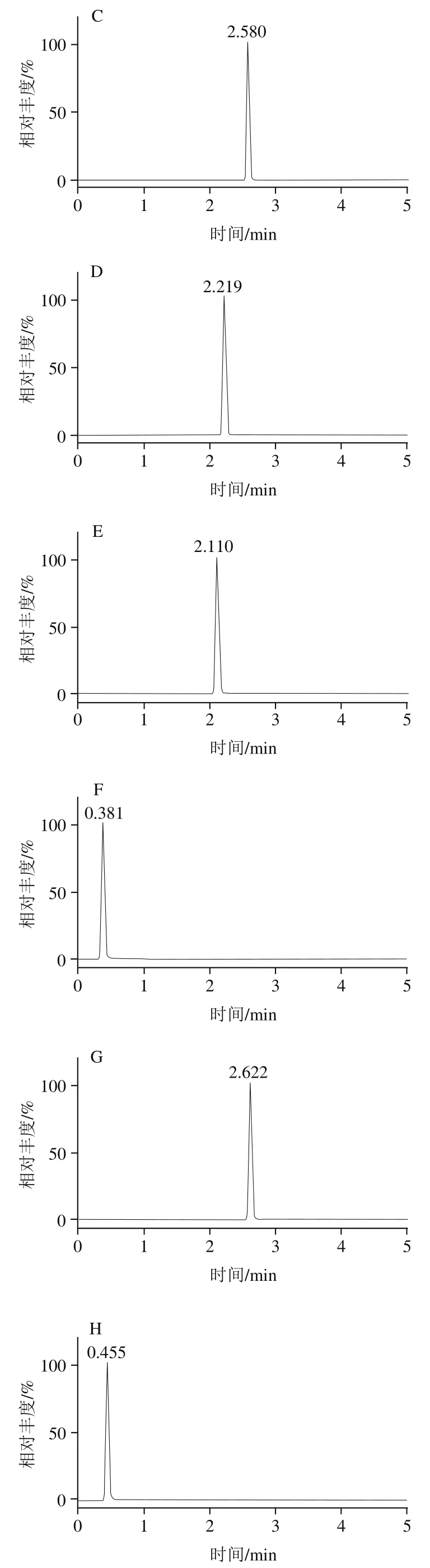
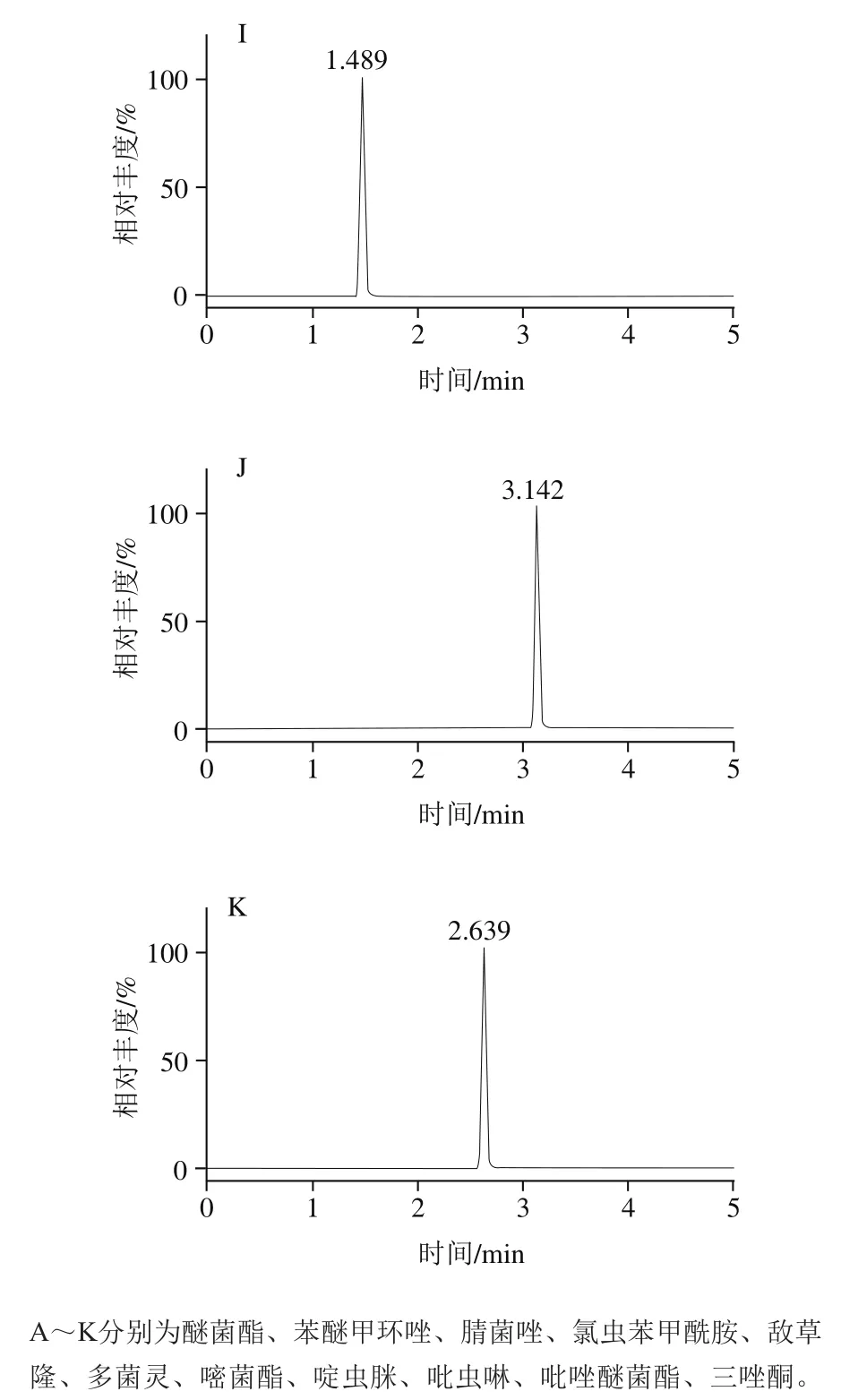
图1 11 种农药定量离子色谱图Fig. 1 Chromatograms of quantitative ion pairs of 11 pesticides
2.2 样品前处理优化结果
2.2.1 提取

表3 不同提取方法的11 种农药总体回收率Table 3 Total recoveries of 11 pesticides with different extraction methods
考察乙腈、甲醇、乙酸乙酯和二氯甲烷4 种提取剂的提取效率,结果显示乙腈的提取效率较其他提取剂好,平均回收率能达到99%(表3)。从表3可以看出,添加缓冲剂后,11 种农药的平均回收率在63%~74%之间,说明在提取剂中加入一些缓冲剂如甲酸、冰醋酸和氨水等并不能提高乙腈的提取率,因此最终确定提取剂为乙腈。
2.2.2 净化
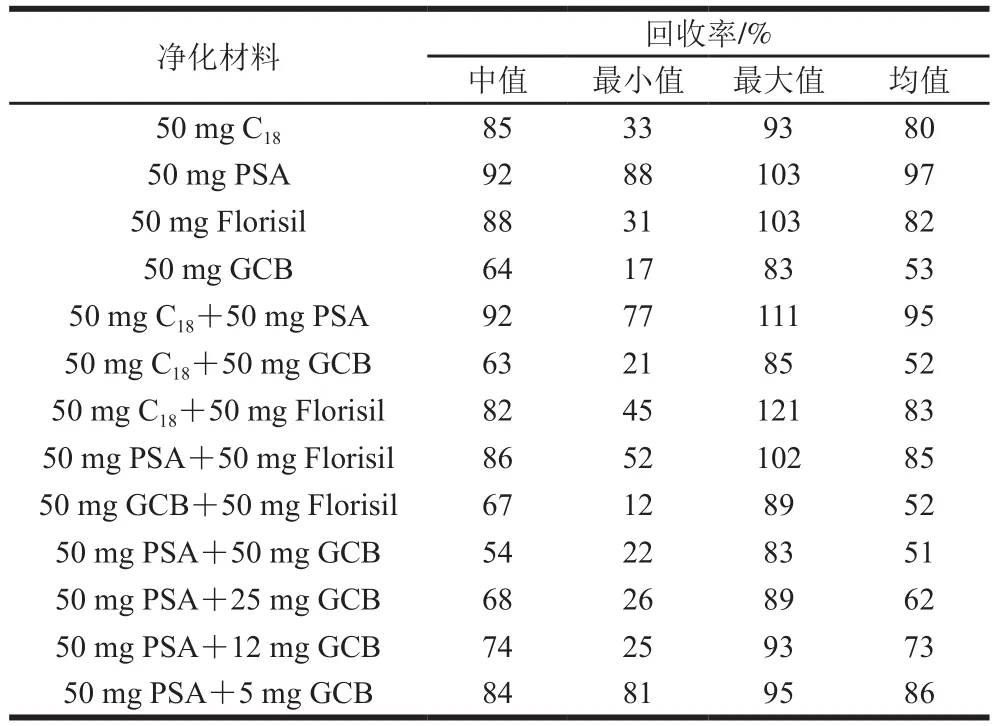
表4 不同净化剂净化后的11 种农药总体回收率Table 4 Total recoveries of 11 pesticides with different sorbents
QuEChERS方法常用净化材料有C、PSA、Florisil和GCB。C可用来除脂,PSA可用来消除各种果蔬的有机酸、色素及一些糖和脂肪酸,GCB可用来去除甾体、叶绿素等色素,但对含苯官能团的化合物有较强吸附作用,降低其回收率。因此,本研究考察C、PSA、Florisil和GCB四种净化材料单独使用与组合使用对待测物回收率的影响。除PSA外,其他净化剂均对少数农药有一定的吸附,尤其是含GCB的净化剂影响最大,导致个别农药回收率偏低(表4)。从表4还可看出,通过将回收率最高的PSA与不同质量的GCB混合使用后发现,随着GCB的质量减少,回收率不断上升,当GCB质量为5 mg时回收率最为理想,达到了86%,同时上清液比只添加PSA的上清液更加澄清。尽管50 mg PSA与5 mg GCB复合净化的回收率(86%)不如PSA单独净化高(97%),但没有添加GCB净化剂的样品含有较多色素,加大了色谱柱和检测器被污染的风险,综合考量,本实验最终选择50 mg PSA+5 mg GCB作为净化剂。
2.3 方法评价
2.3.1 线性范围、检出限、定量限及基质效应
基于已优化的分析条件,用空白刺梨样品的提取液将1.3.2节标准混合溶液稀释成质量浓度分别为0.001、0.005、0.01、0.02、0.04 μg/mL的基质标准混合溶液,经UPLC-MS/MS测定后,以每种农药定量离子峰面积为纵坐标,农药基质标准溶液质量浓度为横坐标,绘制标准曲线。结果显示,11 种农药在0.001~0.04 μg/mL范围内呈现出良好的线性关系,相关系数()均大于0.99,以信噪比=3估算检出限(limits of detection,LOD),以=10确定定量限(limits of quantitation,LOQ),11 种农药LOD为1.31~8.56 μg/kg,LOQ为4.13~43.57 μg/kg,结果见表5。
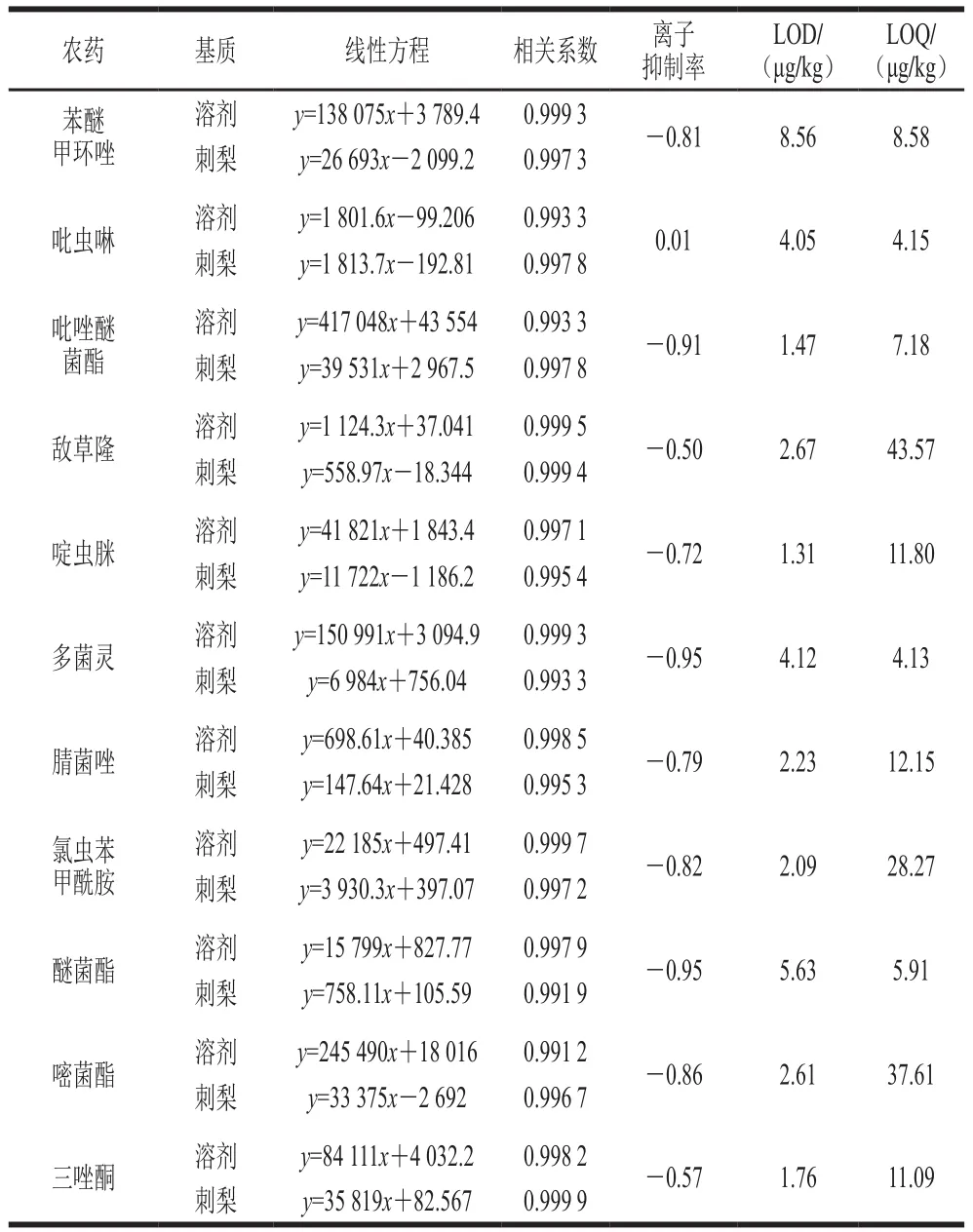
表5 11 种农药的线性方程、相关系数、离子抑制率、LOD及LOQTable 5 Linear equations, correlation coefficients, ion suppression percentages, LODs and LOQs of 11 pesticides
基质效应是使用LC-MS/MS检测残留应尽量避免。参照文献[41-44]报道,离子抑制率计算公式为:
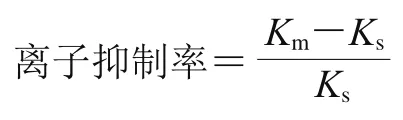
式中:为基质匹配标准曲线的斜率;为纯溶剂标准曲线的斜率。
当离子抑制率为0时,表示无基质效应;当离子抑制率大于0时,表示样品基质对目标化合物的测定存在基质增强作用;当离子抑制率小于0时,表示样品基质对目标化合物的测定存在基质抑制作用。通过比较11 种农药在刺梨基质中的离子抑制率,实验结果发现:刺梨样品基质对除吡虫啉外的所有农药均是较为显著的基质抑制效应(表5),离子抑制率的绝对值均大于0.1,因此为消除基质效应带来的影响,需采取基质标准曲线进行校正。
2.3.2 方法准确度与精密度结果
在刺梨样品中添加11 种目标农药的混合标准溶液,添加量均分别100、1 000、5 000 μg/kg。由表6可知,11 种农药的平均添加回收率在84.5%~103.8%之间,相对标准偏差(=6)在1.2%~8.5%之间,方法具有较好的回收率和重复性,满足农药残留分析的要求。
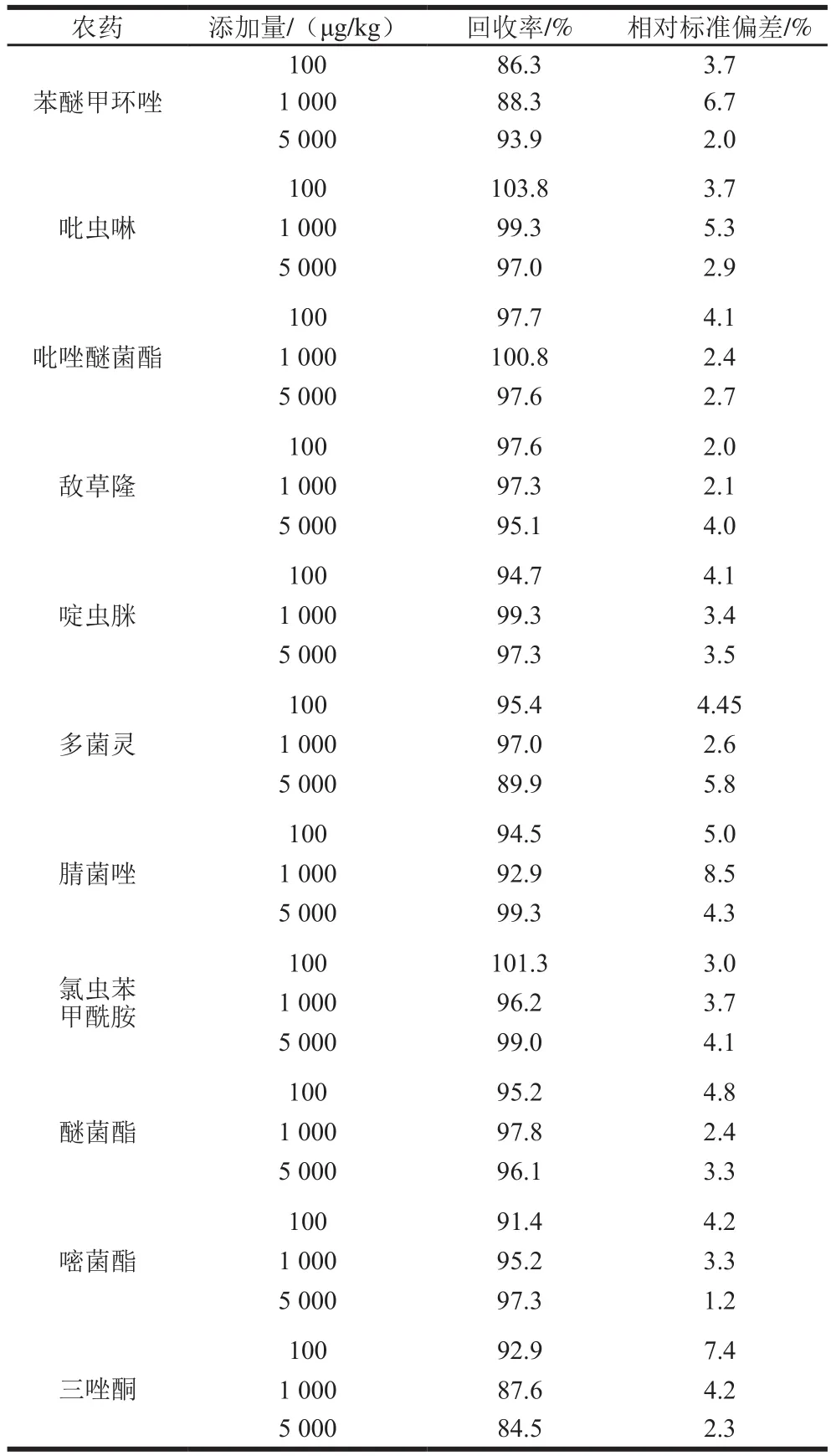
表6 11 种农药在刺梨中的添加回收率和相对标准偏差Table 6 Recoveries and RSDs of 11 pesticides in spiked R. roxburghii
3 结 论
建立了同时检测刺梨中11 种常用农药残留的UPLC-MS/MS方法。该方法灵敏度高、重复性好,经过系列方法学验证,11 种常用农药的方法LOD在1.31~8.56 μg/kg之间,LOQ在4.13~43.57 μg/kg之间,线性相关系数()在0.991 2~0.999 9之间;平均添加回收率在84.5%~103.8%之间,相对标准偏差(=6)在1.2%~8.5%之间。该方法准确、快速、操作简单、净化效果好,对于推进政府监管部门执法、提高检测效率、降低检测成本、推进第三方检测市场整体技术进步等具有重要的实践意义和社会效益,可应用于刺梨农药使用和安全性监测工作中。
