甲烷氧化菌素耦合脂肪酶生物传感器差分脉冲伏安法对Cu2+的检测
2022-09-01李虹佳辛嘉英孙立瑞关桦楠
王 艳,赵 宁,王 悦,李虹佳,辛嘉英,孙立瑞,关桦楠
(哈尔滨商业大学 食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
环境中的铜易在人体中富集,根据世界卫生组织规定,饮用水中Cu质量浓度标准为不高于2.0 mg/L,当血清中Cu累计量超过0.035 mmol/L,会造成铜中毒。现有Cu检测方法有光谱法、电感耦合等离子体质谱法、离子色谱法、分光光度法等,其中大部分方法存在一些限制性和弊端,如耗时较长、灵敏度低、操作繁琐、仪器昂贵以及依赖实验室专业的人员进行检测等缺点,不利于现场快速检测实际应用。电化学分析法是一种公认的快速、灵敏、准确的痕量元素分析法,操作简单、价格低廉,是其备受关注的突出优势。目前电化学法对Cu检测灵敏度和选择性较低,差分脉冲伏安(differential pulse voltammetry,DPV)法相较于循环伏安法灵敏度更高,电流响应信号与表面电解的待测物总量呈比例关系,可进行定量检测。
脂肪酶是一种三油酸甘油酯水解酶,天然酶作为绿色环保的生物催化剂,具有高效性、高选择性、催化条件温和以及酶活较高等特点,广泛存在于动物、植物和微生物中。纳米材料具有表面效应、体积效应和介电限域效应等不同于块体材料和原子或分子的介观性质,并且具有较高的表面自由能,能为生物酶的固载提供更多的活性位点,并且脂肪酶与金纳米粒子可通过金硫键进行键合从而对三油酸甘油酯的电化学行为产生特有的催化效应。采用柠檬酸纳法还原氯金酸制备的纳米金(gold nanoparticle,AuNPs),用于制备脂肪酶生物传感器可使传感器表面积呈指数增加,从而显著增加其催化效率。将AuNPs作为固定化酶的载体材料,可以增加固定分子数量,从而增强电化学响应信号。同时,AuNPs具有一定的生物相容性,可以增强脂肪酶分子间的稳定性。甲烷氧化菌素(methanobactin,Mb)是由甲烷氧化菌生长过程中分泌的一种生物分子,是一种具有极高铜亲和力的蛋白活性肽,Mb中游离的巯基与胺基可与AuNPs通过Au—S和Au—N键键合,并且Mb特异性捕获环境中的铜且对Cu具有较强的专一性。
本实验通过循环伏安法对Mb耦合脂肪酶生物传感器考察传感器构建的电化学响应情况,采用DPV实现对Cu的特异性定性、定量检测研究,其原理如图1所示。基于层层组装技术构建Mb耦合脂肪酶生物传感器(Mb/Lipase@AuNPs-Gold Electrode),脂肪酶催化三油酸甘油酯的水解反应为基础反应模型,以三油酸甘油酯为底物分子,生物传感器可检测水解底物时产生的电流信号,利用Mb可特异性捕获Cu的特性,实现Cu在脂肪酶周围产生富集现象,从而抑制脂肪酶的催化活性,导致电流强度迅速下降,通过考察加入Cu前后电流信号差值,实现对Cu的快速定性、定量检测。本研究构建的脂肪酶生物传感器可解决现有电化学检测Cu灵敏度和专一性低、检出限高的问题,为实现Cu现场快速定量检测提供新的思路和研究基础。

图1 基于Mb耦合脂肪酶生物传感器电化学检测Cu2+示意图Fig. 1 Schematic diagram for electrochemical detection of Cu2+ based on Mb/Lipase@AuNPs-gold electrode
1 材料与方法
1.1 材料与试剂
甲基弯菌OB3b 俄罗斯科学院催化研究所;无水乙醇(纯度99%) 天津富宇精细化工有限公司;氯金酸 国药集团上海试剂公司;脂肪酶 美国Sigma公司;柠檬酸钠、铁氰化钾、亚铁氰化钾、氯化钾、Tirs-HCl缓冲溶液(纯度99%) 天津市天力化学试剂有限公司;离子溶液(Ca、Mg、Zn、Hg、Pb、Ba、Ni)均为分析纯,实验过程配制试剂全部采用超纯水。
1.2 仪器与设备
PB-10 pH计 赛丽朵思公司;生化发酵罐 上海保兴生物设备工程公司;CHI660 E电化学工作站、金盘电极、铂丝电极、Ag/AgCl电极(3.4 mol/L KCl溶液)上海辰华仪器公司;UV-2550型紫外-可见分光光度计日本岛津公司;傅里叶变换红外光谱仪 美国PerkinElmer公司;F-7000荧光分光光度计 日本日立公司;JEM-2100F场发射高分辨透射电镜 日本JEOL公司。
1.3 方法
1.3.1 试剂的配制
1.3.1.1 AuNPs的制备
采用柠檬酸钠还原法制备AuNPs,取100 mL质量浓度为1×10g/L的氯金酸,加热至沸腾,随后加入10 g/L的柠檬酸钠溶液1.8 mL摇晃振荡、使之充分混合。溶液从微黄色变为酒红色,通过紫外吸收光谱520 nm处的吸光度,可得到AuNPs的平均粒径为10 nm。
1.3.1.2 电解液的配制
电解液(5 mmol/L铁氰化钾、3 mmol/L亚铁氰化钾和0.1 mol/L氯化钾)用于检测酶生物传感器。
1.3.2 固定化脂肪酶的制备与表征
称取50 mg脂肪酶于10 mL具塞三角瓶中加入2 mL离子水,充分振荡至完全溶解,配制成25 mg/mL的酶液,再添加粒径为10 nm的AuNPs 2 mL,将其混匀后盖上胶塞并用封口膜密封,置于30 ℃的恒温培养箱中反应6 h后,即固定化酶。通过紫外、红外、荧光光谱以及透射电镜对其二级和三级结构进行表征,判断结合的稳定情况。
1.3.3 Mb耦合脂肪酶生物传感器的构建
1.3.3.1 Mb耦合脂肪酶生物传感器构建方法筛选与表征
使用固体三电极体系(工作电极:金电极;参比电极:Ag/AgCl;对电极:Pt电极),固定化脂肪酶、Mb(1×10mol/L)和AuNPs,首先在3 支裸金电极表面滴涂30 μL AuNPs溶液,置于4 ℃冰箱中3 h备用,将固定化脂肪酶液与Mb分别采用滴涂法、浸泡法和电沉积法对电极层层组装构建脂肪酶生物传感器。
滴涂法:将固定化脂肪酶酶液取30 μL滴涂在备用电极表面,静置于4 ℃冰箱中12 h,再滴涂30 μL Mb于4 ℃冰箱中静置12 h;浸泡法:将备用电极浸泡于固定化脂肪酶酶液中,静置于4 ℃冰箱中12 h,自组装完成后再置于Mb溶液中12 h;电沉积法:采用循环伏安法对备用电极修饰固定化脂肪酶酶液电沉积30 圈再修饰Mb溶液电沉积30 圈,将以上3 种不同方法构建的脂肪酶生物传感器分别在电解液和以三油酸甘油酯为底物的两个检测体系中选用循环伏安法考察电流信号变化情况,并用交流阻抗法通过电阻大小进行脂肪酶生物传感器构建表征,电位-时间曲线法确定交流阻抗法开路电位值0.4 V。采用灵敏度更高的DPV,检测三油酸甘油酯为底物的电化学体系电流信号强度,选取不同的反应底物质量浓度和pH值条件,使得DPV法在此检测体系中电信号达到最强,为后续检测Cu浓度反定量提供更宽的检测范围。
1.3.3.2 电沉积法构建Mb耦合脂肪酶生物传感器
首先将粒径为10 nm的AuNPs溶液采用循环伏安法电沉积20 圈于打磨抛光好的裸金电极,其次电沉积修饰固定化脂肪酶酶液40 圈,再修饰Mb(1×10mol/L)电沉积30 圈;重复修饰固定化脂肪酶酶液和Mb溶液的步骤,利用DPV法检测Mb耦合脂肪酶生物传感器检测性能。
1.3.4 DPV法对Cu的定量检测
将制备好的酶生物传感器,超纯水冲洗后氮气吹干,采用DPV法在三油酸甘油酯为底物的检测体系中检测,在阶跃高度0.015 V、振幅0.03 V、脉冲宽度0.06 s、取样间隔0.02 s条件下,测出氧化电流峰值后,引入不同浓度的Cu,Mb特异性捕获Cu,Cu会抑制脂肪酶的催化活性,进而氧化电流峰值会随着Cu浓度的升高而下降。确定检测Cu最佳浓度范围内的线性关系。
1.3.5 Cu电化学检测体系抗干扰研究及传感器的使用寿命
采用DPV法在三油酸甘油酯和Tirs-HCl缓冲溶液的检测体系中,采用时间-电流曲线法在三油酸甘油酯和Tirs-HCl缓冲溶液体系中检测,每50 s向其中加入30 μL 100 nmol/L Cu,观察电流变化,再依次加入30 μL浓度为10 μmol/L的离子,包括Ca、Mg、Zn、Hg、Pb、Ba、Ni,评估该检测体系抗干扰性能。将制备好的酶生物传感器分别放置冰箱4 ℃保存2、4、6、8、10、12 d和14 d,在同一时间内对酶生物传感器的检测性能进行监测,将制备好的酶生物传感器重复进行浓度100 μmol/L Cu检测,每次检测后采用超纯水清洗,氮气吹干后置于4 ℃冰箱冷藏保存,观察检测结果的相对标准偏差。
1.4 数据处理
采用Origin 8.5软件处理数据作图。
2 结果与分析
2.1 固定化脂肪酶构建机制分析
2.1.1 透射电镜表征固定化脂肪酶
透射电镜下观察AuNPs溶液与固定化脂肪酶,如图2A所示,AuNPs溶液中AuNPs颗粒分散均匀且粒径均一,图2B固定化脂肪酶溶液中由于脂肪酶通过共价键固定在AuNPs颗粒上,并未改变AuNPs颗粒粒径,但AuNPs颗粒分布相对紧密,可证明脂肪酶固定成功。

图2 AuNPs(A)和固定化脂肪酶(B)的透射电镜表征Fig. 2 TEM images of AuNPs (A) and lipase-AuNPs (B)
2.1.2 光谱表征固定化脂肪酶
猪胰脂肪酶蛋白质中的色氨酸(Try)和酪氨酸(Tyr)在280 nm附近均有紫外特征吸收峰。AuNPs的紫外吸收特征峰在520 nm左右,AuNPs可通过静电吸附以及与脂肪酶中的巯基—SH结合形成牢固的共价Au—S键,进而实现脂肪酶的固定性。如图3A所示,AuNPs与脂肪酶结合后在520 nm处出现新特征吸收峰,固定化脂肪酶制备成功后此特征吸收峰发生红移现象,且此时280 nm附近的氨基酸紫外特征吸收峰会下降,结果表明脂肪酶已成功固定在AuNPs上,使得AuNPs粒子与脂肪酶分子聚合程度上升。猪胰脂肪酶中的荧光基团可以与猝灭剂发生分子间作用,如激发态反应、分子重排、能量转移、形成基态络合物和分子碰撞等,均可引发荧光的猝灭。当激发波长为280 nm时,色氨酸和酪氨酸同时被激发。如图3B所示,当激发波长为280 nm时,酶液中加入AuNPs后,/=280/342 nm处的色氨酸和酪氨酸的特征发射峰明显降低,荧光基团发生猝灭现象,脂肪酶的发射波长产生轻微的红移,由342 nm红移至345 nm,当固定化脂肪酶制备成功时,发射波长再次红移至351 nm,这说明两种氨基酸残基均已暴露,固定化脂肪酶制备成功形成激基复合物导致波长变长。脂肪酶与固定化脂肪酶变化红外图谱对比如图3C所示,3 437 cm处为不饱和碳上有强极性O—H发生伸缩振动,2 319 cm处形成新的叁键和累计双键区C≡N发生伸缩,1 638 cm的C=C伸缩振动明显增强,可能是由于—SH与AuNPs溶液中羧酸的C=O发生键和,此处特征吸收峰增强,980 cm可能为C—O伸缩振动,872 cm处为=CH发生面外摇摆,607 cm和531 cm可能为C—S和C—N,525 cm处为—S—S—的伸缩振动明显减弱,表明脂肪酶中的二硫键与AuNPs粒子发生偶联,形成了Au—S离子共价键。鉴于二硫键在维持蛋白质结构稳定性的重要性,以及紫外与荧光光谱结果可知固定化脂肪酶制备成功。
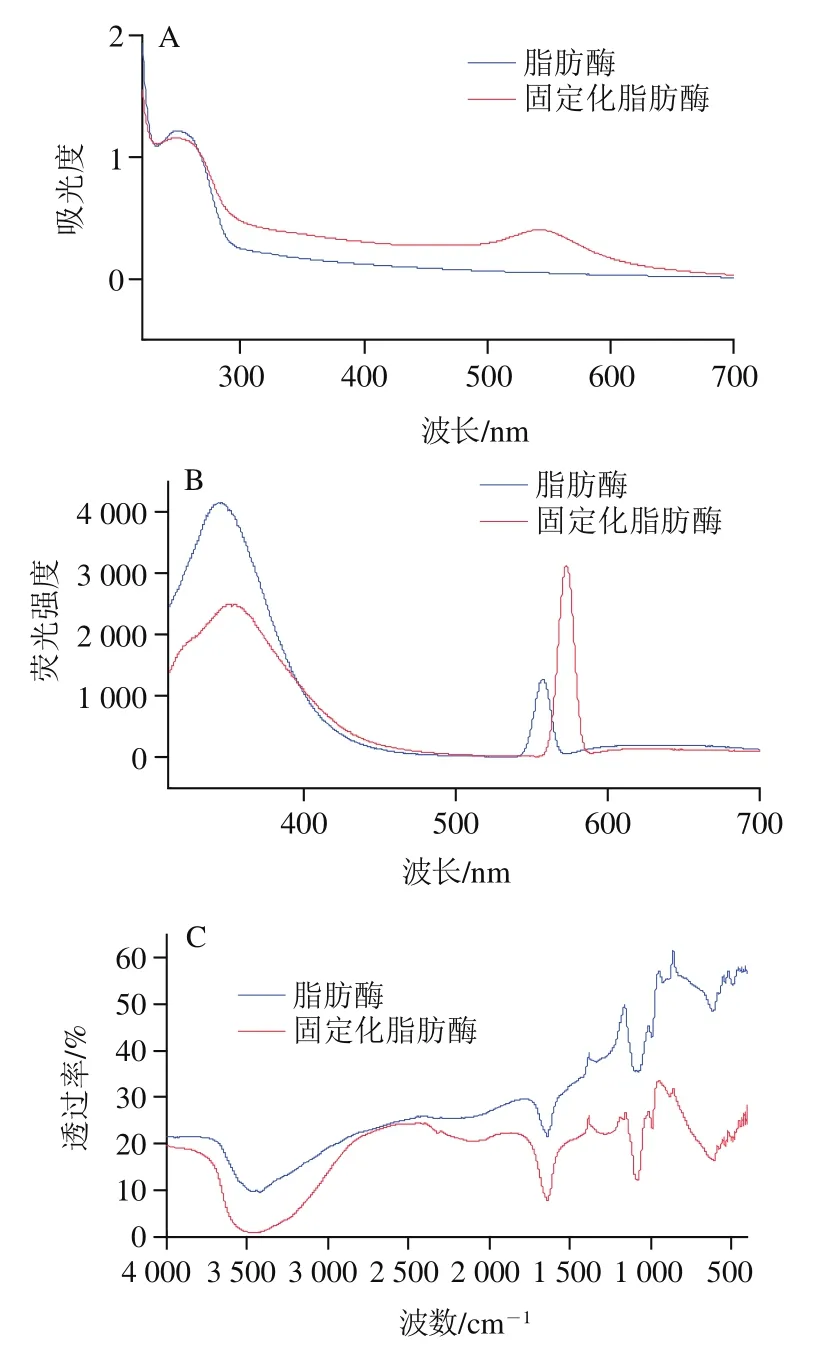
图3 固定化脂肪酶紫外光谱(A)、荧光光谱(B)和红外光谱(C)表征Fig. 3 UV (A), fluorescence (B) and infrared spectra (C) of lipase-AuNPs
2.2 Mb耦合脂肪酶生物传感器构建方法筛选
在电解液溶液中,只修饰AuNPs溶液的金电极:由于AuNPs有放大电流信号的能力,电极导电性增强,比裸金电极捕捉电信号的能力更加灵敏,电流值增加了8.802 µA;3 种方式构建的Mb耦合脂肪酶生物传感器,电沉积法、浸泡法、滴涂法电流信号依次递增,滴涂法比裸电极电流信号降低了17.861 µA,浸泡法比裸电极电流信号降低了21.992 µA,电沉积法比裸电极电流信号降低了27.093 µA,结果见图4,说明电沉积法构建脂肪酶生物传感器的效果最好;图5中3 种方法制备的单层组装Mb耦合固定化脂肪酶的酶生物传感器分别在三油酸甘油酯为底物的反应体系中检测:电沉积法电流信号值为18.449 µA、浸泡法电流信号值为12.908 µA、滴涂法电流信号值为11.426 µA,电沉积法、浸泡法、滴涂法构建的脂肪酶生物传感器检测电流峰值依次递减,两项结果均表明电沉积法修饰固定化脂肪酶的效果最佳,因此本研究选择电沉积法构建脂肪酶生物传感器。电沉积法可达成修饰电极理想化按设计顺序修饰,且目标物有序、相对致密,修饰的稳定性相较于滴涂法与浸泡法更高。

图4 脂肪酶生物传感器在电解液中电信号强度Fig. 4 Electrical signal intensity of lipase biosensor in electrolyte

图5 脂肪酶生物传感器催化三油酸甘油酯Fig. 5 Voltammetric curves showing catalysis of triglycerides of lipase biosensor
2.3 Mb耦合脂肪酶生物传感器构建表征
如图6A所示,在电解液溶液中裸电极表面修饰AuNPs可以放大电流信号,随着修饰的脂肪酶层数不断增加,电信号逐渐减弱。如图6B所示,交流阻抗法检测中实部电阻-虚部电阻曲线圆弧逐渐变大,显示传感器表面电阻不断增加的同时,也证明酶生物传感器构建成功。
在三油酸甘油酯为底物的检测体系中,传递的电流强度很弱,裸电极只能捕捉到微弱的氧化还原电信号;随着电沉积法构建脂肪酶生物传感器酶层数不断增加,氧化还原反应逐渐增强,电信号强度递增,但层数为4 层时,在检测体系中电信号骤减,结果如图7所示,层数越多会形成空间位阻效应,活性中心互相遮盖掩埋,并影响传感器对电流信号的感应效果,且形成Au—S键共价键键和强度弱于自身重量也会引起断裂;但修饰层数过少,则信号传递效率、传感器响应面及有效换能没有达到饱和,使得检测的灵敏度过低,因此选择3 层为最优的修饰脂肪酶层数。

图6 伏安法(A)和交流阻抗法(B)电解液溶液中脂肪酶生物传感器修饰层数优化表征Fig. 6 Optimization of the number of modified layers of lipase biosensor in electrolyte solution
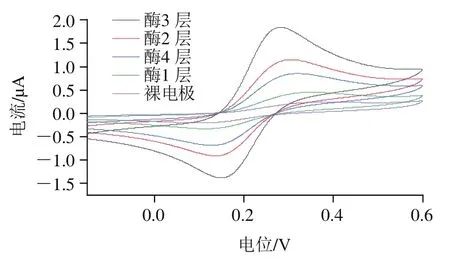
图7 酶层数不同的脂肪酶生物传感器催化三油酸甘油酯Fig. 7 Voltammetric curves showing catalysis of triglycerides by lipase biosensor with different enzyme layers
2.4 DPV法Cu2+检测体系的优化
2.4.1 脂肪酶生物传感器催化底物质量浓度的确定
将构建好的脂肪酶生物传感器分别在不同质量浓度三油酸甘油酯为底物的体系检测电流信号强度,以-0.1~-0.5 V电位区间内氧化峰电流值为响应,如图8A所示,在0.2 V附近电流达到峰值,如图8B所示,质量浓度为2 g/100 mL三油酸甘油酯溶于Tirs-HCl缓冲溶液时电信号强度最大为8.795 μA,构建脂肪酶生物传感器上酶数量一定,酶催化活性中心的活性位点数量也一定,当底物质量浓度过高时,酶的催化活性中心可传递电信号的活性位点会被掩盖发生衰减现象,与此同时检测体系的双电层扩散系数会减小,传感器同时期捕获的电流信号会成倍降低。当底物质量浓度过低时酶促反应没达到饱和,此时虽然检测体系的双电层扩散系数大于相对三油酸甘油酯质量浓度过大时的系数,质量浓度对脂肪酶生物传感器上的酶促反应传递电信号能力有影响,相较于两者平衡时的电信号强度而言,体系双电层的介电系数达到饱和,因此选择三油酸甘油酯溶于Tirs-HCl缓冲溶液,2 g/100 mL为最佳反应底物质量浓度。

图8 脂肪酶传感器催化不同质量浓度三油酸甘油酯(A)及其电流变化曲线(B)Fig. 8 Voltammetric curves showing catalysis of different concentrations of triglycerides by lipase biosensor (A) and relationship between electric current and substrate concentration (B)
2.4.2 脂肪酶生物传感器催化三油酸甘油酯最佳pH值的确定
将构建好的酶生物传感器分别在不同pH值条件下,以质量浓度2 g/100 mL三油酸甘油酯为底物的体系检测电流信号强度,以-0.1~0.5 V氧化峰电流为响应,如图9A所示,在电位0.2 V时氧化峰电流达到最大值,如图9B所示,pH 7.5时电信号强度最大为15.81 μA,pH值对脂肪酶催化活性有明显影响,当双电层界面扩散系数一定时,酶促效果与电信号强度呈正比,pH值的不同会改变酶的二级结构以及三级结构,酶的活性氨基酸以及残基会部分或全部失活,酶促反应无法正常进行,此时脂肪酶生物传感器活性位点传递信号的强度成倍衰减,因此选择pH 7.5的脂肪酶催化体系为最佳检测体系。
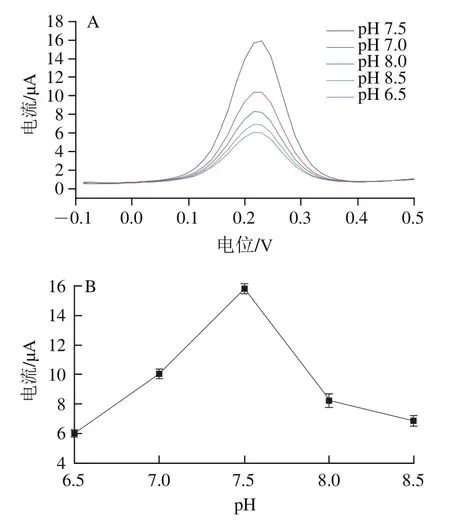
图9 脂肪酶传感器在不同pH值催化三油酸甘油酯(A)及其电流变化曲线(B)Fig. 9 Voltammetric curves showing catalysis of triglycerides by lipase sensor at various pH levels (A) and relationship between electric current and pH (B)
2.5 Cu2+检测线性范围拟合曲线、检出限
采用DPV以0.2 V处氧化峰电流最大值为响应,加入不同浓度Cu通过电流下降高度实现对Cu的反定量检测,Cu浓度(1、25、50、75 nmol/L和100 nmol/L)为横坐标,脂肪酶生物传感器水解三油酸甘油酯产生的电流与加入Cu后电流强度差值为纵坐标进行线性拟合,如图10所示,线性回归方程为=0.228+0.774 8(=0.995 0),表明Cu浓度在1~100 nmol/L区间与电流信号下降高度之间线性关系良好,经计算得检出限为0.03 nmol/L。
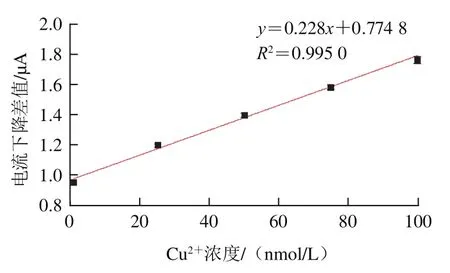
图10 脂肪酶生物传感器检测Cu2+线性关系Fig. 10 Linear relationship for detection of copper ion with lipase biosensor
2.6 Cu2+检测体系抗干扰性能
采用时间-电流曲线法,在三油酸甘油酯质量浓度2 g/100 mL与Tirs-HCl检测体系中每隔50 s加入20 μL的50 nmol/L Cu溶液,其他干扰离子浓度是Cu的100 倍,如图11所示,当检测体系中加入Cu溶液时电流成阶梯状有序下降,但依次每隔50 s加入20 μL浓度为5 μmol/L Ca、Mg、Zn、Hg、Pb、Ba、Ni溶液时脂肪酶生物传感器感应电流强度无变化,说明在超痕量的检测范围内此脂肪酶生物传感器对Cu检测具有特异性,其他常见的二价金属、非金属离子对本检测体系无干扰。

图11 抗干扰性能电流变化曲线Fig. 11 Current changes showing anti-interference performance
2.7 酶生物传感器的稳定性以及使用寿命
为证明每次实验数据结果具有科学性,检测制备的脂肪酶生物传感器的稳定性,在三油酸甘油酯与Tirs-HCl缓冲溶液的检测体系中加入Cu进行10 次连续检测,重复测定3 次,相对标准偏差为1.72%(<5%说明酶传感器电流响应性能良好)。将制备好的酶生物传感器保存于4 ℃冰箱中,分别存放2、4、6、8、10、12、14 d后取出对Cu进行检测,重复5 次检测实验,如图12所示,在第14天对Cu响应的峰电流达到86.96%,说明该脂肪酶生物传感器稳定性良好,随着检测次数的增加与构建时间的延长,脂肪酶催化底物的活性位点逐渐减少导致重复性下降、检测性能降低,因此在传感器有效检测时间内及时使用。传感器每次检测Cu后用缓冲溶液进行活性位点释放处理,可实现一支传感器多次使用的目的,实验发现用同种方式进行传感器的活性位点释放前10 次检测,结果如图13所示,相对标准偏差为2.19%;在11~20 次,相对标准偏差为2.87%;在21~30 次,相对标准偏差为3.48%;在31~40 次,相对标准偏差为4.55%;在41~50 次,相对标准偏差为8.03%(>5%),由此可知,此脂肪酶生物传感器在40 次重复利用时可保持良好的检测性能,但是在40 次以上电流信号感应衰减情况显著,此现象可能是因为传感器上的脂肪酶在每次释放、检测往返过程中部分活性位点掩盖甚至失活,酶促反应的电信号传递缺失,或本来可传导信号的活性中心因为失活,电信号湮灭,因此本脂肪酶生物传感器在使用寿命上可完成在40 次左右的重复检测效果良好。

图12 脂肪酶传感器稳定性时间-电流响应强度Fig. 12 Current response intensity versus curve showing lipase sensor stability

图13 传感器使用次数与电流变化曲线Fig. 13 Current changes as a function of the number of repeated use of the sensor
3 结 论
利用电沉积法通过层层组装AuNPs、固定化脂肪酶、Mb构建脂肪酶生物传感器,实验表明本法固定化脂肪酶修饰层数为3 层时制备的传感器最稳定;脂肪酶催化底物三油酸甘油酯的检测体系中三油酸甘油酯溶于100 mL的Tirs-HCl缓冲溶液质量浓度为2 g/100 mL、pH 7.5时传感器捕获电流信号响应值最高;Cu浓度为1~100 nmol/L线性范围内拟合程度最好,线性方程为=0.228+0.774 8(=0.995 0),检出限为0.03 nmol/L(=3)且在此超痕量的检测范围内,浓度为1 μmol/L的Ca、Mg、Zn、Ba、Hg、Pb等常见的二价金属、非金属离子同时存在时,其他金属对Cu检测无干扰;此体系检测Cu的抗干扰能力出色;在超痕量范围内采用DPV可实现对同离子现场快速、定量检测、检测时间仅需10 s,解决了目前对Cu检测不能现场快速检测的实际问题。本研究建立的新型脂肪酶生物传感器检测Cu的方法,具有较高的灵敏度、专一性和稳定性,为食品中痕量、超痕量重金属检测领域奠定了研究基础。
