栀子苷对高糖诱导肾小管上皮细胞转分化中TGF-β/Smad通路的影响*
2022-08-31梁栋杨洪涛
梁栋 ,杨洪涛
(1.天津中医药大学第一附属医院肾病科,天津 300381;2.国家中医针灸临床医学研究中心,天津 300381)
随着生活饮食习惯的改变,糖尿病全球患病率程上升趋势,目前已成为威胁人类寿命的严重疾病。据相关流调显示,目前中国成人2型糖尿病的患病率已达10.9%[1]。糖尿病肾病是糖尿病最常见的微血管并发症。在全球范围内,糖尿病肾病是导致慢性肾脏病(CKD)甚至终末期肾病(ESRD)的主要继发性因素。在中国,既往慢性肾小球肾炎是导致慢性肾脏病发病的首要原因,随着糖尿病发病率的持续上升,相关研究证实,糖尿病肾病已经取代慢性肾小球肾炎成为中国导致慢性肾脏病的主要原因[2-3]。肾小管间质纤维化是糖尿病肾病主要的病理特征,而在糖尿病肾病相关病程进展中,肾小管上皮细胞向间充质细胞转分化(EMT)不仅促进肾间质纤维化,而且是糖尿病肾病肾脏损伤的主要机制[4]。而转化生长因子β1是公认的致纤维化因子[5],其过度表达可诱导糖尿病肾病,激活其下游相关因子,加速肾间质纤维化。最近的研究也证实抑制转化生长因子-β1和 Smad相关蛋白(TGF-β1/Smad)可抑制肾纤维化和上皮细胞转分化。既往的研究证实,高糖环境、持续炎症状态均可激活相关信号通路导致糖尿病持续肾损伤[6-7]。而其中白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)是具有代表性的相关炎症因子,其激活中性粒细胞并使其聚集,进一步向炎症部位迁移、吞噬细胞、释放卵清蛋白酶、促进细胞凋亡等,促进炎症进一步发展,影响糖尿病患者免疫调节[8]。
栀子苷(GE)作为环烯醚萜葡萄糖苷,易溶于水,是栀子中主要活性成分,具有降血糖、抗氧化、抗炎等多种生物学作用[9],在糖尿病肾病小鼠中可改善疾病状态[10],有研究表明,栀子苷可以降低脂多糖诱导的小鼠巨噬细胞相关炎症状态中TNF-α和IL-1β、IL-6等的表达和释放[11]。但是否通过改善肾小管上皮细胞转分化发挥作用尚不清楚。因此,高糖诱导人近端肾小管上皮细胞HK2,探讨GE对肾小管上皮细胞转分化是否发挥作用,以初步探讨GE缓解糖尿病肾病的机制。
1 材料与方法
1.1 细胞 人近端肾小管上皮细胞HK2,购自中国医学科学院基础医学研究所细胞资源中心,资源编号:3111C0001CCC000160。
1.2 药品、试剂及仪器 GE(纯度>98%,上海源叶生物科技有限公司,CAS:24512-63-8);胎牛血清、无糖DMEM培养液(美国Sigma公司,货号分别为:F8318、90113);IL-1β、IL-6、TNF-α 酶联免疫吸附(ELISA)试剂盒,一抗 TGF-β1、Smad3、α-平滑肌肌动蛋白(α-SMA,英国Abcam公司,货号分别为:ab215715、ab40854、ab21027)磷酸化 Smad3(Phospho-Smad3,p-Smad3)(美国 CST 公司,批号 9520);RNA提取试剂盒、TIANScript cDNA第一条链合成试剂盒、2×SYBR qPCR Mix(北京 TAINGEN 公司,货号分别为:DP419、KR104、KR108)。实时荧光定量聚合酶链反应(qRT-PCR)仪(美国ABI公司,型号:7500);蛋白凝胶成像仪(美国BIO-RAD公司,型号:GelDoc 2000)。
1.3 方法
1.3.1 实验分组及处理 实验分为对照组、高糖组、GE 1、10、50、100 μmol/L 组。HK2 细胞在含 10%胎牛血清DMEM培养液中置于37℃、5% CO2培养箱中培养,待细胞密度达到90%左右时进行传代,细胞处于对数期时进行实验。
对照组在5.5 mmol/L低糖DMEM培养液中培养,除对照组外,其余各组均于25mmol/L高糖DMEM培养液中培养,GE 1、10、50、100 μmol/L 组同时添加 GE,使 GE 终浓度分别为 1、10、50、100 μmol/L,干预48 h。
1.3.2 显微镜下观察HK2细胞形态 倒置显微镜下观察HK2细胞的形态学情况。
1.3.3 qRT-PCR检测细胞中纤连蛋白(FN)、E-钙黏素(E-cad)、Ⅳ型胶原(COLⅣ)mRNA 水平 RNA提取试剂盒提取细胞总RNA,cDNA第一条链合成试剂盒合成cDNA。qRT-PCR仪对FN、E-cad、COLⅣ、内参 GAPDH 扩增,FN F:5’-CGAAATCACAGCCAG TAG-3’、R:5’-ATCACATCCACACGGTAG-3’,E-cad F:5’-CTGAGAACGAGGCTAACG-3’、R:5’-TTCAA TCCAGCACATCC-3’,COLⅣ F:5’-TATTCCTTCCT CATGCACACGGCG-3’、R:5’-CCAATTTTTGGGTT GGCACC-3’,内参 GAPDHF:5’-AGTTCACTGGCGT CTTCAC-3’、R:5’-GCTTGACAAAGTGGTCGTTGAG-3’。20 μL 反应体系:1 μL 40 ng/μL cDNA、10 μL 2×Mix、0.5 μL/0.5μL(F/R)、8 μL ddH2O;反应条件:95 ℃、40 s;95 ℃、30 s,(FN 59 ℃、45 s,E-cad 61 ℃、40 s,COLⅣ 57 ℃、45 s),40 个循环。2-ΔΔCt法计算FN、E-cad、COLⅣmRNA相对表达水平。
1.3.4 ELISA 检测细胞上清液中 IL-1β、IL-6、TNF-α水平 收集细胞培养液,3 000 r/min离心5 min收集上清,离心半径为32.3 cm。严格按照人IL-1β、IL-6、TNF-α ELISA试剂盒说明书检测上清液中IL-1β、IL-6、TNF-α 水平。
1.3.5 蛋白免疫印迹检测细胞中TGF-β1、Smad3、p-Smad3、α-SMA蛋白水平 收集细胞,添加蛋白裂解液冰上裂解10 min,14 000 r/min、4℃离心20 min提取总蛋白,离心半径为11.09cm。10%凝胶电泳分离蛋白,280 mA 40 min PVDF膜转膜;PVDF膜经5%脱脂奶粉室温封闭2 h;对应加入一抗TGF-β1、Smad3、p-Smad3、α-SMA,4℃孵育过夜;加入对应二抗,室温孵育1 h。避光显色,蛋白凝胶成像仪拍照和定量分析。条带灰度值通过image J软件分析获得。
1.4 统计学方法 统计学软件GraphPad 8.0进行数据分析,计量数据以均数±标准差(±s)描述,多组间比较采用单因素方差分析,组间两两比较采用SNK-q法。P<0.05时表示差异有统计学意义。
2 结果
2.1 各组细胞形态 对照组细胞呈多边形或卵圆性,分布均匀;高糖组细胞部分呈现长梭形、胞核呈梭形变;随着GE剂量的升高,细胞形态逐渐恢复正常。见图1。

图1 各组细胞形态情况(×200)Fig.1 Cell morphology of each group(×200)
2.2 GE对细胞中纤维化标志物FN、E-cad、COLⅣmRNA水平的影响 与对照组相比,高糖组细胞中FN、COLⅣmRNA水平升高,E-cad mRNA水平降低(P<0.05);与高糖组相比,GE 1 μmol/L 组细胞中FN mRNA 水平降低(P<0.05),GE 10、50、100 μmol/L组细胞中FN、COLⅣmRNA水平降低,E-cad mRNA水平升高(P<0.05)。见表 1。
表1 6组细胞中FN、E-cad、COLⅣmRNA水平比较(n=6,±s)Tab.1 Comparison of FN,E-cad and COLⅣmRNA levels in 6 groups of cells(n=6,±s)

表1 6组细胞中FN、E-cad、COLⅣmRNA水平比较(n=6,±s)Tab.1 Comparison of FN,E-cad and COLⅣmRNA levels in 6 groups of cells(n=6,±s)
注:与对照组相比,*P<0.05;与高糖组相比,#P<0.05。
组别 FN E-cad COLⅣ对照组 1.01±0.12 0.99±0.09 0.98±0.09高糖组 3.16±0.31* 0.37±0.04* 2.43±0.25*GE 1 μmol/L 组 2.42±0.25# 0.43±0.04 2.18±0.16 GE 10 μmol/L 组 2.14±0.19# 0.57±0.05# 1.96±0.18#GE 50 μmol/L 组 1.86±0.17# 0.73±0.08# 1.53±0.05#GE 100 μmol/L 组 1.34±0.12# 0.82±0.06# 1.38±0.14#
2.3 GE 对上清液中 IL-1β、IL-6、TNF-α 水平的影响 与对照组相比,高糖组上清液中IL-1β、IL-6、TNF-α 水平升高(P<0.05);与高糖组相比,GE 1、10、50、100 μmol/L 组上清液中 IL-1β、IL-6、TNF-α 水平降低(P<0.05)。见表 2。
表 2 6 组上清液中 IL-1β、IL-6、TNF-α 水平比较(n=6,±s)Tab.2 Supernatant of IL-1β、IL-6、TNF-α level comparison in 6 groups of cells(n=6,±s)

表 2 6 组上清液中 IL-1β、IL-6、TNF-α 水平比较(n=6,±s)Tab.2 Supernatant of IL-1β、IL-6、TNF-α level comparison in 6 groups of cells(n=6,±s)
注:与对照组相比,*P<0.05;与高糖组相比,#P<0.05。
组别 IL-1β IL-6 TNF-α对照组 26.46±3.16 49.19± 7.15 116.15±13.69高糖组 86.28±6.98* 136.48±13.96* 348.19±30.18*GE 1 μmol/L 组 67.49±5.86# 86.49± 9.14# 298.48±25.41#GE 10 μmol/L 组 56.66±4.94# 72.46± 7.92# 215.19±13.59#GE 50 μmol/L 组 43.71±4.69# 69.48± 7.18# 158.59±12.59#GE 100 μmol/L 组 34.85±6.15# 62.18± 6.75# 139.29±13.16#
2.4 GE 对细胞中 TGF-β1、Smad3、p-Smad3、α-SMA蛋白水平的影响 与对照组相比,高糖组细胞中 TGF-β1、p-Smad3/Smad3、α-SMA 蛋白水平升高(P<0.05);与高糖组相比,GE(1、10、50、100)μmol/L组细胞中 TGF-β1、p-Smad3/Smad3、α-SMA 蛋白水平降低(P<0.05)。见图 2、表 3。
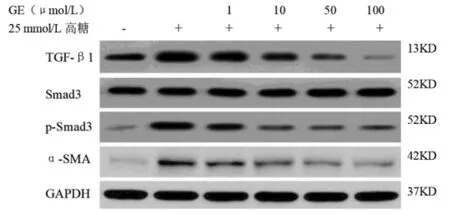
图2 6组细胞中 TGF-β1、Smad3、p-Smad3、α-SMA 蛋白水平情况Fig.2 TGF-β1、Smad3、p-Smad3、α-SMA protein level in 6 groups of cells
表 3 6 组细胞中 TGF-β1、Smad3、p-Smad3、α-SMA 蛋白水平比较(n=6,±s)Tab.3 Comparison of TGF-β1、Smad3、p-Smad3、α-SMA protein level in 6 groups of cells(n=6,±s)

表 3 6 组细胞中 TGF-β1、Smad3、p-Smad3、α-SMA 蛋白水平比较(n=6,±s)Tab.3 Comparison of TGF-β1、Smad3、p-Smad3、α-SMA protein level in 6 groups of cells(n=6,±s)
注:与对照组相比,*P<0.05;与高糖组相比,#P<0.05。
组别 TGF-β1 Smad3 p-Smad3/Smad3 α-SMA对照组 0.43±0.04 0.67±0.07 0.09±0.01 0.06±0.01高糖组 1.21±0.18*0.68±0.08 1.12±0.11* 0.38±0.04*GE 1 μmol/L 组 0.96±0.09# 0.65±0.06 0.89±0.06# 0.26±0.03#GE 10 μmol/L 组 0.45±0.05# 0.65±0.07 0.34±0.06# 0.19±0.04#GE 50 μmol/L 组 0.24±0.05# 0.67±0.08 0.35±0.04# 0.12±0.02#GE 100 μmol/L 组 0.11±0.01#0.68±0.05 0.32±0.04# 0.09±0.01#
3 讨论
栀子是茜草科植物栀子的果实,是中国的传统中草药,具有泻火除烦、凉血解毒、清热利湿、消肿止痛等作用。GE作为栀子重要活性成分,在糖尿病中具有保护胰岛β细胞结构,从而达到降血糖目的。在肾小管上皮细胞中是否亦发挥类似功效抑制肾小管上皮细胞转分化进而缓解糖尿病肾病,目前尚不清楚。
肾小管上皮细胞转分化是细胞在病理条件下的形态、结构、功能改变现象,与肿瘤转移、细胞修复、脏器纤维化关系密切,特别是脏器纤维化会引发肾衰竭[12]。FN、COLⅣ均是细胞外基质主要成分,在肾脏疾病早期即可出现,诱导胶原的分泌和沉积,进而促进肾间质纤维化过程[13]。正常情况下肾小管上皮细胞通过多种黏附蛋白紧密连接,E-cad作为黏附蛋白,在细胞膜上表达较多,具有维持细胞稳定性和完整性作用[14],E-cad在肾小管上皮细胞上表达降低,肾小管上皮细胞间黏附性丧失,变成单个细胞,促进肾小管上皮细胞转分化,E-cad是肾小管上皮细胞转化的第一道屏障[15]。本研究发现,与对照组相比,高糖组部分细胞呈长梭形、形态发生改变,细胞中FN、COLⅣmRNA水平升高,E-cad mRNA水平降低,提示高糖可诱导肾小管上皮细胞之间的黏附作用降低、肾小管上皮细胞转分化,且促进胶原的分泌和沉积,促进纤维化过程;与高糖组相比,GE各剂量组均可在一定程度上降低FN、COLⅣmRNA水平,升高E-cad mRNA水平,从而增加肾小管上皮细胞黏附、减少胶原沉积,实现对肾小管上皮细胞转分化的缓解作用。
炎症损伤是肾小管间质纤维化的关键,病理情况下产生各种炎症因子,炎症因子又通过旁分泌、自分泌等过程扩大炎症效应,产生炎症级联反应,促进糖尿病肾脏疾病的发展,导致肾纤维化过程[16]。本研究发现,与对照组相比,高糖组上清液中IL-1β、IL-6、TNF-α水平升高,提示高糖可促进肾小管上皮细胞炎症过程,加速炎症反应。与高糖组相比,GE各剂量组上清液中IL-1β、IL-6、TNF-α水平降低,提示GE具有抑炎作用,抑制肾小管上皮细胞炎症反应。
TGF-β1作为细胞增殖、分化的调控基因,亦可调节细胞外基质分泌[17],TGF-β信号通路已经公认作为肾小管上皮细胞转分化的关键介质,在血管内皮损伤、肾小管萎缩、足细胞损伤等多方面影响糖尿病肾病[18],TGF-β信号通路中Smad蛋白亦参与这一过程[19]。α-SMA作为肌成纤维标志蛋白,可促进细胞纤维肌丝的形成,TGF-β可通过Smad过程诱导成纤维细胞标志物α-SMA的表达从而成纤维细胞向肌成纤维细胞的转分化,促进FN、COLⅣ的分泌[20];TGF-β/Smad通路亦可参与炎症免疫信号通路过程[21]。本研究发现,与对照组相比,高糖组细胞中 TGF-β1、p-Smad3/Smad3、α-SMA 蛋白水平升高,提示高糖诱导肾小管上皮细胞TGF-β/Smad通路处于激活状态,促进细胞纤维肌丝形成和肾小管上皮细胞转分化。与高糖组相比,GE各剂量组细胞中 TGF-β1、p-Smad3/Smad3、α-SMA 蛋白水平降低,提示GE可抑制TGF-β/Smad通路,促进细胞间黏附作用、降低炎症反应,从而抑制肾小管上皮细胞转分化,抑制肾小管间质纤维化。
综上所述,GE可能通过降低FN、COLⅣmRNA水平,升高E-cad mRNA水平,从而增加肾小管上皮细胞黏附、减少胶原沉积,实现对肾小管上皮细胞转分化的缓解,同时抑制肾小管上皮细胞炎症反应,从而抑制肾小管上皮细胞转分化,抑制肾小管间质纤维化。其是否通过其他途径影响肾小管上皮细胞转分化,尚需进一步研究。
