结核性胸膜炎患者血清及胸水外泌体miRNAs差异表达分析
2022-08-30杜文胜朱杰华邓凤琳黄俊琼鄢仁晴
杜文胜,朱杰华,王 娟,邓凤琳 ,黄俊琼,鄢仁晴
(1.遵义医科大学附属医院 医学检验科,贵州 遵义 563099;2.遵义市第一人民医院 神经内科二病区,贵州 遵义 563000;3.遵义医科大学附属医院 输血科,贵州 遵义 563099)
结核病(Tuberculosis,TB)是严重的传染性疾病,从发现至今有一百多年的历史,却仍然没能消灭的原因是宿主与结核杆菌相互作用的机制不明确。导致结核病的病原体是结核分枝杆菌(Mycobacterium tuberculosis,MTB),结核分枝杆菌不同于一般细菌,虽无内外毒素和侵袭性酶,但其结构组分复杂,不同免疫细胞对结核杆菌的不同成分又有不同应答效应,故机体抗结核感染机制复杂,至今未明。外泌体(Exosomes,Exos)作为细胞内源性的小囊泡结构,介导体内不同细胞间的通讯,影响机体正常和病理状态,被证实与多种疾病相关,是最近研究热点[1-2]。目前外泌体与结核病关系的研究主要集中在外泌体特征、对细胞功能影响以及是否可以作为结核病诊断与鉴别诊断的潜在生物学标志方面,而关于外泌体与结核性胸膜炎关系方面研究较少。本研究通过分离纯化Exos后提取总RNA,再通过高通量测序分析其内差异表达miRNAs,并生物信息学分析其主要功能及可能的信号通路。
1 材料与方法
1.1 标本收集 收集来自遵义医科大学附属医院呼吸二科结核病专科的12例肺结核合并结核性胸膜炎患者(试验组)的血清和胸水标本,患者符合临床结核病的诊断标准[3],排除患有免疫抑制性疾病如艾滋病、糖尿病或自身免疫性疾病及应用免疫抑制剂。12 例健康体检者(对照组)血清标本。标本采集后即刻提取Exos,-80℃冰箱保存备用,留取小部分进行鉴定。本研究通过遵义医科大学附属医院伦理委员审查。
1.2 血清Exos提取与鉴定及miRNA 高通量测序
1.2.1 血清Exos提取 血清及胸水中Exos体提取采用辽宁润基生物科技有限公司生产的外泌体提取和纯化试剂盒,基本原理是试剂盒吸附柱上有一种根据外泌体膜结构分子特点而设计和修饰的树脂成分,这种树脂成分仅能与外泌体脂质双分子层成分结合,而不与样本中其它蛋白质结合实现外泌体的提取和纯化,从而得到较纯的完整外泌体(这种方法能够简单、快速地捕获生物样本中外泌体,又易于操作,适合常规外泌体实验要求,有广泛的下游应用)。血清及胸水中Exos提取的具体方法:(1)样本预处理:新鲜收集的血清和胸水样本置于冰上平衡,12 000×g,4℃离心15 min,去除细胞或细胞碎片,离心后将上清吸入新管中;(2)纯化柱平衡:吸取 1.0 mL平衡缓冲液加入纯化柱中 (已放入收集管中),300×g离心2 min,弃去滤液,纯化柱重新放入收集管中;(3)外泌体结合:吸取 1.0 mL 处理的血清或胸水样本放入15 mL离心管中,加入结合缓冲液 3.0 mL,颠倒混匀,然后将混合液分2次加入已平衡的纯化柱中,300×g离心2 min,倒掉滤液,将纯化柱再次放入收集管中;(4)外泌体洗涤:吸取1.0 mL洗涤缓冲液加入纯化柱中,300×g离心2 min,然后1 000×g离心2 min,弃去滤液和收集管;(5)外泌体洗脱:将纯化柱放入新的15 mL离心管中,加入300 μL洗脱液于吸附柱中,室温静置5 min,300×g离心2 min,将离心得到的溶液再加入纯化柱中,300×g 离心2 min,弃掉纯化柱,最后离心管中液体为提取的外泌体。-80℃保存待批量提取总RNA后送华大基因测序仪分析。
1.2.2 透射电子显微镜观察Exos形态及大小
1.2.2.1 外泌体电镜鉴定:1)将分离好的外泌体取出5 μL稀释到10 μL,全部滴加于铜网上沉淀1 min,滤纸吸去浮液;2)用磷钨酸10 μL滴加于铜网上沉淀1 min,滤纸吸去浮液;3)常温干燥15 min;4)80 kv进行电镜检测成像,获得透射电镜成像结果。
1.2.2.2 Western blotting技术检测外泌体表面标记CD9、CD63、Tsg101、calnexin 采用WB技术对Exos表面标记鉴定,基本操作步骤是:取10 μL获得的Exos,加入蛋白裂解液10 μL,加入5xSDS样品缓冲液5 μL,95 ℃加热5 min使蛋白变性,将样品20 μL进行上样,12%的凝胶进行电泳,然后转PVDF膜,检测表面标记蛋白,剩下的裂解样品进行蛋白BSA定量。

20 μg/lane。
1.2.3 miRNA 高通量测序 剩下的所有Exos样本送深圳华大基因公司进行miRNA测序分析,采用DNBseq平台高通量测序分析,获得原始图像数据。
1.3 miRNA 的注释及表达水平分析 利用软件Bcl2fastq(v2.17.1.14)对高通量测序结果原始图像数据进行处理,获得原始测序数据。采用软件FastQC(v0.10.1)对测序数据进行质量分析。使用二代测序数据质量统计软件Trimmomatic(version0.30)进行测序数据过滤,下载Rfam数据库中(version11)的家族序列数据,然后用BLASTN软件将过滤后的测序数据与其进行比对,获得注释miRNA。用Bioconductor软件包的edgeR(v3.4.6)进行miRNA差异表达分析,按差异显著性标准(差异miRNA表达变化2倍以上且P≤0.05)筛选检测结果,统计miRNA显著性差异表达上下调情况。
1.4 差异miRNA靶基因GO富集分析及KEGG富集分析 利用miRNAda软件,对数据库中已存在的 miRNA序列及其对应的基因组cDNA序列进行靶位点预测,通过GO富集分析推测与差异表达miRNA靶基因显著相关的生物学功能。通过KEGG富集分析,推断在差异表达miRNA靶基因涉及的显著性富集的分子通路,进而找出其所参与的主要生化代谢通路和信号转导途径。
2 结果
2.1 血清和胸水中Exos的鉴定 提取获得的外泌体经透射电子显微镜观察外泌体的大小和形态,显示这些囊泡的直径为30~100 nm、形态完整、球形、大小较为均一(见图1)。外泌体膜上富含参与外泌体运输的四跨膜蛋白家族(CD63、CD81和CD9)、热休克蛋白家族(HSP60、HSP70、HSPA5、CCT2和HSP90)以及一些细胞特异性的蛋白及乳凝集素等。其中CD63、CD9、CD81以及TSG101、HSP70、ALIX是最常用的标志物,本实验分析检测外泌体表面标记CD9、CD63、CD81、TSG101和Calnexin,结果显示CD9、CD63、TSG101有明显条带(见图2),提示成功分离血清和胸水中外泌体。

放大倍数1 μm、100 nm、200 nm。
2.2 miRNA差异表达分析 比较健康对照组与结核性胸膜炎患者外泌体中miRNA差异,对结果按注释的miRNA序列差异显著性标准(差异表达2倍以上且P≤0.05)进行筛选,统计显著差异miRNA表达情况。结果显示,与健康对照组比较,患者外周血外泌体中上调miRNA数大于下调miRNA数,胸水外泌体中下调miRNA数大于上调miRNA数;总体共筛选出差异表达miRNA有245个,其中患者血清外泌体中上调miRNA的有81个,下调的有45 个,胸水中上调的有30个,下调的有36个,其中血清和胸水Exos中同时上调最显著的10个 miRNA 及下调的显著的6个miRNA(见表1、2),245个差异基因表达量聚类分析(见图3)。

表1 血清和胸水Exos中上调最明显的前10个miRNA

表2 血清和胸水Exos中下调最明显的前6个下调miRNA
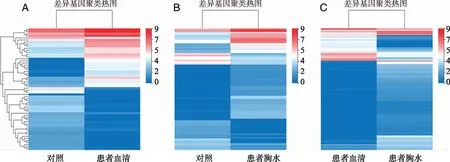
A:对照vs患者血清;B:对照vs患者胸水;C:患者血清vs患者胸水。
2.3 miRNA的靶基因预测 使用TargetScan和TarBase软件,共同对差异miRNA序列对应基因组cDNA 序列进行靶位点预测,主要的作用位点是6~8个碱基的多聚体保守序列,部分miRNA靶基因预测结果(见表3)。
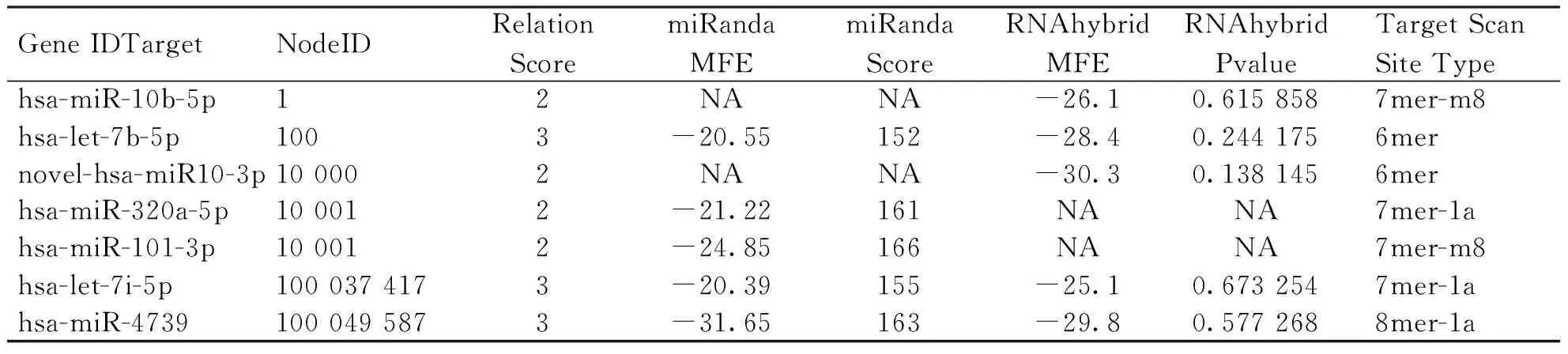
表3 部分miRNA 靶基因预测结果
2.4 差异miRNA靶基因功能分析 利用R语言对差异表达miRNA的靶基因进行基因本体GO 分析,根据差异靶基因功能集合绘制柱状图(见图4),结果显示这些靶基因不管是血清中还是在胸水中都主要参与细胞膜及细胞器的组成成分、细胞之间黏附链接、酶的催化活性、细胞内信号提呈、分子代谢及细胞生物学调控。采用KEGG分子信号通路公共数据库进行miRNA靶基因显著性富集能确定其主要参与的生化代谢途径和信号转导途径。本研究对差异miRNA靶基因进行 KEGG 富集分析,显示患者血清中差异miRNA靶基因主要富集参与细胞代谢途径、内吞作用通路、MAPK、RAS、cAMP信号通路等多种生化代谢途径,但在胸水中则主要富集与细胞自嗜、线粒体自嗜信号通路,其次是细胞代谢、抗生素生物合成和MAPK通路,这一点与血清中差异基因存在显著差别。差异miRNA靶基因 KEGG 富集气泡图及富集通路(见图5)。
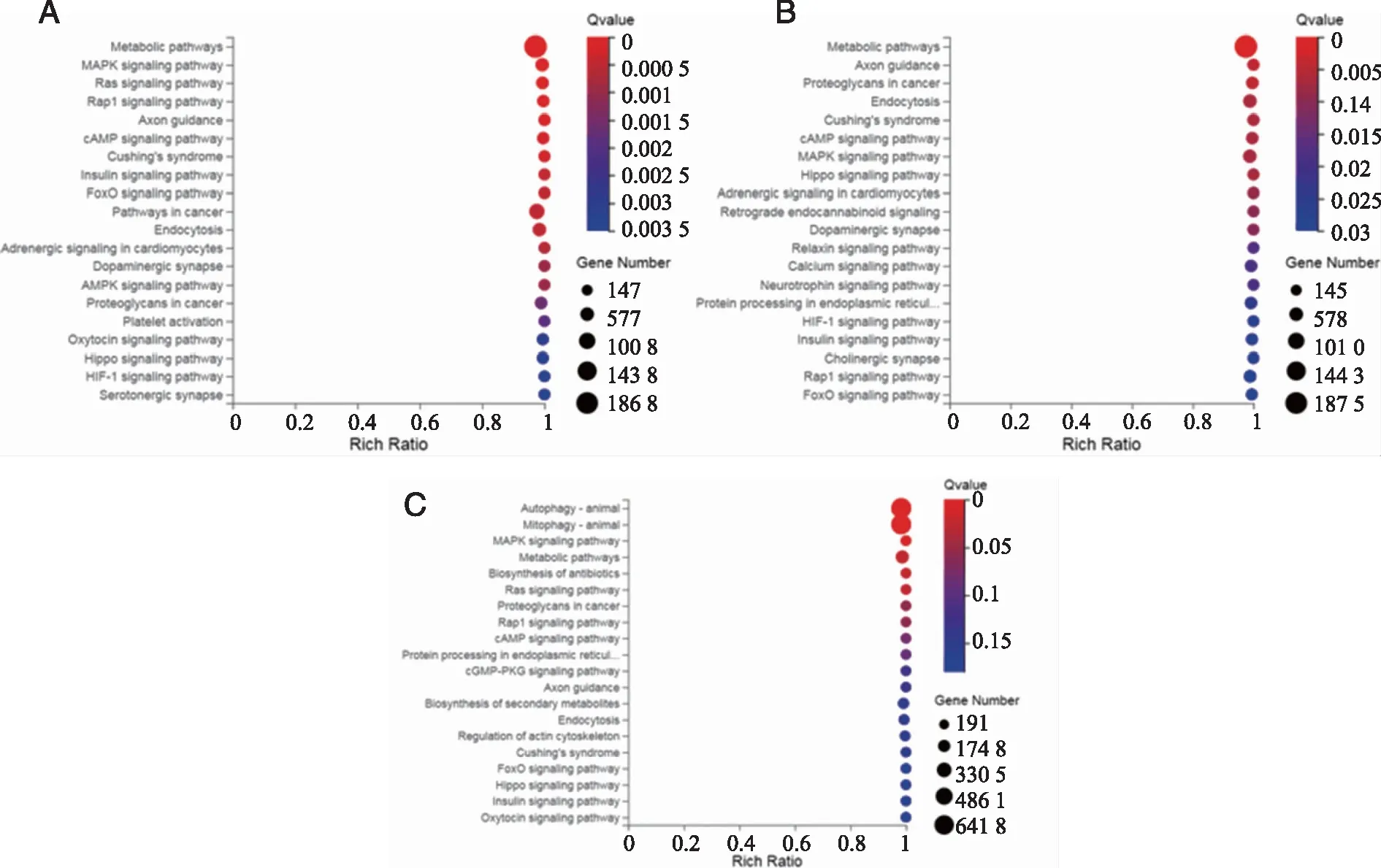
A:对照vs患者血清;B:对照vs患者胸水;C:患者血清vs患者胸水。
3 讨论
Exos的生物学功能体现主要与其来源及膜内外所含成分有关。不同来源的Exos,其功能亦不尽相同。多种作用方式使得Exos具有更广泛的生物学功能。其作用方式可以通过表面信号分子的直接接触,或生物活性成分的胞外释放或膜融合等过程,对细胞内的生理活动进行调节。目前Exos与多种疾病的发病机制有关的研究最为广泛,如癌症、神经系统疾病、生殖和感染性疾病以及免疫系统调节过程[4-6]。研究人员曾一度关注miRNA分子在肿瘤中的作用、机制和作为诊断标志物及临床应用,但miRNA分子在外界环境中极易降解,而外泌体具有膜性结构能够携带各种核酸分子并保护其免遭降解,使其作为肿瘤诊断或者治疗成为可能,已成为当前关于Exos功能研究最具吸引力的领域[7-8]。在再生医学中间充质干细胞(Mesenchymal stem cells,MSCs)来源的Exos具有急性肾脏损伤修复、肾缺血再灌注损伤修复、心肌梗死后心肌缺血保护、肝脏损伤治疗修复、皮肤创面修复治疗等方面作用,而这些作用均与Exos内容物密切相关[9]。Exos在促进细胞表型转化中也发挥重要作用[10]。
自Exos被广泛研究后其生物学功能已基本明确,并强调其参与了疾病的病理过程。肺脏作为一个由大量的免疫细胞和结构细胞组成复杂的器官,为了达到最佳功能,细胞间的交流是必不可少的,可见Exos在肺生物学和功能方面有望发挥关键作用[11]。如树突状细胞(Dendritic cells,DCs)衍生的Exos在其表面有共刺激分子,可以激活过敏原特异性的Th2细胞[12];嗜酸性粒细胞来源的Exos在哮喘患者中增加[13],失调的miRNA参与了与气道完整性相关的通路。在另一项研究中,重症哮喘患者Exos-miRNAs的变化与TGF-ß信号通路、Erbb信号通路和局部粘连有关[14],最近一项研究显示肺脏结构细胞和效应细胞都产生Exos,调节与哮喘有关的慢性发病过程[15]。在肺结核方面,目前对结核病外泌体的研究还处于初级阶段。最近的研究以描述体内和体外Mtb衍生Exos的分离和表征为主。研究结果显示Mtb衍生的Exos可通过将分枝杆菌衍生成分递送至受体细胞参与TB发病。也有研究显示从人体液中分离Exos可以作为结核病的快速诊断或预后生物标志物[16]。可见Exos为研究结核病感染过程提供了新的视角。如从肺结核患者分离出的血清来源的外泌体miR-484、miR-425和 miR-96的表达明显增高,且与结核病感染水平相关,提示外泌体 miRNAs具有诊断活动性肺结核的潜能[17]。在另一项研究中,作者分析了潜伏性结核患者和活动性结核患者以及健康对照血清Exos中miRNA变化,结果显示3组中Exos有不同miRNA谱,筛选出的两百多个差异表达的 miRNA中有一些 miRNA被进一步验证在潜伏性结核患者中存在特异性表达,可能会成为潜伏性和活动性结核病的潜在鉴别诊断标志物[18]。最近的一项研究关于卡介苗感染引起差异miRNA下游靶点生物信息学分析发现,差异miRNA在宿主代谢和能量通路发挥重要作用,且可以通过Exos传递到局部和远端细胞,调节细胞的功能[19]。
本研究通过收集结核性胸膜炎患者外周血和胸水中Exos,分离纯化miRNA并分析miRNA表达谱变化,发现结核性胸膜炎患者外周血和胸水Exos中miRNA表达发生显著性变化,且两者中miRNA变化不一致,血清Exos中差异表达miRNA上调数增加而胸水中Exos差异表达的miRNA下调数增加,总体基因表达水平均是下降的;部分miRNA存在高水平表达,其中表达差异最明显的是hsm-let-7家族成员。为了进一步了解这些差异miRNA的调节功能和分子机制,采用GO分析富集显示这些差异miRNA靶基因不管是血清中还是在胸水中都主要参与细胞膜及细胞器的组成成分、表现与细胞生长、代谢过程相关的蛋白分子结合和催化功能基因,这点与最近的一项研究相似[20]。同时进一步KEGG分析了其主要信号通路,发现这些差异miRNA 的靶基因在患者外周和胸水中存在差异,在患者血清中主要参与细胞代谢途径、内吞作用通路、MAPK、RAS、cAMP信号通路等多种生化代谢途径,而在胸水中则主要富集与细胞自嗜、线粒体自嗜信号通路,其次是细胞代谢、抗生素生物合成和MAPK通路,这一点与血清中差异miRNA存在显著差别。可见,外泌体中miRNA与结核病的发生发展有一定的相关性。
综上所述,结核性胸膜炎患者Exos中miRNA表达谱存在显著性差异,其中表达差异最明显的是hsm-let-7家族成员,为后续进一步研究提供了基础;hsm-let-7家族成员表达分析有望成为结核性胸膜炎患者诊断和分型的潜在标志物。其次,外泌体miRNA可能通过MAPK、RAS等信号通路参与疾病发生发展过程。
