基于α-synuclein表达探讨七氟烷对小鼠树突棘状态与学习记忆功能的影响
2022-08-30阎晨,刘涛,宣斐
阎 晨,刘 涛,宣 斐
(新疆医科大学附属肿瘤医院 麻醉与围手术期医学中心,新疆 乌鲁木齐 830000)
随着生命医学和科学技术的进步,越来越多疾病有机会通过全身麻醉后手术进行修复。然而,无论啮齿类还是灵长类动物,多数临床前实验都已证明,全身麻醉会造成认知功能损伤[1]。七氟烷是一种临床常用麻醉剂,其优势包括起效快、效能高、可控性强及血流动力学稳定[2]。回顾性研究分析显示,幼龄儿童接受七氟烷全身麻醉会增加其成年后读写功能损害的风险[3]。此外,在成年患者中,七氟烷麻醉也会造成短期或长期的认知功能损伤[4]。而在老龄患者中,全身麻醉手术则是老年痴呆发病的独立危险因素之一[5]。大脑海马组织是机体认知与学习中心,神经元树突是信息储存记忆的生理基础。α-突触核蛋白(α-synuclein,α-Syn)是广泛存在于海马神经元中突触蛋白,当α-Syn过量表达时会异常聚集,形成神经毒性,造成神经元树突棘可塑性降低,导致学习认知功能降低[6]。现阶段,已有不少研究讨论七氟烷对患者学习认知功能的影响机制[7],但针对α-Syn介导的树突棘可塑性降低鲜有报道。因此,本研究拟从体内和体外两个方面探讨七氟烷对小鼠树突棘结构与学习记忆功能的影响。
1 材料与方法
1.1 实验动物 16只野生型(Wild-type,WT)C57BL/6J 雄性小鼠与16只α-synuclein基因敲除(α-syn knockout,KO)C57BL/6J 雄性小鼠,由南京大学模式动物研究所提供。所有动物体质量为23~28 g,年龄8~10周,饲养于SPF动物房中,室内温度控制23~25 ℃,湿度控制为60%~70%,12 h/12 h昼夜节律。
1.2 实验试剂与仪器 七氟烷(上海艾伯维公司);HT22细胞株(上海赛百慷生物技术公司);高尔基染色试剂盒(美国HitoBiotec公司);DMEM培养基(美国Gibco公司);胎牛血清(内蒙古金源康生物公司);外源性脑源性生长因子(Brain-derived neurotrophic factor,美国Sigma公司);MTT噻唑蓝粉末(Thiazolyl blue tetrazolium bromide,北京索莱宝生物公司);Morris水迷宫(北京众实迪创公司);ZH-MZJ型小动物麻醉机(安徽正华生物仪器公司);Duo Link 邻位连接检测试剂盒(美国Sigma公司);兔源Anti-synuclein抗体(美国abcam公司);鼠源Anti-TrkB(美国abcam公司);兔源Anti-p-TrkB(沈阳万类生物公司);兔源Anti-TrkB(沈阳万类生物公司);鼠源Anti-β-actin(沈阳万类生物公司)。
1.3 动物分组与模型构建 所有动物适应实验室环境喂养1周后,随机分为WT对照组(WT Control),KO对照组(KO Control),WT+七氟烷(WT+Sev)组,KO+七氟烷(KO+Sev)组,每组8只。自制一个60 cm×30 cm×25 cm的透明麻醉盒,两侧设有进气口与出气口。将WT+Sev组与KO+Sev组小鼠放入麻醉盒中,进气口与麻醉机相连,出气口连接气体检测仪。通过麻醉机将空气混合3%七氟烷自进气口输入至麻醉盒中,麻醉过程中控制温度为37 ℃,持续6 h。WT Control组与KO Control组小鼠吸入空气。次日,待所有小鼠苏醒后进行水迷宫训练。
1.4 Morris水迷宫训练与测试Morris 水迷宫测试装置主体是一个圆柱体水箱,直径120 cm,高50 cm。水箱中注入约40 cm深水,设置水温条件为恒温24 ℃,并使用白色淀粉铺满水底,水箱中固定一个水面以下1.5 cm的逃生平台,水箱周围固定一些几何图形,帮助小鼠确认方向。水箱上装有一个摄像机记录小鼠游泳图像并将数据传输到计算机上进行轨迹分析。计算机将水面分为四个象限,设置存在逃生平台的象限为第一象限,顺时针设为第二现象,第三象限和第四象限。将小鼠从任意象限放到水池中,让它们自由游泳直到登上平台,设置自由寻找时间为90 s,90 s内未登上平台则引导至平台停留10 s。每天重复4次,训练4 d。分析小鼠潜伏期,平均速率和平均距离。结束训练后2 d,将小鼠自第三象限丢入水中,撤去逃生平台,记录小鼠逃避潜伏期,穿越平台次数与在第一象限中停留时间(靶象限)。
1.5 电生理场电位记录 将小鼠的大脑小心地取出放置在冷却的人工脑脊髓液缓冲液中,缓冲液包括124 mM NaCl,3 mM KCl,26 mM NaHCO3、2 mM CaCl2、1 mM MgSO4、1.25 mM KH2PO4和10 mM D-葡萄糖,通入95%O2和5%CO2。冰冻后将脑组织切成300 nm厚的切片,并在人工脑脊液缓冲液中孵育2 h。用金属探针将脑切片固定在8×8阵列微电极室中,并使用MED64 Mobius微电极阵列系统(Microelectrode array system,MEA)记录长期增强(Long-term potentiation,LTP)。测试刺激强度位于DG区域,并根据I / O(输入/输出)曲线设置为引起最大场兴奋性突触后电位(Field excitatory postsynaptic potential,fEPSP)响应的30%(或50%)。20 min后,记录基线,并通过重复3次的100 Hz高频刺激诱导LTP,并在另外60 min内记录fEPSP斜率变化,记为长时程电位(Long-term potentiation,LTP)。
1.6 高尔基染色与计数 按照HitoBiotec公司生产的Hito Golgi-Cox Optimstain Kit 高尔基染色试剂盒中说明书步骤进行处理。取小鼠脑组织,浸没于试剂盒中溶液1与溶液2混合液中(提前24 h配置),次日跟换混合液,室温避光保存2周。取组织洗去混合液,浸入溶液3中,避光储存24 h,更换溶液再放置4 d。取组织放入预冷的异戊烷中冷凝成块,擦去表面异戊烷。使用冰冻切片及切成约100 μm切片,载玻片贴片后避光阴干。玻片置入溶液4与溶液5混合液中反应,结束后蒸馏水冲洗,切片放入梯度乙醇中脱水,每次60 s,再以二甲苯溶液透化组织,每次2 min。最后使用中性树脂封片,显微镜下观察捕获图像,以神经元树突棘密度反映神经元形态结构变化。
1.7 Western blot实验 取小鼠海马组织大脑,放于冰盒上,全程维持低温环境,称重后根据重量加入RIPA裂解液。使用匀浆机充分匀浆10 min,结束后冰浴充分裂解30 min,离心机预冷4 ℃,调至12 000 rpm,离心30 min,精确记录体积,检测蛋白浓度,加入溴酚蓝上样缓冲液。将样品放入100 ℃金属浴中煮沸5 min,待冷却后冰箱冷冻保存。配置SDS-PAGE凝胶进行电泳,每一泳道上样50 μg,设置电泳条件60 V,30 min,90 V,100 min,待溴酚蓝到达分离胶底部时,停止电泳,根据分子标记物切取所需蛋白范围的凝胶,剪取与凝胶大小相似的PVDF膜,选择湿转转膜法,设置条件恒流300 mA,60 min。取出PVDF膜,4%脱脂牛奶中,室温孵育1 h。洗净牛奶后,将PVDF膜放入对应一抗溶液中,4 ℃条件下孵育过夜。次日取出条带漂洗,加入HRP标记的二抗稀释液,摇床上避光孵育1 h。PBST漂洗条带后,加入配好的ECL发光液,在凝胶成像系统下显影,保存图像,最终使用Image J软件进行分析。
1.8 细胞培养与活率 检测小鼠海马神经元细胞HT22细胞培养于含10%胎牛血清的DMEM培养基中,培养基中添加100 μg/mL链霉素与100 U/mL盘林西林,培养条件为37 ℃培养箱中通入5% CO2。待细胞生长至90%融合,胰酶消化细胞,等量接种于96孔板中,设组为对照组(Control),七氟烷组(Sev),80 ng/mL脑源性神经营养因子组(BDNF 80 ng/mL),七氟烷+40 ng/mL脑源性神经营养因子组(Sev+BDNF 40 ng/mL),七氟烷+80 ng/mL脑源性神经营养因子组(Sev+BDNF 80 ng/mL)。七氟烷组暴露于含2%七氟烷环境中2 h,随后添加BDNF,在正常培养环境中孵育24 h。次日取出96孔板,弃去上清,每孔添加50 μL 5 mg/mL MTT溶液,培养箱中孵育2 h。取出96孔板,每孔添加100 μL DMSO溶液,充分震荡10 min使甲臜充分溶解,在570 nm激发波长处测定其吸光度值。
1.9 α-synuclein与TrkB的邻位 连接(Proximity Ligation Assay,PLA)检测根据DuoLink厂家提供说明书进行细胞处理操作。将步骤1.8中培养于96孔板中的细胞PBS漂洗后加入兔源Anti-α-Synuclein与鼠源Anti-TrkB抗体孵育2 h。PBS漂洗样本后加入正链PLA探针识别鼠源抗体和负链标记的PLA探针识别兔源抗体,共同孵育1 h。PBS漂洗样品并加入连接酶,孵育1 h,DAPI染色液37 ℃避光孵育15 min。PBS漂洗样品,加入扩增缓冲液,使用荧光显微镜对每个细胞中红色点信号进行记录,最后使用Duolink成像工具对结果进行定量。
2 结果
2.1 七氟烷对小鼠认知功能的影响 为了探究在α-synuclein存在情况下,七氟烷对小鼠学习记忆功能的影响,本研究测试了Morris实验中小鼠的空间参考记忆。如图1、表1所示,训练期间,WT Control组与KO Control组在逃避潜伏期没有显著性差异(P>0.05)。与此同时,如表2所示,测试期间,WT Control组与KO Control组在逃避潜伏期,穿越平台次数和靶象限停留时间之间都不存在统计学差异(P>0.05)。然而,与Control组相比,七氟烷吸入麻醉的小鼠训练期间逃避潜伏期显著增加(P<0.05),在测试中,穿越平台次数显著减少(P<0.05),靶象限停留时间显著增加(P<0.05)。此外,KO+Sev组小鼠Morris水迷宫各项指标优于WT+Sev组小鼠,且测试中逃避潜伏期两组数据差异具有统计学意义(P<0.05)。
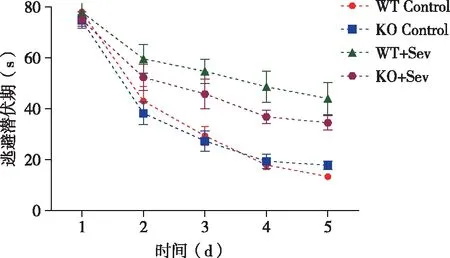
图1 训练期间小鼠逃避潜伏期

表1 训练期间小鼠逃避潜伏期统计

表2 测试期间小鼠逃避潜伏期、穿越平台次数与靶象限停留时间统计
2.2 七氟烷对小鼠海马 CA3-CA1途径长时程电位与树突棘状态的影响如图2、3所示,脑组织电生理检测中兴奋性突触后电位(fEPSP)斜率常作为观察LTP变化的指标。WT Control组小鼠与KO Control组小鼠海马组织CA1-CA3途径中LTP没有差异(P>0.05)。与对照组相比,七氟烷造成小鼠fEPSP斜率显著降低(P<0.05),此外,与WT+Sev组相比,KO+Sev组小鼠fEPSP斜率降低,且存在显著性差异(P<0.05)。高尔基染色树突棘密度能够反映树突棘的可塑性,与LTP结果一致,WT Control组与KO Control组小鼠海马CA1区神经元密度较高且没有显著差异,但七氟烷吸入麻醉造成小鼠海马CA1区神经元密度降低。
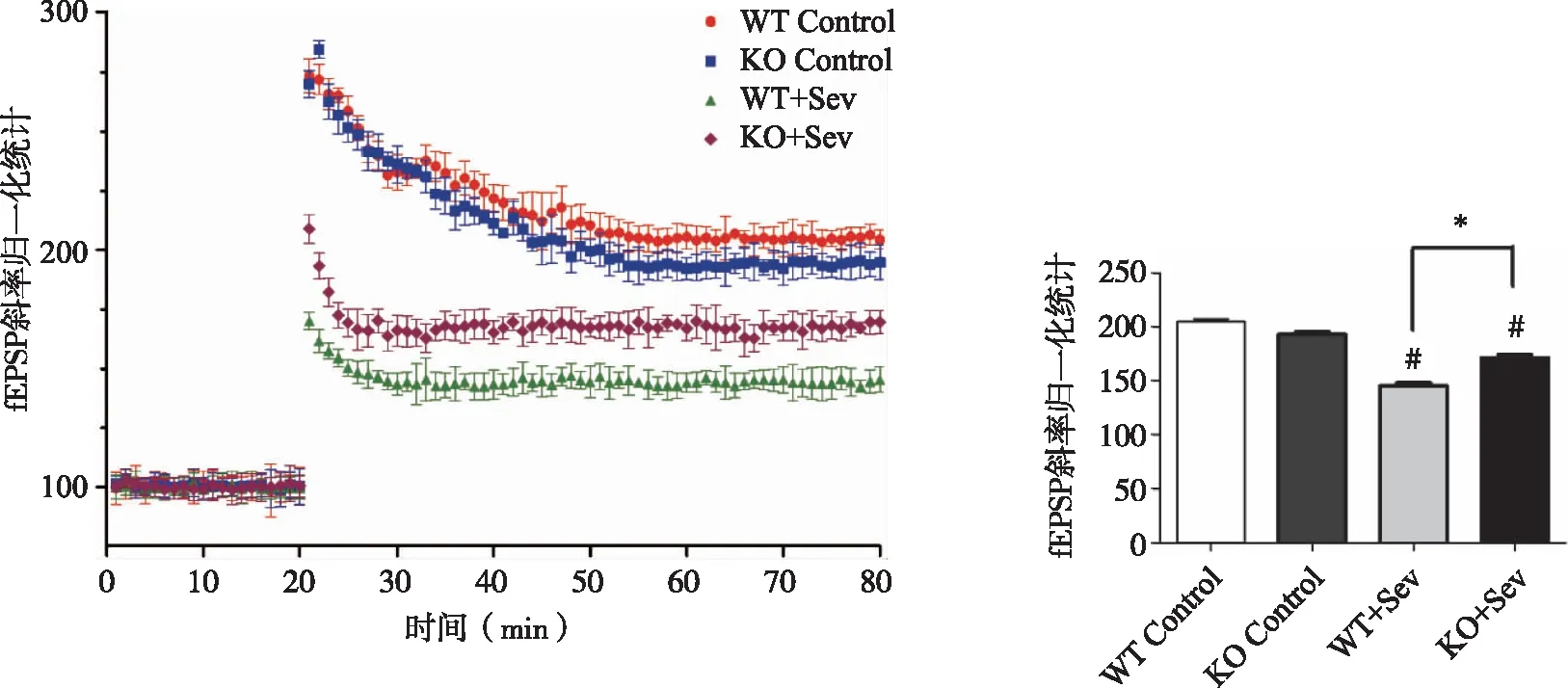
#:与Control组比较, P<0.05;*:与WT+Sev组比较, P<0.05。
2.3 七氟烷对小鼠海马组织中α-synuclein、BDNF与p-TrkB的影响 如图4所示,本研究中使用小鼠为WT小鼠与KO小鼠,因此,α-synuclein KO小鼠基本不表达α-synuclein,WT Control组小鼠正常表达α-synuclein。七氟烷吸入则显著增加了小鼠脑组织中α-synuclein表达(P<0.05)。此外,本研究中,与Control组相比,七氟烷给药显著降低了小鼠海马中BDNF表达(P<0.05),降低了TrkB磷酸化水平(P<0.05)。与此同时,与WT+Sev组相比,KO+Sev组小鼠脑组织中BDNF与TrkB表达显著增加(P<0.05)。

#:与Control组比较, P<0.05。

#:与Control组比较, P<0.05;*:与WT+Sev组比较, P<0.05。
2.4 外源性BDNF对七氟烷干预的HT22细胞活率的影响 如图5所示,与对照组相比,七氟烷造成HT22细胞活力显著降低(P<0.05),而外源性BDNF干预则促进了HT22细胞的生长(P<0.05)。与此同时,细胞体系中添加外源性BDNF能够显著提高HT22细胞活率(P<0.05),且具有剂量依赖性。

#:与Control组比较, P<0.05;*:与Sev组比较, P<0.05。
2.5 外源性BDNF对HT22细胞中α-Syn与TrkB邻位结合的影响 如图6所示,对照组与BDNF(80 ng/mL)组HT22细胞中几乎检测不到α-Syn与TrkB的邻位结合。与对照组相比,七氟烷造成HT22细胞中α-Syn与TrkB邻位结合较多,然而,外源性BDNF干预则显著减少了α-Syn与TrkB结合,且结果呈剂量依赖性。

A:Control组;B:Sev组;C:BDNF(80 ng/mL)组;D:Sev+BDNF(40 ng/mL)组;E:Sev+BDNF(80 ng/mL)组;红色点表示α-Syn与TrkB结合;#:与Control组比较, P<0.05;*:与Sev组比较, P<0.05。
3 讨论
本研究重点论证了小鼠吸入七氟烷麻醉会提高海马组织中α-synuclein(α-Syn)表达,降低BDNF表达,且α-Syn会与BDNF竞争TrkB受体,干扰TrkB信号传导,造成长时程电位(Long-term potentiation,LTP)抑制与树突棘可塑性损伤,导致小鼠学习和记忆功能障碍。
Morris水迷宫训练与测试是研究啮齿类动物空间学习功能的首要实验方法[8]。本研究中,WT Control组与KO Control组中两种不同表型小鼠在空间记忆方面表现相似,没有差异。然而,七氟烷吸入麻醉却会造成WT小鼠与KO 小鼠在空间记忆与获取信息方面,与对照组相比,表现变差。因此,七氟烷麻醉是造成小鼠学习与记忆能力损伤的原因。与此同时,水迷宫训练与测试中,部分结果显示KO+Sev组小鼠优于WT+Sev组小鼠,提示敲除α-synuclein在一定程度上能够缓解七氟烷造成的小鼠学习记忆损伤。
LTP的形成被认为是学习和记忆过程中潜在的细胞机制[9]。本研究结果显示,正常情况下,敲除α-Syn不影响LTP。这可能是因为LTP主要是由于CA3-CA1途径中突触后电位机制引起的,但是α-Syn对突触传递的影响主要是突触前,因此,KO Control组小鼠海马CA3-CA1途径中LTP与WT Control组小鼠没有差异。然而,α-Syn过量表达却会造成神经毒性。α-Syn广泛存在于中枢神经系统的神经元中,位于突触小泡附近的突触前末端。近期研究显示,α-Syn在阿尔兹海默病研究中会增强Aβ蛋白分泌,上调淀粉样前体蛋白表达的同时导致细胞死亡[10]。此外,α-Syn的表达增加,在细胞培养和动物模型中造成炎症反应,从而抑制LTP的形成,导致小鼠空间记忆功能的退化[11]。因此,本研究中,与文献报道相似,七氟烷造成α-Syn表达增加,造成小鼠海马神经元突触可塑性降低,导致LTP抑制。然而,与WT+Sev组相比,KO+Sev组小鼠海马神经元LTP显著升高,提示α-Syn表达升高是造成LTP抑制的重要原因。
与LTP密切相关的是神经元突触可塑性。神经元是信息接纳、加工与整合的基本单位。树突棘是神经元树突上棘状突起,与电信号接收和传递密切关联,且树突棘密度往往与信息传递速率相关[12]。与此同时,树突棘的形成、脱落、扩张和萎缩与突触可塑性相关,树突棘的高度可塑性是脑内神经元发挥学习记忆功能的生理基础[13]。因此,本研究中显示的七氟烷介导的小鼠海马CA1区树突棘密度降低是导致小鼠Morris水迷宫中空间记忆能力衰退的重要原因。
海马组织作为大脑长期学习与记忆核心区域,也是七氟烷吸入麻醉过程中最敏感的区域。海马组织中BDNF是学习与记忆涉及的神经生物学机制的关键分子[14]。通过检测小鼠海马组织中BDNF相关蛋白表达,结果显示与对照组相比,七氟烷造成小鼠海马组织中BDNF与p-TrkB表达显著降低,且α-Syn敲除小鼠在七氟烷干预后,与WT+Sev组小鼠比较,BDNF与p-TrkB表达显著升高。溯其原因是七氟烷造成BDNF表达降低,BDNF作用机理是通过原肌球蛋白激酶受体B(Tropomyosin kinase receptor B,TrkB)起作用。BDNF与TrkB的结合通过其胞内域中酪氨酸残基的构象变化发生磷酸化,激活有丝分裂原激活的蛋白激酶(Mitogen-activated protein kinase,MAPK),磷脂酰肌醇3-激酶(Phosphatidylinositol 3-kinase,PI3K)和磷脂酶C-γ1(Phospholipase C-γ1,PLC-γ1)触发其二聚化信号通路,介导神经元分化,提高神经元存活和促进神经发生[15]。此外,当α-Syn过度表达时,α-Syn会与BDNF选择性竞争TrkB受体,从而抑制BDNF-TrkB信号通路,抑制神经元分化并导致神经元死亡[16]。本研究中,通过体外细胞实验首先验证了外源性BDNF能够有效改善七氟烷造成的HT22细胞死亡。与此同时,本研究通过邻位连接实验证实了α-Syn与BDNF竞争性结合TrkB位点。
综上所述,七氟烷会造成小鼠认知功能损伤,其机理是通过增加α-Syn表达,下调BDNF水平,减少TrkB磷酸化,从而降低海马CA1区树突棘可塑性,抑制长时程电位从而造成小鼠学习记忆功能损伤。
