复方肺毒清颗粒的制备工艺及质量标准*
2022-08-30张聪子张金玲杜光王维武姜琼夏松柏陈辉甘露珍徐金军章登政傅勃饶志威
张聪子,张金玲,杜光,王维武,姜琼,夏松柏,陈辉,甘露珍,徐金军,章登政,傅勃,饶志威
(1.咸宁市中心医院、湖北科技学院附属第一医院药学部,咸宁 437100;2.华中科技大学同济医学院附属同济医院药学部,武汉 430030;3.湖南中医药大学第一附属医院脾胃病科,长沙 410000)
复方肺毒清颗粒由防风、炒白术、鱼腥草、赤芍、柴胡、桔梗、浙贝母、冬桑叶、川桂枝、炒白芍、板蓝根、生甘草等12味中药组成,具有辛温解表、清热解毒、宣肺止咳功效。方中柴胡作为君药,有祛风清肺、抵御疫毒之功。2020年初新型冠状病毒肺炎(简称新冠肺炎)疫情暴发后,该方经湖北省咸宁市新冠肺炎疫情防控指挥部医疗专家组讨论通过,在咸宁地区推荐使用。在咸宁市中心医院确诊的117例患者中,服用103例,使用率88.03%;在咸宁市第一人民医院确诊的223例患者中,服用200例,使用率89.69%;嘉鱼县医疗机构初期确诊的患者中有127例使用,治愈41例,治愈率32.28%,且无死亡病例;同时在中医防治新冠肺炎中具有较高使用频次,在抗击新冠肺炎疫情中发挥了积极作用[1-3]。临床应用过程中,由于中药复方合剂多采用传统煎煮方式给药,患者用药依从性差。因此,本实验将该方制备成复方肺毒清颗粒,并进行质量标准研究,报道如下。
1 仪器与试药
1.1试药 防风(批号:190601)、炒白术(批号:201001)、鱼腥草(批号:200701)、赤芍(批号:191201)、柴胡(批号:191201)、桔梗(批号:200701)、浙贝母(批号:191201)、冬桑叶(批号:200101)、川桂枝(批号:200101)、炒白芍(批号:191201)、板蓝根(批号:190501)、生甘草(批号:201001)均购自安徽省亳州市坤源医药有限公司,药材经咸宁市中心医院主管中药师孟婷鉴定,均符合《中华人民共和国药典》2020年版一部规定。
糊精(安徽山河药用辅料股份有限公司,批号:200308)、甜菊糖(安徽山河药用辅料股份有限公司,批号:200308)、柴胡皂苷a(含量:94.80%,批号:110777-201912,购自中国食品药品检定研究院);乙腈(批号:202889)、甲醇(批号:203074)为色谱级,均购自美国Fisher chemical公司。
1.2仪器 Thermo UltiMate3000高效液相色谱仪(赛默飞世尔科技公司);DSH-50-1电子水分测定仪(上海奥平科学仪器制造有限公司);ZP-200振荡器(苏州培英实验设备有限公司);TDL-60B低速离心机(上海安亭科学仪器厂);GLTQ-50L多功能提取浓缩罐(上海格翎环境科技有限公司);101-2AB电热鼓风干燥箱(天津市泰斯特仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);YOKO-BD薄层电动点样仪(武汉药科新技术开发有限公司);ZY-600U薄层色谱自动成像分析系统(北京先驱威锋技术开发公司)。
2 方法与结果
2.1复方肺毒清颗粒的制备 处方组成为:防风、炒白术、鱼腥草、赤芍、柴胡、浙贝母、冬桑叶、川桂枝、炒白芍、板蓝根各10 g,桔梗5 g,生甘草6 g,总剂量111 g,水煎服(加水量为药材量的5.4倍),每日2剂,早晚各1次。
称取处方量各药材饮片,分别加入一定量水,置多功能提取器内,采用水回流提取法提取3次,得到含固率为29.3 %的干膏,粉碎,备用。将干浸膏、糊精、甜菊糖按照一定比例混合,制粒,干燥,整粒。本成品检验合格后制成单包装颗粒,每袋装量10 g,贴标签。
2.2颗粒评价指标的测定
2.2.1成型率的计算 将制备好的颗粒称质量,先过筛孔内径2.00 mm(一号)筛,再过筛孔内径0.18 mm(五号)筛,收集能通过筛孔内径2.00 mm筛,但不能通过筛孔内径0.18 mm的颗粒,称质量,计算成型率。
2.2.2溶化率的测定 在干燥至恒质量的10 mL离心管中加入精密称量的颗粒,加入沸水5 mL,持续搅拌5 min,3000 r·min-1离心15 min(离心半径r=13 cm),弃上清液,将残渣在80 ℃条件下干燥至恒质量,精密称定质量,计算溶化率。
2.2.3休止角的测定 采用固定漏斗法,将漏斗固定于水平放置的坐标纸上高1.5 cm的位置(H),缓慢将颗粒沿漏斗壁倒入最上面的漏斗中,直到形成的颗粒圆锥尖端接触到漏斗口为止,测算圆锥底部的直径(2R),计算休止角tgα=H/R。成型性、溶化率、休止角的权重系数各设为45%,30%,25%,综合评分=45%×(成型率/最大成型率)+30%×(溶化率/最大溶化率)+25%×(最小休止角/休止角)[4]。
2.2.4堆密度的测定 取本品颗粒适量,沿壁缓慢加入干燥至恒质量的10 mL量筒中,待颗粒表面至10 mL刻度处,称质量,减去干燥空量筒质量即为颗粒的质量,平行测定3次,计算堆密度。堆密度ρ=颗粒质量/容积×100%。
2.2.5吸湿性的测定 配制氯化钠饱和溶液,置于玻璃干燥器中,25 ℃恒温平衡48 h。精密称定本品颗粒2 g,平行3份,置于干燥至恒质量的称量瓶中,于24,48,72,96,120,144,168 h后称质量,计算吸湿百分率。吸湿率越低颗粒越不容易吸潮,质量也越稳定[5-6]。吸湿百分率=(吸湿后颗粒质量-吸湿前颗粒质量)/吸湿前颗粒质量×100%。
2.2.6水分测定 采用水分测定仪平行测定3次。
2.3处方筛选
2.3.1药物与辅料比例考察 称取干浸膏粉20.3 g 3份,分别称取糊精10.2 g(药辅比1:0.5)、14.2 g(药辅比1:0.7)、18.3 g(药辅比1:0.9),将干浸膏粉与糊精混合,过筛孔内径0.25 mm使其充分混匀;按一定比例混合,加入适宜的黏合剂制备软材,挤压过筛制粒,干燥30 min。整粒后遵循《中华人民共和国药典》2020年版对颗粒成型率、溶化率、休止角等指标进行综合评价,以此优选最佳药辅比。
根据复方肺毒清颗粒制备工艺,按处方称取各药材饮片30付,总质量为3330 g,置多功能提取器内,总共提取3次。第1次加10倍量水,煎煮2 h(水沸腾后计时),第2次加8倍量水,煎煮2 h,第3次加6倍量水,煎煮1 h。合并水煎液,滤液浓缩至相对密度约1.08(60~70 ℃)的稠膏4160 g,将稠膏烘干,得到干膏1218 g(含固率为29.3 %)。采用湿法制粒,筛选药辅比,综合评分显示最高的药辅比为1:0.9,但是为减少患者服用量,增加患者的顺应性,选择1:0.5比例作为最佳药辅比(表1)。取20份处方量的干浸膏做小试颗粒,得到水分为3.19%的肺毒清颗粒(每袋10 g)。

表1 药物与辅料比例考察 Tab.1 Investigation on drug-to-excipient ratio
2.3.2矫味剂选择 为寻找最佳比例,选用木糖醇作为矫味剂,进行以下实验:取3 g干膏粉6份,分别加入木糖醇0.10,0.20,0.30,0.40,0.50,0.60 g搅拌均匀。请6名实验员品尝口感,均认为口感较苦。另选择甜菊糖作为矫味剂,称取1.0:0.5药辅比颗粒1 g,加入甜菊糖0.01 g,相同6名实验员品尝口感,均认为口感稍甜,具香甜味,故选用1% 甜菊糖作为矫味剂。
2.3.3小试工艺结果 本品颗粒剂粒度均匀,颗粒颜色由浅棕至深棕色,《中华人民共和国药典》2020年版规定,能通过筛孔内径2.00 mm但不能通过筛孔内径0.18 mm的颗粒及粉末所占百分比<15%符合标准,本品颗粒成型率为96.31%,符合《中华人民共和国药典》规定;休止角是考察药物的流动性,休止角越小,颗粒剂的流动性越好[7],一般认为,α≤30 °时流动性好,α≤40 °时可以满足生产过程中对流动性的需求,本品颗粒的休止角为15.47 °,颗粒的流动性较好;颗粒剂的成型率、溶化率、休止角、堆密度具体结果见表2。

表2 小试生产的复方肺毒清颗粒(批号20201201)的检测结果 Tab.2 Test results of compound Feiduqing granules produced in a small scale(batch No.20201201) n=3
吸湿性检测7个时间点,每24 h检测1次,分别是24,48,72,96,120,144,168 h测定颗粒剂的吸湿性,计算吸湿百分率。实验结果表明,小试生产的复方肺毒清颗粒,吸湿拟合回归曲线方程为Y=-0.00 043X2+0.137 7X+1.995 7,R值为0.994 1,其拟合程度较好,平衡吸湿时间为137.7 h,平衡吸湿率为12.80%,见表3。
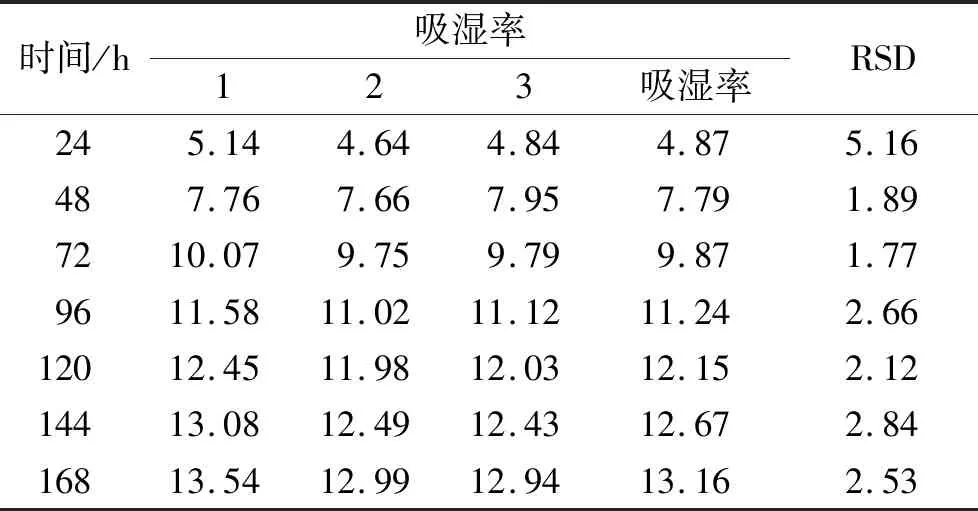
表3 复方肺毒清颗粒(批号20201201)在不同时间的吸湿百分率 Tab.3 Moisture absorption rate of compound Feiduqing granules(batch No.20201201) at different times %
2.3.4制剂成型工艺验证 采用湿法制粒,根据药辅比筛选,以干膏粉为原料,以糊精和甜菊糖为辅料,75%乙醇、纯化水适量作润湿剂,干膏粉:糊精:甜菊糖=1:0.50:0.01的药辅比进行制剂,上述原辅料均过筛孔内径0.25 mm(60目)后,在筛孔内径1.18 mm(14目)标准筛上挤压,制湿颗粒,干燥30 min,整粒后分单包装。按照颗粒剂相关检查项目对其进行粒度、水分、溶化率检查,结果显示:该小试颗粒的粒度均<15%,水分均<5%,颗粒均完全溶化,符合《中华人民共和国药典》2020年版颗粒剂相关检查要求。
2.4柴胡的薄层鉴别
2.4.1供试品溶液的制备 精密称取本品颗粒2.0 g,研钵中研细,加入甲醇12 mL溶解,超声处理15 min,滤过,挥干后得滤渣,加入纯化水1.5 mL溶解滤渣,溶解后加入水饱和正丁醇溶液5 mL,置于分液漏斗中震荡萃取3次,将正丁醇合并,挥干正丁醇溶液得滤渣,滤渣加甲醇定容至1.5 mL,作为供试品溶液[8]。
2.4.2对照品溶液的制备 精密称取柴胡皂苷a对照品0.1 mg,加入甲醇2 mL,制成浓度为0.05 mg·mL-1对照品溶液。
2.4.3阴性溶液、对照药材溶液的制备 取不含柴胡药材的阴性颗粒及柴胡药材,同“2.4.1”项方法制成阴性对照溶液和对照药材溶液。
2.4.4鉴别 吸取供试品溶液及阴性对照溶液5 μL,对照药材溶液及对照品溶液10 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯:乙醇(95%):水=8:2:1的比例为展开剂进行展开,晾干,喷2%对二甲氨基苯甲醛的40%硫酸溶液显色剂,于105 ℃ 加热至斑点清晰,置紫外灯(波长365 nm)下检视[9]。供试品与对照药材及柴胡皂苷a对照品相应的色谱位置上显示相同的黄色荧光斑点,而阴性对照无相应的斑点,见图1。
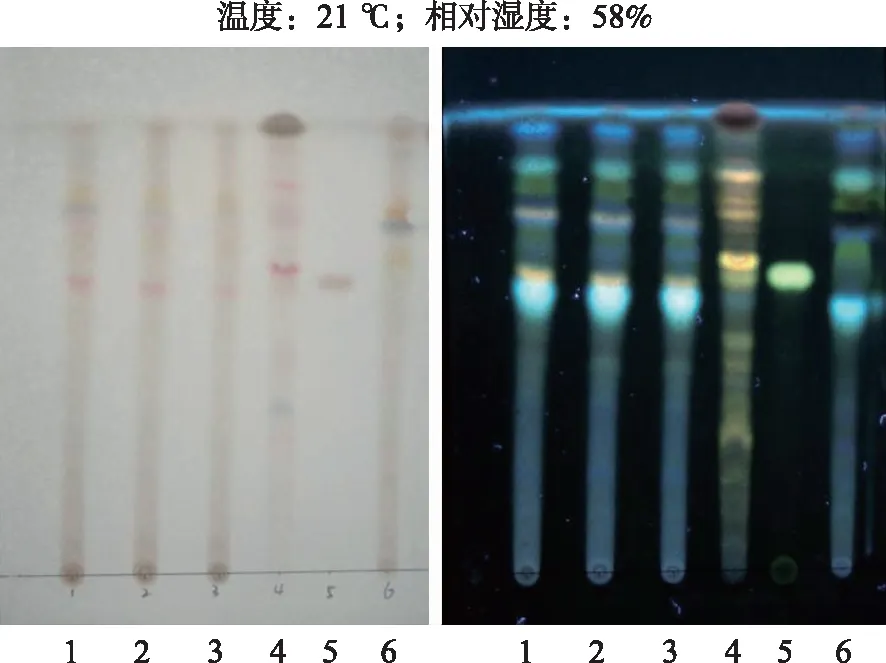
1—3.样品;4.柴胡;5.柴胡皂苷a对照品;6.阴性对照品。图1 柴胡皂苷a的薄层色谱鉴定 1—3. sample;4.bupleuri radix;5.saikosaponin a reference substance;6.negative reference.Fig.1 TLC identification of saikosaponin a
2.5柴胡皂苷a的含量测定
2.5.1色谱条件 色谱柱:6 L sciences Inc ODS-3(4.6 mm×250 mm,5 μm);流动相A为乙腈,流动相B为水,梯度洗脱:0~40 min,85%→40%B;40~45 min,40%→85%B;柱温40 ℃;流速1 mL·min-1;检测波长为210 nm,进样:20 μL,在此条件下,样品中柴胡皂苷a与其他成分色谱峰完全分离,和相邻色谱峰的分离度>1.5。
2.5.2对照品溶液的制备 精密称取柴胡皂苷a 5.17 mg,加入甲醇5 mL溶解,配成柴胡皂苷a 1.034 mg·mL-1的母液,密封,放入4 ℃冰箱,备用。
2.5.3供试品溶液的制备 精密称取样品10.013 0 g,研钵中研细,置具塞锥形瓶中,加入含5%浓氨试液的甲醇溶液25 mL,密塞,超声(功率:200 W,频率:40 kHz)30 min,离心取上清液10 mL,挥干后加甲醇定容至5.0 mL即为供试品溶液。
2.5.4阴性溶液的制备 精密称取缺柴胡的样品颗粒,同“2.5.3”项方法制成阴性对照品溶液。
2.6方法学考察
2.6.1专属性实验 在选定的色谱条件下,分别取对照品溶液、供试品溶液、阴性溶液各20 μL,注入高效液相色谱仪测定,结果柴胡皂苷a标准品与供试品中其他成分色谱峰完全分离,在与对照品色谱相应的保留时间上有相同的色谱峰,而阴性溶液无干扰,见图2。
2.6.2线性关系实验 将母液浓度为1.034 mg·mL-1柴胡皂苷a标准品,等比稀释得0.064 6,0.129 3,0.258 5,0.517 0,1.034 0 mg·mL-15个浓度样品,每个连续进样2次,每次20 μL。以含量为横坐标,色谱峰面积为纵坐标,绘制标准曲线,柴胡皂苷a线性回归方程为Y=110.26X+0.935 7,R=1,在0.06~0.98 mg·mL-1浓度范围内,含量与峰面积线性关系良好。
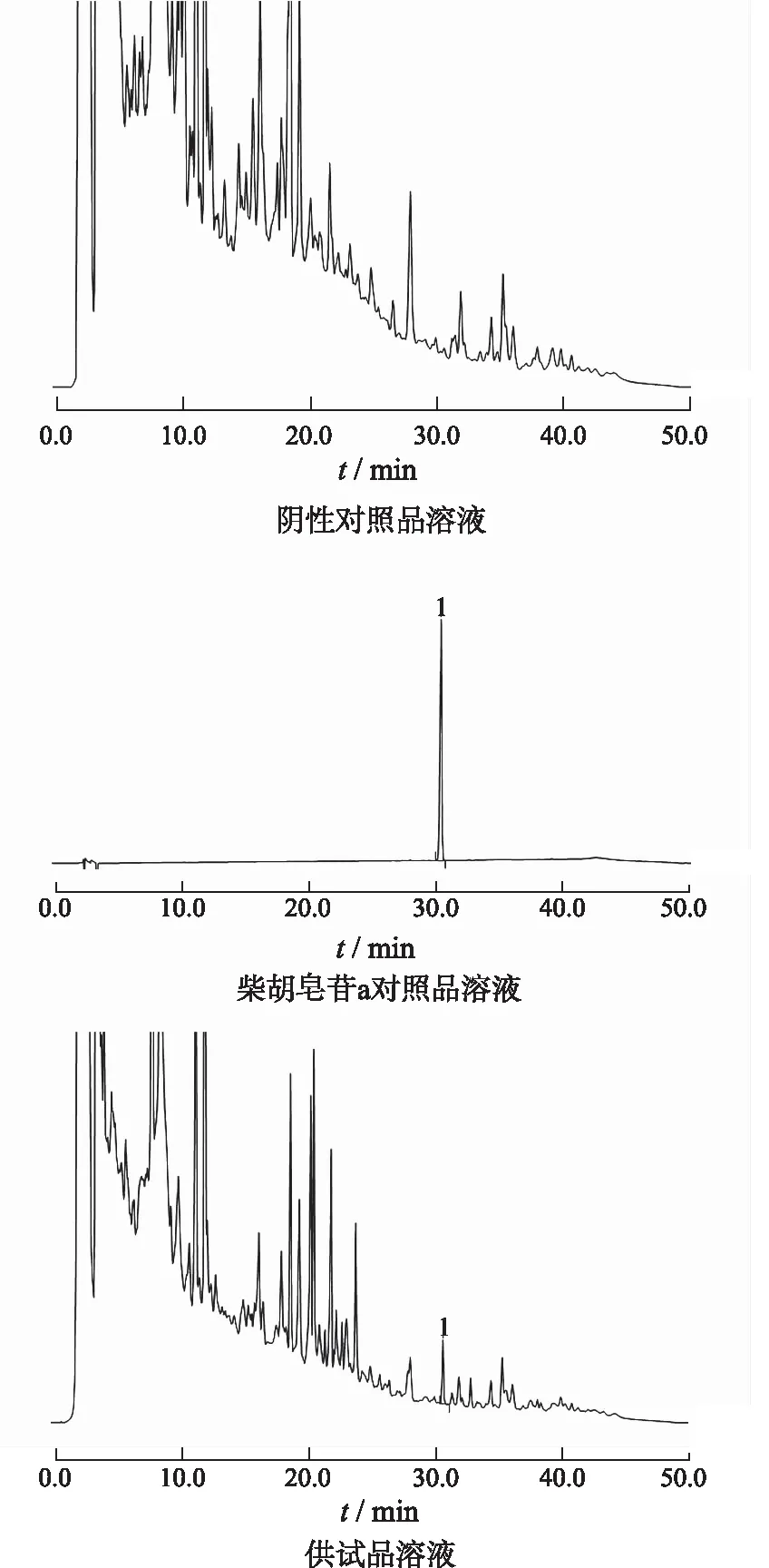
1.柴胡皂苷a。图2 阴性对照品、柴胡皂苷a对照品、供试品溶液高效液相色谱图
1.saikosaponin a.
Fig.2 HPLC chromatograms of negative reference,saikosaponin a reference and test sample
2.6.3精密度实验 精密吸取柴胡皂苷a对照品溶液20 μL,连续进样6次,测定色谱峰面积,计算RSD值。结果显示柴胡皂苷a峰面积RSD为0.21%,表明仪器精密度良好。
2.6.4稳定性实验 取复方肺毒清颗粒,按“2.5.3”项下制备供试品溶液,分别于0,2,4,8,12,24 h进样20 μL,记录峰面积,结果显示:柴胡皂苷a的 RSD为1.493%,表明溶液在24 h内稳定。
2.6.5重复性实验 取复方肺毒清颗粒(批号:20201201)6份,按“2.5.3”项下分别制备供试品溶液,按上述色谱条件测定柴胡皂苷a的含量,每个样品进样2次,得到柴胡皂苷a的平均含量为0.192 mg·g-1,RSD为0.679%。
2.6.6回收率实验 取已知含量样品(批号:20201201)6份,精密称定每份2 g;各份样品中加入一定量的对照品溶液,按“2.5.3”项下分别制备供试品溶液,再按“2.5.1”项色谱条件进样测定含量,分别进样20 μL,记录峰面积并计算加样回收率,结果平均回收率为97.49%,RSD为1.34%,见表4。
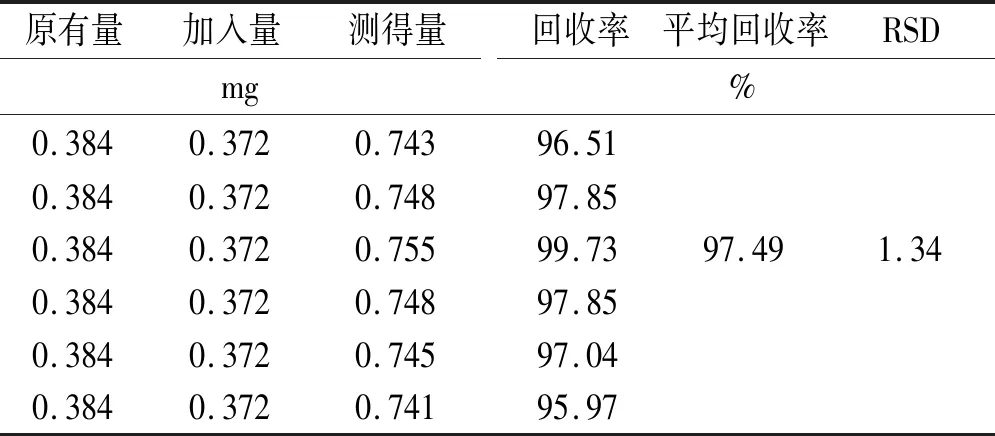
表4 柴胡皂苷a加样回收率实验结果 Tab.4 Recovery test results of saikosaponin a
2.7样品测定结果 取不同批次复方肺毒清颗粒(批号:20201201,20201202,20201203),按供试品制备方法制备样品溶液,进样量20 μL,按“2.5.1”项色谱条件进行柴胡皂苷a含量测定,记录峰面积,按照外标法计算含量。结果显示样品中(每袋10 g)柴胡皂苷a平均含量为0.192 mg·g-1,最低浓度为0.191 mg·mL-1,RSD为0.679%。
3 讨论
因中药复方制剂药味多,本研究预实验中,参照《中华人民共和国药典》2020年版中的色谱条件,结合文献,选择薄层色谱鉴别所需展开剂,显色剂比例。对复方肺毒清颗粒处方中的桔梗以桔梗皂苷d为对照品进行薄层色谱鉴别,在对照品色谱相应的位置上,主斑点不显色或显色不明显,且与其他斑点未分离,方法不可用,因此未纳入本实验质量标准。柴胡以柴胡皂苷a作对照品进行薄层色谱鉴别,分离效果好,在对照品相应的色谱位置上显示相同的黄色荧光斑点,而阴性对照无干扰。故将薄层色谱法鉴别方中柴胡皂苷a纳入本质量标准,且分离方法可靠。因条件受限,今后课题组将进一步扩大对处方中各组分进行色谱条件的考察优化及鉴别。
提取工艺选用水回流提取法进行提取,操作简单,符合我国传统的中药提取方法。复方肺毒清颗粒处方有效成分复杂,柴胡作为君药,具有疏散退热、升举阳气、疏肝解郁等功效[10-11]。本研究中标志物的选择,遵循了中医方剂中“君臣佐使”的原则,采用高效液相色谱法对方中的柴胡皂苷a进行含量测定[12],参考相关文献,对流动相比例进行筛选,通过观察不同条件及图谱的变化,最终选择了最适宜的流动相比例及洗脱梯度。结果表明方法易于操作,重复性较好。
综上所述,本研究建立的质量标准方法可行,能有效控制复方肺毒清颗粒的质量。
