麻黄升麻汤对急性肺损伤大鼠微生物多样性和碳水化合物酶谱的影响*
2022-08-30刘明燃宋博王琳孟祥龙刘必旺高丽彭涛马艳苗
刘明燃,宋博,王琳,孟祥龙,刘必旺,高丽,彭涛,马艳苗
(1.山西中医药大学基础医学院,晋中 030619;2.河南中医药大学第二附属医院,郑州 450046;3.山西省中西医结合医院,太原 030013)
肠缺血-再灌注损伤会导致黏膜损伤、屏障破坏和急性炎症反应,常继发于肠道和肠系膜血管疾病[1]。其可引起急性肺损伤(acute lung injury,ALI),引发炎症、活性氧生成、血管通透性增加、促炎细胞因子释放、炎症细胞浸润及肺纤维化[2]。
人类和动物的消化道是由数万亿微生物细胞组成的多样化生态系统。哺乳动物的内在(由宿主基因组编码)消化能力极度不足,而微生物的关键作用之一是帮助宿主消化大量复杂碳水化合物。近年来基于DNA的宏基因组技术的出现,为人类深入探究微生物群DNA 分类学和功能谱提供了技术支持,并将微生物群与健康、疾病联系起来[3]。
人类与复杂的微生物组合共同进化,其中人类肠道微生物群(human gut microbiota,HGM) 是新陈代谢和全身健康的关键驱动因素。HGM组成的异常变化与严重的代谢、炎症、肿瘤疾病有关。聚糖代谢是塑造肠道微生物群动态和进化的关键因素[4],木聚糖结构差异也可以影响肠道微生物的组成和生长[5]。
中药复方中大多含有较多的糖类成分,多糖越复杂,其分解所需要的酶就越多。人类基因组最多只编码17种酶来消化食物聚糖,特别是淀粉、蔗糖和乳糖。高度复杂和可变的植物细胞壁多糖,如木聚糖、木葡聚糖和果胶的分解需要大量不同的糖苷酶的协同作用。中药含有多种多糖,具有多重生物活性,能够调节免疫、抗病毒、抗炎和抗氧化,激活菌群与免疫系统间的信号通路,刺激免疫细胞,进而调节机体免疫。例如麻黄中ESP-B4多糖可以改善H1N1病毒所致的ALI,并能显著增加小鼠肠道菌群中有益菌的丰度,发挥治疗作用[6]。肠道微生物不仅能降解中药多糖释放有机酸、气体和短链脂肪酸等发酵产物,同时也能降解动物源性多聚糖及肠上皮分泌的内源性黏蛋白[7]。肠道微生物还可弥补人体自身编码糖苷水解酶(glycoside hydrolases,GHs)和糖基转移酶(glycosyl transferases,GTs)的不足[8],增加人参皂苷等中药多糖类活性成分的生物利用度[9]。
ALI属于中医“喘脱”“结胸”“暴喘”等范畴。前期研究发现,经方麻黄升麻汤能够降低ALI 动物模型肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中可溶性晚期糖基化终末产物受体、白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α含量,抑制 Ager-RAGE、核因子κB(nuclear factor-κB,NF-κB)p65 的转录活性[10]。由于肠缺血-再灌注引起ALI是一种全身继发性疾病,从肠道稳态失衡入手探究其发病机制可能加深对急性肺损伤的理解。
本研究借助宏基因组测序,分析肠缺血-再灌注对ALI大鼠肠道微生物多样性及碳水化合物活性酶(carbohydrate-active enzymes,CAZy)的特点及差异,将从“药物微生物组学”角度为中药复方治疗ALI提供深入的数据支持与参考。
1 材料与方法
1.1实验材料与仪器
1.1.1实验动物 无特定病原体(SPF)级Wistar雄性大鼠,5周龄,购自维通利华(北京)实验动物技术有限公司,生产许可证号:SCXK(京)2017-0005。 饲养环境:温度(23±2) ℃,湿度(50±10)%,24 h昼夜节律光照。适应性喂养 1 周后开始实验。
1.1.2药物与试剂 麻黄升麻汤(由麻黄 、升麻 、当归、知母 、黄芩、玉竹、白芍、天冬、桂枝、茯苓、甘草、石膏、白术、干姜组成)药材购自晋中市同仁堂药房连锁有限公司,药材经山西省中医药研究院吉海杰副主任药师鉴定为正品。饮片用纯化水浸泡30 min,煎煮2 次后合并滤液,浓缩4 ℃备用。醋酸地塞米松购自天药药业(天津)股份有限公司(批号:20200416)。
1.1.3仪器 倒置荧光显微镜(NIKON公司,型号Ti2-U),M220TM聚焦超声仪(Covaris Inc.,Woburn,MA,USA),Illumina基因组分析仪(HiseqPE150,Illumina公司),CLC基因组工作台(v7.0.3,CLC bio),宏基因组图谱统计分析(stampv.2.1.3)软件。
1.2方法
1.2.1动物分组与给药 将32只大鼠用完全随机设计分为假手术组、模型对照组、地塞米松组(5 mg·kg-1)、麻黄升麻汤组(17 g·kg-1),每组8只。造模前,假手术组、模型对照组给予纯化水,地塞米松组、麻黄升麻汤组给予相应药物,灌胃,连续给药3 d。腹腔注射10%水合氯醛0.2×10-2mL·g-1,仰卧位固定,消毒后腹部切口入腹,肠管向右拨向体外,0.9%氯化钠溶液浸润的纱布湿润暴露肠管,暴露并游离肠系膜上动脉(superior mesenteric artery,SMA),以无创动脉夹夹闭SMA造成小肠完全缺血后将小肠还纳回腹腔,闭合腹部手术切口。持续缺血1 h后,去除无创动脉夹,恢复血供2 h,结束实验。假手术组仅游离SMA不做夹闭。
1.2.2粪便样本取材 治疗结束后,每组随机选取大鼠5只,结肠无菌采集粪便2~4粒,迅速置于灭菌冻存管,-80 ℃保存。
1.2.3一般情况 动物处死后沿气管完整取下全肺,结扎右肺上叶后用冰磷酸盐缓冲液(PBS)灌洗肺部,收集BALF 1 mL,铺在6孔板中,30 min后,待肺泡巨噬细胞完全贴壁后,随机选取5个视野在倒置显微镜下计数[11]。
1.2.4肺组织病理组织学观察 冰上取左肺后,用4%多聚甲醛固定,石蜡包埋后行苏木精-伊红(HE)染色,观察肺组织病理形态的变化。
1.2.5大鼠粪便总DNA提取与宏基因组建库 利用粪便基因组DNA 提取试剂盒提取粪便样品中微生物基因组DNA。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。将纯化后的DNA随机打断成小片段长度为350 bp,质量达到建库要求的样本采用Illumina Hiseq平台测序。
1.2.6宏基因组测序 ①数据评估及质控。对测序的原始数据通过FastQC软件进行质量评估,去除Illumina平台的Fastq序列中的接头,并根据碱基质量值对Fastq进行修剪。Raw Reads通过碱基识别的分析手段将原始图像数据转化为FASTQ文件格式存储。使用FastQC评估样本测序数据的质量,通过Trimmomatic软件的2种过滤模式,分别对应SE和PE测序数据,过滤处理原始数据得到Clean数据。
②拼接组装、预测及基因集构建。使用IDBA_UD进行组装拼接成长序列,根据reads间的overlap关系,获得contigs,经多次调整参数后获得最优组装结果,选择最佳组装结果。采用Prodigal对拼接结果进行ORF预测,选择长度≥100 bp的基因,并将其翻译成氨基酸序列。采用CD-HIT软件进行去冗余,获得非冗余的基因集。
③生物信息学分析。该步骤以bowtie2工具进行比对,将基因集和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)、CAZy等数据库进行比对,获得基因的物种注释信息和功能注释信息、功能和物种丰度。
基于以上结果进行物种与功能组成分析、物种与功能差异分析、样本比较分析等,对结果做可视化展示,挖掘数据中的有效信息,揭露隐含的规律,验证实验假设和发现新的问题。数据分析由生工生物工程(上海)有限公司完成。
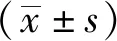
2 结果
2.1大鼠肺巨噬细胞浸润及肺组织、结肠组织病理变化 通过麻黄升麻汤对ALI过度应答反应的干预发现,麻黄升麻汤能够降低ALI致炎后肺泡巨噬细胞的浸润数量(P<0.05)(图1)。
A.假手术组;B.模型对照组;C.麻黄升麻汤组;D.地塞米松组。①与模型对照组比较,t=-11.452~4.514,P<0.05。图1 4组大鼠肺巨噬细胞浸润情况 A.sham group;B.model control group;C.Mahuang Shengma decoction group;D.dexamethasone group.①Compared with model control group,t=-11.452—4.514,P< 0.05.Fig.1 Pulmonary macrophage infiltration in four groups of rats
对大鼠肺、结肠远端组织进行HE染色发现,假手术组大鼠细支气管、肺泡及小动脉结构正常,肺泡间质内轻度充血;模型对照组可见细支气管及肺泡扩张充血,肺泡间炎症细胞浸润;麻黄升麻汤组肺泡间质内轻度充血,细支气管、肺泡及小动脉未见异常;地塞米松组肺泡间见少许淋巴细胞浸润(图2)。结肠远端组织病理结果显示,假手术组黏膜及黏膜以下肌层未见特殊;模型对照组黏膜皱襞扩张,间质疏松水肿,炎症细胞浸润;麻黄升麻汤组黏膜未见著变,肌层及浆膜结构正常;地塞米松组黏膜糜烂,黏膜下疏松水肿,少许炎症细胞浸润(图2)。
2.2物种分布——微生物群落结构分析
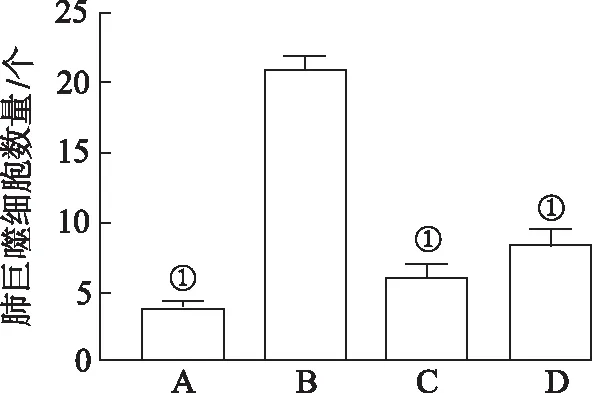
2.2.1门(Phylum)水平分布 给药治疗后,各组大鼠的肠道优势菌门构成及相对丰度见图3。肠道菌群优势菌门以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)为主。其中模型对照组拟杆菌门较其余3组丰度显著降低(P<0.01),放线菌门相较于假手术组和麻黄升麻汤组丰度升高(P<0.05),地塞米松组拟杆菌门相对丰度最高,为64%,高于其他3组(P<0.01)。 拟杆菌门是人或动物肠道内的常在菌,主要作用于类固醇、胆汁酸及多糖的代谢,也可以帮助宿主对多糖的吸收及蛋白质的合成,但有时也会成为病原菌[12]。假手术组、模型对照组和麻黄升麻汤组拟杆菌门相对丰度分别为45%,47%,57%。变形菌门是细菌门中最庞大的一门,包括很多致病性细菌,如大肠埃希菌、幽门螺杆菌、沙门菌、霍乱弧菌等。地塞米松组变形菌门相对丰度最高,占比为 6%,与地塞米松组比较,其余3组均降低,其中 麻黄升麻汤组最低,为1%。

A.假手术组;B.模型对照组;C.麻黄升麻汤组;D.地塞米松组。图2 4组大鼠肺组织和肠组织病理形态学改变(×100) A.sham group;B.model control group;C.Mahuang Shengma decoction group;D.dexamethasone group.Fig.2 Pathomorphological changes of lung and intestine in four groups of rats(×100)
2.2.2属(Genus)水平分布 各组大鼠肠道菌群优势菌属构成及相对丰度见图 3。正常菌群优势菌属包括:拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)等;与假手术组比较,模型对照组拟杆菌属、普雷沃菌属(Prevotella)和乳杆菌属(Lactobacillus)相对丰度均有所下降(P<0.05);假手术组乳杆菌属相对丰度为 11%,模型对照组、地塞米松组、麻黄升麻汤组分别为 5%,7%,6%,表明麻黄升麻汤能在一定程度上提升大鼠肠道乳杆菌比例。
A.假手术组;B.模型对照组;C.麻黄升麻汤组;D.地塞米松组。图3 大鼠肠道优势菌在门和属水平的构成及相对丰度 A.sham group;B.model control group;C.Mahuang Shengma decoction group;D.dexamethasone group.Fig.3 Composition and relative abundance of dominant bacteria in rat gut at phylum and genus levels
2.2.3α多样性指数分析 与假手术组比较,模型对照组香农指数降低,辛普森指数升高(P<0.05);与模型对照组比较,其余3组香农指数均显著升高,辛普森指数均显著降低(P<0.01)(图4);上述结果提示,模型对照组大鼠肠道菌群丰富度和多样性明显降低,麻黄升麻汤能恢复大鼠肠道菌群丰富度和多样性。

A.假手术组;B.模型对照组;C.麻黄升麻汤组;D.地塞米松组。①与模型对照组比较,t=-15.542~6.482,P<0.05。图4 4组大鼠α多样性指数比较 A.sham group;B.model control group;C.Mahuang Shengma decoction group;D.dexamethasone group.①Compared with model control group,t=-15.542—6.482,P< 0.05.Fig.4 Comparison of α diversity index among four groups of rats
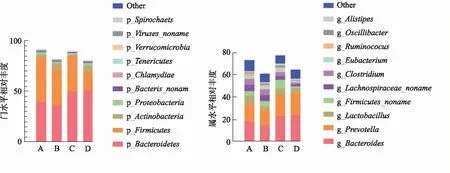
2.2.4Beta多样性分析 Beta多样性分析常用PCoA(principal co-ordinates analysis)观察个体或群体间的差异。结果见图5。模型对照组样品点与其他各组样品点距离较远,表明细菌群落组成存在明显差异,显示进行造模干预后可以影响正常大鼠肠道菌群的结构及多样性。各治疗组坐标点与假手术组样品点距离接近,且明显偏离于模型对照组,提示药物组群落组成与假手术组更相似。说明麻黄升麻汤、地塞米松均可以调节感染后大鼠肠道菌群组成结构。
图5 4组大鼠不同维度菌群多样性分布的PCoA图 Fig.5 PCoA diagram of flora diversity distribution from different dimensions in four groups of rats
2.2.5组间差异物种的筛选 采用线性判别分析(linear discriminant analysis effect size,LEfSe)筛选组间显著差异菌种。LDA 值(2~4)可得出两组间显著差异菌。 显著差异菌在假手术组、模型对照组、麻黄升麻汤组中丰度对比,见图6。由差异菌在种和属丰度对比发现,麻黄升麻汤组的g_Prevotella、g_Bacteroides、g_Lactobacillus、g_Ruminococcus较模型对照组升高;模型对照组s_Lactobacillus_reuteri较假手术组有所升高。

图6 3组大鼠差异菌的种和属丰度比较 Fig.6 Comparison of species and genus abundance of differential bacteria among three groups of rats
2.2.6KEGG功能注释 KEGG通路中共展示6个板块的一级信号通路注释信息,由图7可知,显示新陈代谢通路的注释水平较高,二级代谢通路中碳水化合物代谢(carbohydrate metabolism)表达最为显著。进一步注释碳水化合物三级通路,富集表达较为显著为蔗糖和淀粉代谢(starch and sucrose metabolism)、氨基糖和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism)、糖酵解/糖异生(glycolysis gluconeo-genesis)等是麻黄升麻汤干预ALI的主要代谢途径。
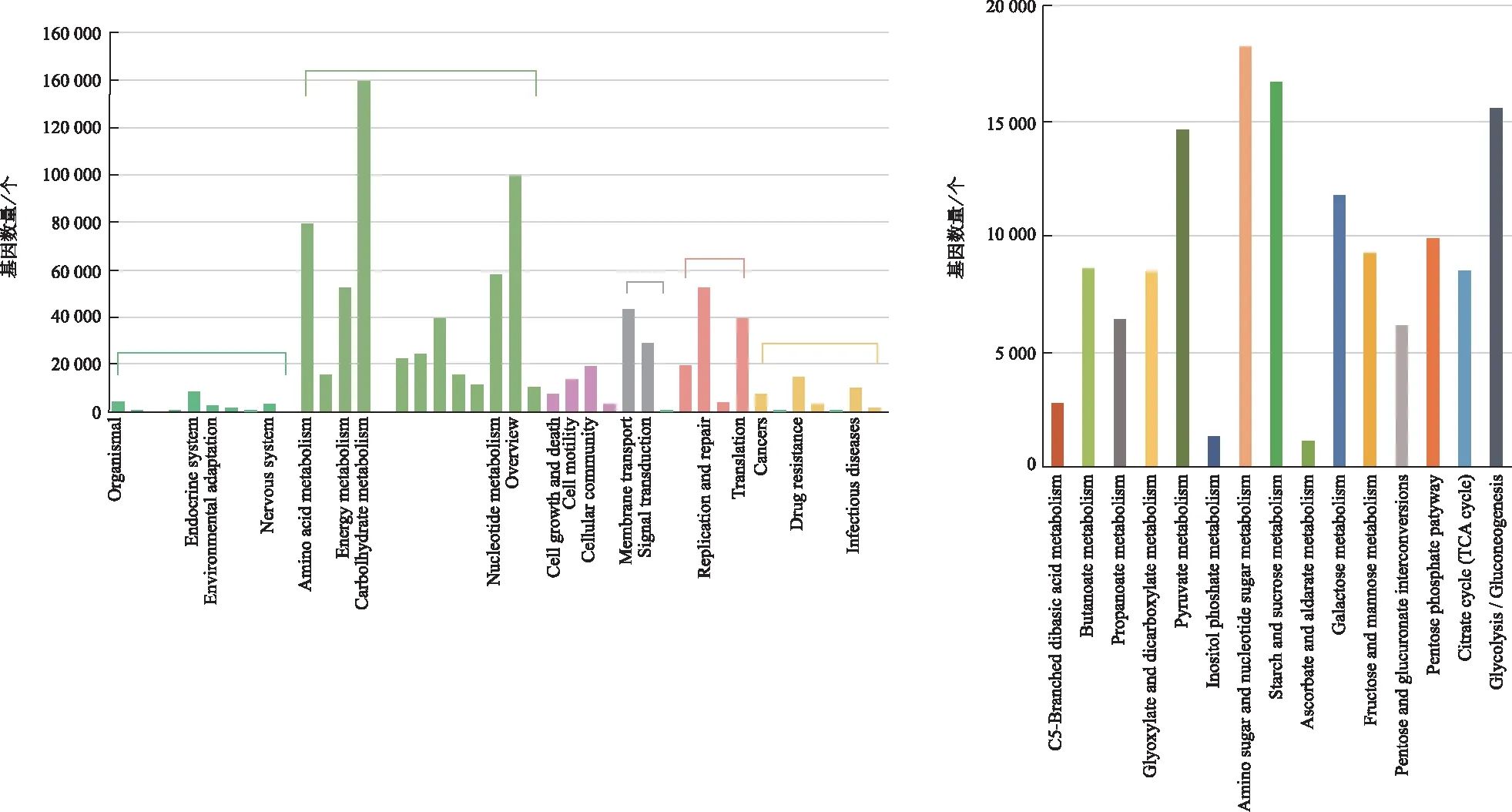
图7 KEGG 通路和碳水化合物通路三级注释结果 Fig.7 Result of KEGG Pathway and three-level annotation of carbohydrate pathway
2.2.7碳水化合物活性酶注释 CAZy数据库约有300种酶,其主要包含 GHs、 GTs、多糖裂解酶(polysaccharide lyases,PLs)等。基因集蛋白序列与CAZy数据库比对后,可得到对应的碳水化合物活性酶注释信息。筛选条件为E-value<1e-5。并统计CAZy各功能层级的丰度。GH、GT和糖类酯解酶(carbohydrate esterase,CE)在各组中丰度较为富集,各组在GH和GT酶类家族显著富集的丰度对比见图8。
3 讨论
肠缺血-再灌注不仅会损伤肠道,还会严重损伤远端器官,特别是引起肺损伤。缺血-再灌注诱导ALI的一个显著特征是过度炎症反应,释放促炎症细胞因子、巨噬细胞浸润和细菌源性内毒素[13]。然而,缺血-再灌注诱导ALI的机制尚未阐明。本研究对缺血-再灌注肠道内容物进行了宏基因组测序,研究了肠道微生物组成和CAZy注释,为研究中药复方的大分子碳水化合物提供参考。
麻黄升麻汤方证的主要表现为咽喉不利、唾脓血、泄利不止、手足厥寒、发热,脉沉迟,有肺闭之危,气脱之象,临床常用于治疗间质性肺病、肺纤维化等复杂疾病[14]。通过对麻黄升麻汤组肠道微生物组成分析发现,厚壁菌门和拟杆菌门为其优势菌门。厚壁菌门可以降解和发酵碳水化合物产生丁酸盐、乙酸盐和丙酸盐等短链脂肪酸,可调节抗炎调节性T细胞(Treg)数量和功能以及上皮完整性[15],从而降低炎症性疾病的风险[16]。拟杆菌门能够降解蛋白质、碳水化合物和脂肪,氨基酸可被肠道细菌用于产生短链脂肪酸 和支链氨基酸[17]。大部分(> 90%)碳水化合物降解酶主要来源于隶属于厚壁菌门和拟杆菌门的微生物[18]。
本研究结果显示,麻黄升麻汤干预后属水平的厚壁菌属(Firmicutes)、拟杆菌属(Bacteroides)、普雷沃菌属(Prevotella)及乳杆菌属(Lactobacillus)丰度较高。拟杆菌是肠道微生物群中的优势属,肠道中碳水化合物的主要来源淀粉、多糖是拟杆菌的易发酵底物[19]。乳杆菌属(Lactobacillus)能够利用可发酵碳水化合物产生乳酸,降低胃肠道pH值,防止致病菌的入侵和定植[20],普雷沃菌可以合成丁酸盐,调节宿主的代谢和免疫反应,改善上皮细胞的完整性和屏障功能,从而预防炎症[21],这可能是麻黄升麻汤抑制肠缺血-再灌注过度炎症反应引起的肺内巨噬细胞浸润趋化、肺毛细血管损伤,保护远端靶器官的作用机制。

①与模型对照组比较,t=-10.251~3.128,P<0.05。图8 各组大鼠碳水化合物活性酶丰度比较 ①Compared with model control group,t=-10.251—3.128,P< 0.05.Fig.8 Comparison of abundance of carbohydrate active enzymes in each group
KEGG功能注释中,碳水化合物三级注释发现蔗糖和淀粉代谢、氨基糖和核苷酸糖代谢、糖酵解/糖异生是麻黄升麻汤干预ALI的主要代谢途径,这些途径通常与碳水化合物降解的短链脂肪酸有关,是影响肠道微生物群组成和平衡的重要决定因素。
肠道中的碳水化合物组成对塑造肠道微生物群多样性具有深远的影响,并通过防止病原体定植和提供次生代谢物来维持人类健康。这种环境刺激了编码CAZy 的复杂微生物基因库的进化,因为只有短的聚糖基底才能穿透细菌的细胞壁。人类拟杆菌属通过离散的多糖利用位点[22]切割聚糖中的大多数糖苷键,来获取和降解最复杂的聚糖[23],产生SCFAs,从而被肠道内皮吸收[24]。
从肠道微生物CAZy注释的结果来看,各组在GHs、GTs类家族呈现显著富集的丰度对比,麻黄升麻汤组的GH2、GH13、GH43、GT4的表达显著高于急性肺损伤组,提示麻黄升麻汤中的碳水化合物活性酶利用率较高,这可能是其促进肠道菌群转化吸收抗炎类小分子物质,发挥抗氧化、调节免疫平衡的基础。
GHs用于水解碳水化合物底物(如植物细胞壁、淀粉颗粒和粘蛋白)的糖苷键。GH13 是主要的 α-淀粉酶家族,可水解淀粉相关碳水化合物的内部 α-1,4-糖苷键,是GHs 中最大的家族,执行淀粉或其他碳水化合物的降解,在葡萄糖循环中具有关键作用。GH43家族存在于许多植物细胞壁降解的微生物中,GHs通过清除机制切割复杂的碳水化合物,诱导自噬、DNA修复和抗氧化酶的表达[25],维持机体稳态。GH2和GH3家族的酶则参与植物细胞壁的解构[26]。GTs家族与双糖、寡糖及多糖的合成有关,负责催化糖苷键断裂,在人体微生物的适应性和致病性方面起着重要作用。
植物乳杆菌和拟杆菌属编码大量 β-半乳糖苷酶[27],瘤胃菌能够作用于碳水化合物降解酶系统和转运蛋白的组织[28],厚壁菌门中的梭状芽孢杆菌属可能是复合碳水化合物的主要降解物。普雷沃菌能够产生针对植物基多糖和木聚糖降解的CAZy,包括GH3家族的xylan-1、4-β-木糖苷酶、GH43的β-木糖苷酶和GH13家族的淀粉水解酶。经过酶促作用后存在的大量未消化的淀粉能够被属于GH13家族的微生物酶降解。拟杆菌门编码来自许多家族的GHs和PLs,能靶向包含目标聚糖的所有或大部分连接[29],本研究结果与之一致。
相同药物在不同个体中表现出显著不同的疗效和毒性,影响患者的治疗效果。不同α/β葡萄糖苷酶活性和微生物生物转化潜力的个体特异性肠道微生物群,与人类的个体差异密切相关,并与中医的“体质”学说不谋而合,也就是说微生物可能通过生物转化或调节宿主酶影响药物代谢。而肠道微生物群在微生物组成和代谢功能方面的可塑性将成为提高药物疗效和安全性的潜在目标。在肠生态系统中,益生菌乳酸杆菌和双歧杆菌已进化产生多种糖基水解酶,包括β-葡萄糖苷酶,有助于人参皂苷释放苷元[30]。研究表明,人参多糖和大建中汤[31]可以塑造肠道微生物群结构并增强疗效[32]。
系统生物学能够揭示疾病中多组分和多靶点之间的潜在的复杂关联,将为研究经方麻黄升麻汤提供更广阔的平台和新颖的视角。CAZy可能代表了人类肠道微生物群功能多样性的一个有用的生物标志物,有助于指导治疗肠缺血-再灌注等黏膜屏障障碍引发的继发感染性疾病策略,通过靶向肠道微生物群的代谢功能可能会优化传统药物及复方的整体功效。
