亚精胺通过抑制音猬因子信号通路减轻心肌胶原沉积和氧化应激作用*
2022-08-30王莉刘敏
王莉,刘敏
(江汉大学附属医院老年医学研究所,武汉 430014)
人口老龄化是全球性公共卫生问题[1]。第7次全国人口普查数据显示,我国正步入老龄化社会。衰老是随着年龄递增而出现细胞、组织和器官生理功能与内环境稳态紊乱的现象,因此也被认为是多种疾病的重要危险因素[2]。衰老性疾病,尤其是心血管疾病(cardiovascular diseases,CVDs)严重危害老年人群的健康[3]。据报道,CVDs(包括高血压、心肌肥大和心力衰竭等)占全世界死亡人数的约31%[4],已经成为造成老年人死亡的主要原因之一[1]。
器官纤维化是一种伴随衰老和组织损伤的生理现象,以细胞外基质(extracellular matrix,ECM)重构造成胶原沉积为常见特征,是人类衰老相关疾病发病和死亡的关键诱因[5-6]。其中,心脏纤维化常见于高血压、心肌梗死和心力衰竭等[7]。纤维化过程参与了包括心脏在内的大多数器官疾病的发病机制。目前尚无有效的针对性治疗方法[6]。
刺猬(hedgehog,HH)信号通路参与细胞分化、增殖和衰老等多种生物学过程,尤其在心肌细胞发育和心血管系统形成等方面发挥重要的调节作用[8]。其中音猬因子(sonic hedgehog,SHH)是HH家族中表达最为广泛的成员,其与受体结合后活化跨膜蛋白Smoothened(SMO)并最终促进GLI蛋白的转移和表达,干预下游靶基因行为从而参与细胞活性和组织稳态的调节[9]。亚精胺是一种广泛存在于日常膳食营养中的天然多胺,其在人体组织中的含量随着年龄的增长而下降[10]。研究显示,亚精胺具有改善心肌线粒体功能、抑制细胞凋亡、防治心肌梗死等活性[11]。笔者研究亚精胺对心肌胶原沉积和氧化应激的改善作用及其机制。
1 材料与方法
1.1材料 亚精胺(含量>99%,批号:S107071)、D-半乳糖(D-galactose,D-gal)(含量>99%,批号:D274314)购于上海阿拉丁生化科技股份有限公司。SHH(批号:00041772)、SMO(批号:10007493)和GLI-1(批号:10010981)抗体购于武汉三鹰生物技术有限公司。SMO激动剂SAG(批号:16561)购于美国MCE公司。实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,q-PCR)检测试剂盒SYBR FAST qPCR Master Mix(批号:KM4101)购于美国KAPA Biosystems公司。转化生长因子-β1(transforming growth factor-β1,TGF-β1)、E-钙粘蛋白(E-cadherin,E-cad)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、波形蛋白(vimentin,VIM)、纤维连接蛋白(fibronectin,FN)以及胶原COL1A1和COL3A1引物由武汉天一辉远生物科技有限公司合成。羟脯氨酸(hydroxyproline,Hyp,批号:20200808)、总抗氧化能力(total antioxidant capacity,T-AOC,批号:20200804)、超氧化物歧化酶(superoxide dismutase,SOD,批号:20200808)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px,批号:20200808)、过氧化氢酶(catalase,CAT,批号:20200804)和丙二醛(MDA,批号:20200804)检测试剂盒均购于南京建成生物工程研究所。大鼠心肌细胞H9c2购于中国科学院细胞库。
1.2方法
1.2.1细胞培养与给药 H9c2 细胞于达尔伯克必需基本培养基(Dulbecco's minimum essential medium ,DMEM)中培养。设置亚精胺梯度浓度(1,5,10,20,50,100和200 μmol·L-1)干预组,另平行操作空白培养基等体积干预设置为正常对照组。24 h后CCK-8法检测吸光度(A值)计算细胞存活率,相对存活率=(A给药孔-A培养基孔)/(A正常对照孔-A培养基孔)。
1.2.2细胞模型建立 与正常对照组比较,1~50 μmol·L-1亚精胺孵育并未显著影响H9c2 细胞存活率。然而,100和200 μmol·L-1亚精胺孵育则显著降低了H9c2 细胞存活率,提示50 μmol·L-1以上的干预浓度可能具有细胞毒性。因此选择20和50 μmol·L-1亚精胺孵育浓度进行后续实验。采用50 mol·L-1D-gal孵育H9c2细胞[12],随机分为4组:模型对照组、20 μmol·L-1亚精胺组、50 μmol·L-1亚精胺组和50 μmol·L-1亚精胺+3 nmol·L-1SHH信号通路激动剂组(SAG组)。24 h后CCK-8法检测细胞存活率。
1.2.3比色法检测生化指标 H9c2细胞按“1.2.2”项操作后,参照试剂盒说明书检测各组细胞Hyp、T-AOC、SOD、GSH-Px、CAT和MDA的水平。
1.2.4流式检测细胞内活性氧水平 H9c2细胞按“1.2.2”项操作后,用10 μmol·L-1DCFH-DA孵育细胞,碘化丙啶(propidium iodide,PI) 染色排除死亡细胞干扰。流式细胞仪检测细胞平均荧光强度评价细胞活性氧(reactive oxgen species,ROS)水平。
1.2.5q-PCR检测mRNA水平 H9c2细胞按“1.2.2”项操作后,参照SYBR FAST qPCR Master Mix说明书步骤,通过q-PCR检测COL1A1、COL3A1、E-cad、α-SMA、VIM、FN和TGF-β1的mRNA水平。引物序列见表1。GAPDH为内参。

表1 q-PCR引物序列 Tab.1 Primer sequences for q-PCR
1.2.6免疫印迹法(Western blotting)检测蛋白表达 采用Western blotting检测SHH信号通路节点蛋白SHH、SMO和GLI-1的表达量。经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离总蛋白后,依次转膜、封闭、抗体孵育。采用全自动化学发光分析仪检测电化学发光(electrochemilumine-scence,ECL),通过TANONGIS软件记录灰度值。
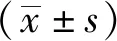
2 结果
2.1亚精胺对H9c2 细胞存活率的影响 与正常对照组比较,D-gal孵育显著降低H9c2 细胞的存活率。与模型对照组比较,20和50 μmol·L-1亚精胺能够显著升高细胞的存活率。与50 μmol·L-1亚精胺单独干预比较,SAG组H9c2 细胞的存活率显著降低。见图1。
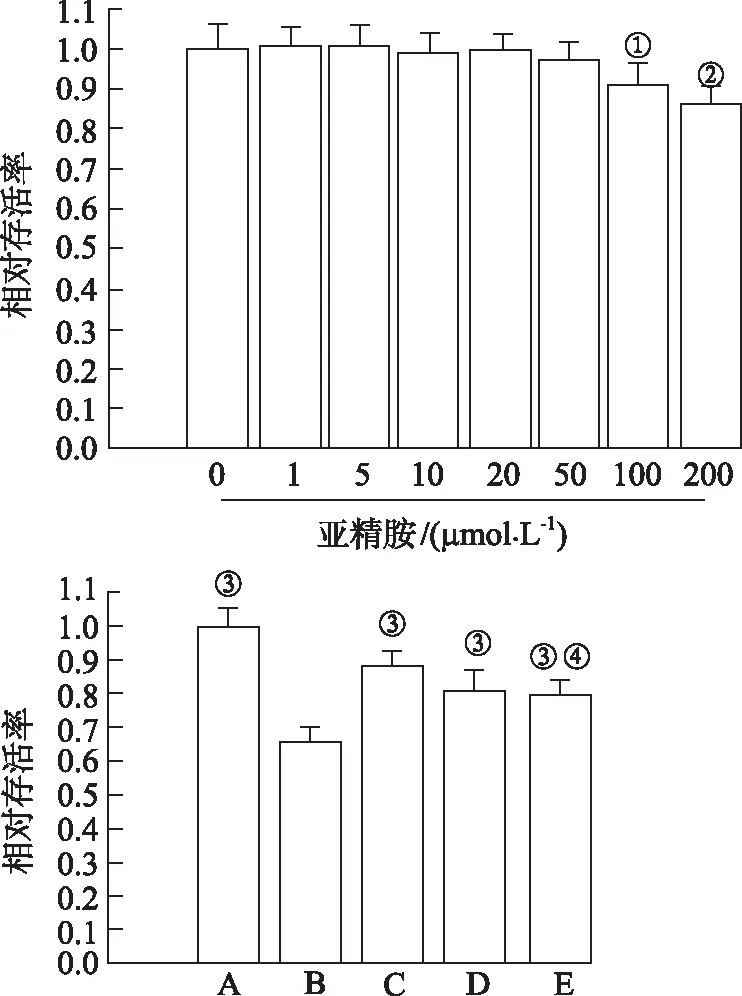
A.正常对照组;B.模型对照组;C.50 μmol·L-1亚精胺组;D.20 μmol·L-1亚精胺组;E.SAG组。①与正常对照组比较,t=2.328,P<0.05;②与正常对照组比较,t=3.791,P<0.01;③与模型对照组比较,t=-9.829~-4.035,P<0.01;④与50 μmol·L-1亚精胺组比较,t=2.731,P<0.05。图1 各组H9c2 细胞的存活率A.normal control group;B.model control group;C.50 μmol·L-1 spermidine group;D.20 μmol·L-1 spermidine group;E.SAG group.①Compared with normal control group,t=2.328,P<0.05;②Compared with normal control group,t=3.791,P<0.01;③Compared with model control group,t=-9.829—-4.035,P<0.01;④ Compared with 50 μmol·L-1spermidine group,t=2.731,P<0.05.Fig.1 The viability of H9c2 cells in each
2.2亚精胺对H9c2细胞氧化应激的影响 H9c2细胞氧化应激通过流式检测细胞ROS水平,比色法检测细胞T-AOC、脂质过氧化水平(MDA)和抗氧化酶(SOD、GSH-Px、CAT)活力综合评价。与正常对照组比较,D-gal孵育显著升高了H9c2细胞的ROS和MDA水平,降低T-AOC能力,并抑制了SOD、GSH-Px和CAT的酶活力。与模型对照组比较,20和50 μmol·L-1亚精胺能够显著升高细胞的T-AOC和抗氧化酶活力,降低ROS和MDA水平。与50 μmol·L-1亚精胺单独干预比较,SAG组细胞ROS和MDA含量显著升高,T-AOC,SOD和CAT水平降低。见图2。
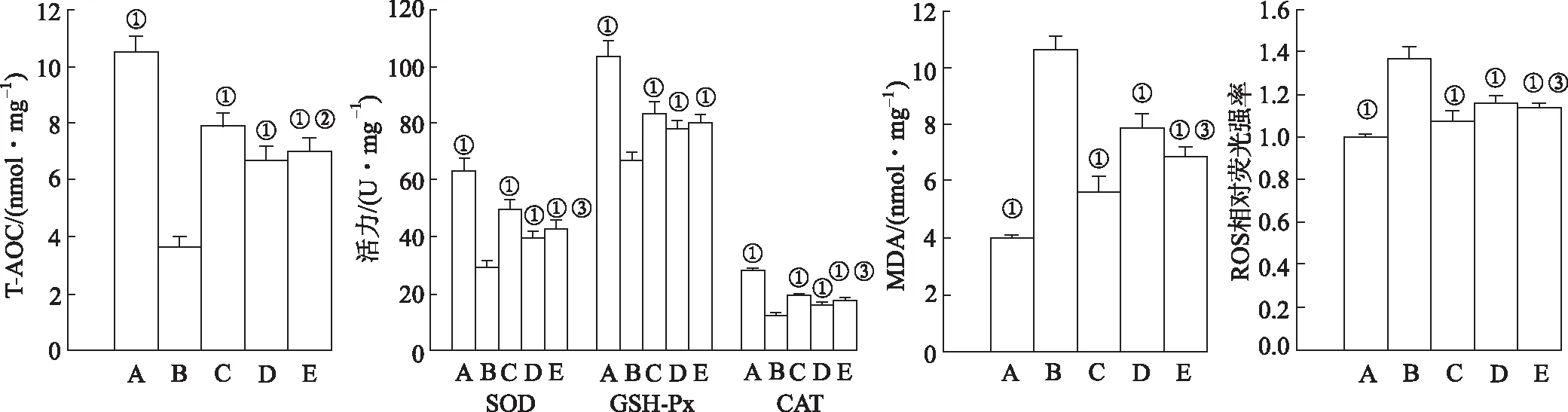
A.正常对照组;B.模型对照组;C.50 μmol·L-1亚精胺组;D.20 μmol·L-1亚精胺组;E.SAG组。①与模型对照组比较,T-AOC,t=-21.138~-10.273;SOD,t=-15.076~-6.314;GSH-Px,t=-11.508~-5.294;CAT,t=-31.15~-6.711;MDA,t=7.807~27.069;ROS,t=6.237~12.522,均P<0.01。②与50 μmol·L-1亚精胺组比较,T-AOC,t=2.69,P<0.05;③与50 μmol·L-1亚精胺组比较,SOD,t=3.195;CAT,t=3.654;MDA,t=-4.271;ROS,t=-2.432,均P<0.01。图2 各组H9c2 细胞氧化应激检测结果A.normal control group;B.model control group;C.50 μmol·L-1 spermidine group;D.20 μmol·L-1 spermidine group;E.SAG group.①Compared with model control group,T-AOC,t=-21.138—-10.273;SOD,t=-15.076—-6.314;GSH-Px,t=-11.508—-5.294;CAT,t=-31.15—-6.711;MDA,t=7.807-27.069;ROS,t=6.237-12.522,all P<0.01.②Compared with 50 μmol·L-1 spermidine group,T-AOC,t=2.69,P<0.05;③Compared with 50 μmol·L-1 spermidine group,SOD,t=3.195;CAT,t=3.654;MDA,t=-4.271;ROS,t=-2.432,P<0.01.Fig.2 Oxidative stress levels of H9c2 cells in each
2.3亚精胺对H9c2细胞胶原沉积的影响 通过检测细胞Hyp含量、胶原COL1A1和COL3A1以及TGF-β1的mRNA水平评价心肌胶原沉积情况。与正常对照组H9c2细胞的Hyp含量(0.100±0.018 )μg·L-1比较,模型对照组H9c2细胞的Hyp含量升高至(0.236±0.019) μg·L-1(t=10.556,P<0.01)。与模型对照组比较,20和50 μmol·L-1亚精胺显著降低Hyp含量至(0.180±0.014)和(0.144±0.015) μmol·L-1(t=4.802,7.720,P<0.01)。与50 μmol·L-1亚精胺组比较,SAG组Hyp含量升高至(0.156±0.019 )μmol·L-1(t=-1.007,P<0.01)。与正常对照组比较,D-gal显著升高COL1A1、COL3A1和TGF-β1的mRNA水平。与模型对照组比较,20和50 μmol·L-1亚精胺能够显著降低COL1A1、COL3A1和TGF-β1的mRNA水平。与50 μmol·L-1亚精胺单独干预比较,SAG组显著升高COL1A1、COL3A1和TGF-β1的mRNA水平。见图3。
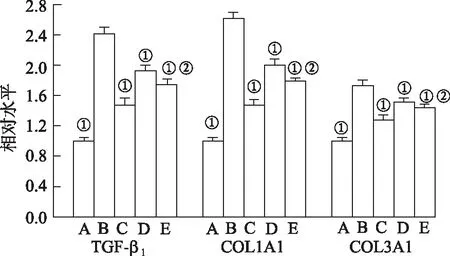
A.正常对照组;B.模型对照组;C.50 μmol·L-1亚精胺组;D.20 μmol·L-1亚精胺组;E.SAG组。①与模型对照组比较,TGF-β1,t=7.241~25.052;COL1A1,t=9.777~32.327,;COL3A1,t=4.363~15.39,均P<0.01。②与50 μmol·L-1亚精胺组比较,TGF-β1,t=-4.117;COL1A1,t=-6.594;COL3A1,t=-3.426,均P<0.01。图3 各组H9c2 细胞TGF-β1、COL1A1和COL3A1的 mRNA水平A.normal control group;B.model control group;C.50 μmol·L-1 spermidine group;D.20 μmol·L-1 spermidine group;E.SAG group.①Compared with model control group,TGF-β1,t=7.241-25.052;COL1A1,t=9.777-32.327;COL3A1,t=4.363—15.39,all P<0.01.②Compared with 50 μmol·L-1 spermidine group,TGF-β1,t=-4.117;COL1A1,t=-6.594;COL3A1,t=-3.426,all P<0.01.Fig.3 The mRNA levels of TGF-β1,COL1A1 and COL3A1 in each group of H9c2
2.4亚精胺对H9c2细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)的影响 通过检测EMT标记物E-cad、α-SMA、VIM和FN的mRNA水平综合评价细胞EMT情况。与正常对照组比较,D-gal孵育显著降低了H9c2细胞E-cad的mRNA水平,升高了α-SMA、VIM和FN的mRNA水平。与模型对照组比较,20和50 μmol·L-1亚精胺显著升高E-cad的mRNA水平,降低了α-SMA、VIM和FN的mRNA水平。与50 μmol·L-1亚精胺单独干预比较,SAG组E-cad的mRNA水平显著降低,α-SMA和FN的mRNA水平升高。见图4。
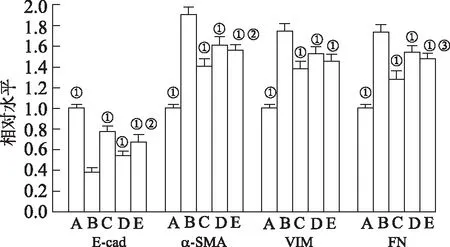
A.正常对照组;B.模型对照组;C.50 μmol·L-1亚精胺组;D.20 μmol·L-1亚精胺组;E.SAG组。①与模型对照组比较,E-cad,t=-18.149~-4.482;α-SMA,t=4.792~17.796;VIM,t=4.046~16.765;FN,t=3.429~14.305,均P<0.01。②与50 μmol·L-1亚精胺组比较,E-cad,t=1.961,α-SMA,t=-2.997,P<0.05。③与50 μmol·L-1亚精胺组比较,t=-3.939,P<0.01。图4 各组H9c2细胞E-cad、α-SMA、VIM和FN的mRNA水平A.normal control group;B.model control group;C.50 μmol·L-1 spermidine group;D.20 μmol·L-1 spermidine group;E.SAG group.①Compared with model control group,E-cad,t=-18.149—-4.482;α-SMA,t=4.792-17.796;VIM,t=4.046-16.765;FN,t=3.429—14.305,all P<0.01.②Compared with 50 μmol·L-1 spermidine group,E-cad,t=1.961;α-SMA,t=-2.997,all P<0.05.③Compared with 50 μmol·L-1 spermidine group,t=-3.939,P<0.01.Fig.4 The mRNA levels of E-cad,α-SMA,VIM and FN in each group of H9c2
2.5亚精胺对H9c2细胞SHH信号通路的影响 SHH信号通路的活跃程度通过检测节点蛋白SHH、SMO和GLI-1的表达量评价。与正常对照组比较,D-gal孵育显著升高了H9c2细胞SHH、SMO和GLI-1的表达水平。与模型对照组比较,20和50 μmol·L-1亚精胺能够显著降低细胞SHH、SMO和GLI-1的表达水平。与50 μmol·L-1亚精胺单独干预比较,SAG组细胞SHH、SMO和GLI-1的表达水平显著升高。见图5。结合前文结果,亚精胺减轻心肌胶原沉积的作用机制可能与抑制SHH信号通路和氧化应激有关(图6)。
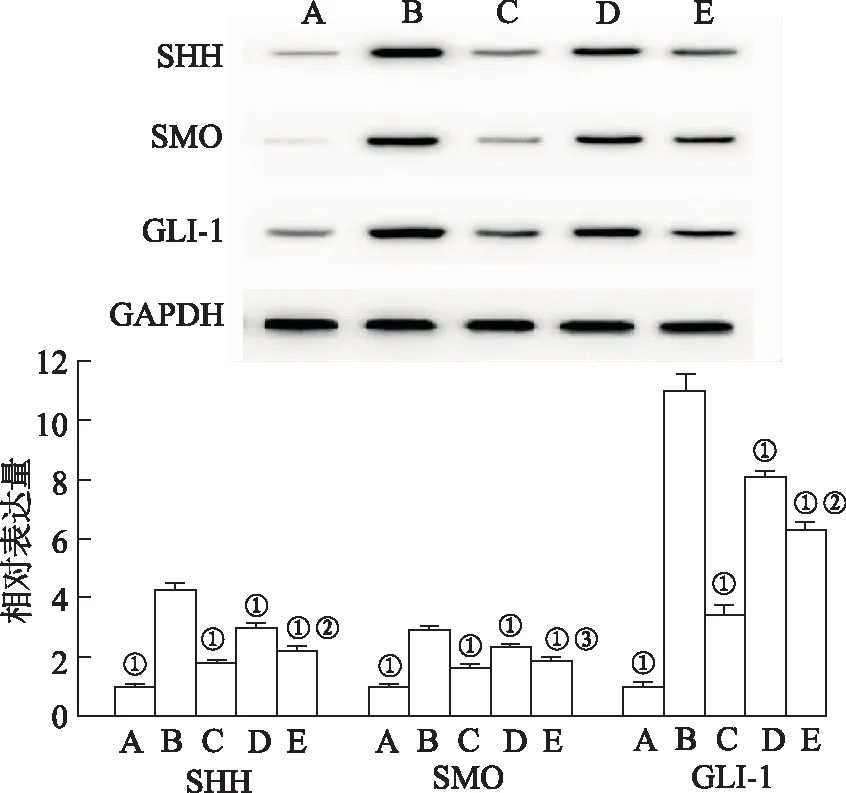
A.正常对照组;B.模型对照组;C.50 μmol·L-1亚精胺组;D.20 μmol·L-1亚精胺组;E.SAG组。①与模型对照组比较,SHH,t=7.923~22.332;SMO,t=6.302~22.620;GLI-1,t=6.307~22.218,P<0.01。②与50 μmol·L-1亚精胺组比较,SHH,t=-2.755;GLI-1,t=-2.054,P<0.05。③与50 μmol·L-1亚精胺组比较,t=-10.242,P<0.01。图5 各组H9c2细胞SHH、SMO和GLI-1蛋白表达水平A.normal control group;B.model control group;C.50 μmol·L-1 spermidine group;D.20 μmol·L-1 spermidine group;E.SAG group.①Compared with model control group,SHH,t=7.923—22.332;SMO,t=6.302—22.620;GLI-1,t=6.307—22.218,all P<0.01;②Compared with 50 μmol·L-1 spermidine group,SHH,t=-2.755;GLI-1,t=-2.054,P<0.05.③Compared with 50 μmol·L-1 spermidine group,t=-10.242,P<0.01.Fig.5 The protein expression levels of SHH,SMO and GLI-1 in each group of H9c2

图6 亚精胺的作用机制 Fig.6 Mechanisms of spermidine
3 讨论
胶原沉积是器官纤维化的关键病理特征[11]。因此,心肌胶原沉积也是心脏纤维化导致心肌结构和功能破坏的病理原因之一,将加速心肌梗死、肥厚型心肌病和心脏衰竭等疾病的进展[13]。H9c2心肌细胞株来源于大鼠心脏,被广泛应用于CVDs的研究中,尤其适用于衰老相关性疾病的防治研究[14-15]。本研究发现,亚精胺能够有效改善D-gal诱导的H9c2细胞的胶原沉积,提示亚精胺具有减缓衰老引起的心脏纤维化的潜力。
EMT是器官纤维化形成的核心途径之一,在分子水平上表现为上皮标记物E-cad逐渐缺失,间质标记物VIM、α-SMA和FN等过表达。一方面,E-cad对维持细胞正常黏附连接至关重要。E-cad缺失和VIM过表达将导致细胞骨架重组并获得运动能力。另一方面,α-SMA的阳性表达是成纤维细胞分化为肌成纤维细胞,进而促进ECM重构和胶原沉积的标志性事件之一[16]。此外,TGF-β是强力的促纤维化细胞因子,与α-SMA和VIM等EMT指针的过表达密切相关[13]。TGF-β1能够下调E-cad,上调α-SMA和FN的表达,促进H9c2细胞EMT[17]。本研究证实,亚精胺改善心肌胶原沉积的效应与抑制TGF-β1和EMT有关。
氧化应激是心肌损伤的诱因之一。正常生理状态下,体内抗氧化体系负责维持细胞内ROS的产生与消除处于动态平衡。各种因素导致的抗氧化酶活力被抑制,都将引起体内抗氧化防御体系的破坏,造成ROS聚集,最终出现氧化应激损伤[15]。SHH信号通路参与衰老相关的细胞氧化应激[18]。事实上,各种细胞信号通路存在广泛的交连,而SHH信号通路处于关键的节点位置[19]。SHH信号通路的活跃能够通过诱导其下游靶标TGF-β、EMT转录因子和胶原基因等表达而连接TGF-β、促纤维化效应、EMT程序和胶原沉积等生理活动[20]。氧化应激的形成将协同SHH信号通路进一步加速器官纤维化进程[21]。本研究发现,亚精胺能够显著抑制H9c2细胞的氧化应激、EMT和SHH信号通路。而SHH信号通路激动剂SAG在一定程度上抵消了亚精胺的上述作用。综上所述,亚精胺能够通过抑制SHH信号通路减轻心肌胶原沉积和氧化应激,提示亚精胺具有改善心脏衰老的潜在应用价值。笔者在下一步研究中将在体内水平予以深入探讨。
