亚临床垂体瘤卒中的临床特点和相关垂体瘤的特征分析
2022-08-29王喆赵余静魏广鑫苗俊杰解昆明闫红梅
王喆,赵余静,魏广鑫,苗俊杰,解昆明,闫红梅
垂体瘤卒中是一种少见的临床综合征,常常由垂体瘤发生出血或梗塞引起。急性垂体瘤卒中典型的临床表现为起病急骤,剧烈头痛、视力下降、眼肌麻痹、垂体功能低下,严重者出现意识障碍,甚至危及生命。而另一部分垂体瘤卒中临床症状轻微、不典型,或者无特殊症状,称之为亚临床垂体瘤卒中(subclinical pituitary adenoma apoplexy,SPAA)。随着神经影像学的发展,越来越多的患者被诊断为亚临床垂体卒中[1]。目前,有关急性垂体瘤卒中的研究较多[2-4],而SPAA的相关临床研究较少,其确切的发病机制尚不清楚。本研究回顾性分析潍坊市人民医院2010年1月—2021年4月收治的513例垂体瘤患者的临床资料,对SPAA的临床表现特点和相关垂体瘤的特征性进行分析、研究,以期为SPAA的诊断和治疗提供理论依据。
1 资料与方法
1.1 一般资料 共纳入513例经手术及病理证实的垂体瘤患者,其中SPAA 78例,急性垂体瘤卒中55例,非卒中垂体瘤380例。78例SPAA中,男48例,女30例;年龄31~68岁,平均年龄(47.1±10.3)岁。SPAA纳入标准:(1)颅脑CT或MRI检查提示垂体瘤(图1、图2),其内部密度或信号不均匀,符合出血或者梗塞征象; (2)术中所见和术后病理证实垂体瘤内有亚急性出血或者梗塞(图3)。排除标准:(1)具有突发性剧烈头痛、恶心、呕吐、严重视觉障碍及眼肌麻痹、出现意识障碍等急性垂体瘤卒中临床表现;(2)临床资料不完整;(3)失随访。本研究所有患者或家属均签署知情同意书。
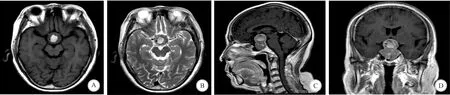
A:发生SPAA患者术前T1加权成像示,肿瘤内出血灶呈高信号; B:T2加权成像显示,肿瘤内出血灶呈高信号;C:T1强化矢状位示,肿瘤内出血灶无强化; D:T1强化冠状位显示,肿瘤内出血灶无强化图1 SPAA患者术前影像学检查结果
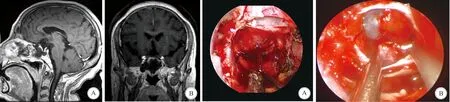
A:颅脑MRI的强化扫描矢状位显示肿瘤切除满意;B:颅脑MRI的强化扫描冠状位显示肿瘤切除满意图2 SPAA患者术后6个月MRI检查结果A:在神经内镜下经蝶手术中,见肿瘤内有暗红色陈旧血性液;B:切除肿瘤后见菲薄的鞍膈下陷,附着薄层垂体组织图3 SPAA患者术中所见
1.2 垂体瘤的体积分类标准 根据有无内分泌功能分类,分为功能性垂体瘤(包括垂体泌乳素腺瘤、生长激素腺瘤、促肾上腺皮质激素腺瘤、促甲状腺激素腺瘤、促性腺激素腺瘤及混合性垂体瘤)和无功能性垂体瘤。根据肿瘤大小分类,患者术前均行颅脑MRI检查,肿瘤最大直径 1.3 垂体瘤的侵袭性判断标准 采用Knosp分级标准,根据测量冠状位颅脑MRI海绵窦受侵犯的情况,达到以下标准可以判断肿瘤具有侵袭性:肿瘤生长到颈内动脉外侧壁连线外,突到海绵窦外,海绵窦内各静脉丛消失;甚至出现海绵窦内颈内动脉被肿瘤包裹,静脉丛消失。在侵袭性垂体瘤病例中,根据影像学表现和术中所见判断垂体瘤是否突破鞍膈的硬膜。 2.1 SPAA临床表现 SPAA最常见的症状为慢性反复头痛48例(61.5%),间断性发作,加重不明显,部分可以自行缓解;其次是缓慢进展的视觉障碍36例(46.2%),其中视力减退28例(35.9%),视野缺损6例(7.7%),复视2例(2.6%) ,视觉障碍程度均不严重,多数不能自行缓解;垂体功能减退28例(35.6%);低皮质醇血症19例(24.4%),甲状腺功能减退症14例(17.9%);性腺功能减退症13例(16.7%);全垂体功能减退症2例(2.6%),表现为疲劳感、食欲减退、体重下降、低钠血症等;头晕10例(12.8%);恶心呕吐4例 (5.1%);均无意识障碍。 2.2 与SPAA相关的肿瘤特征 微腺瘤20例(25.6%),大腺瘤58例(74.4%),其中巨大腺瘤12例(15.4%);无功能腺瘤51例(65.4%),功能性腺瘤27例(34.6%),其中泌乳素腺瘤16例(20.5%),生长激素(growth hormone,GH)腺瘤6例(7.7%),促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)腺瘤3例(3.8%),混合性腺瘤2例(2.6%)。侵袭性垂体瘤40例(51.3%),其中突破鞍膈8例(10.3%),未突破鞍膈32例(41%),非侵袭性垂体瘤38例(48.7%)。 SPAA又称为亚急性垂体瘤卒中,其发病率目前尚无确切范围。Wildemberg等[5]指出在常规影像学检查和术后组织病理学检查中,有高达25%的垂体瘤发现SPAA的证据。Liu等[6]指出在垂体大腺瘤患者中,有14%~22%的患者出现SPAA,Zhang等[7]指出SPAA发病率约10%~25%。Cebula等[1]报告SPAA在无功能腺瘤的发病率为34.4%。而既往文献报告急性垂体瘤卒中的发病率在7.9%~14%[5,8],学者们一致认为SPAA比急性垂体瘤卒中更常见[1,6-7]。本研究中,SPAA发病率为15.2%(78/513),高于急性垂体瘤卒中的发病率10.7%(55/513),与文献报道符合。随着MRI成像质量的提高和垂体MRI成像技术的普遍应用,SPAA的发生率将不断增加[1,8]。 SPAA的临床表现具有非典型性,在诊断方面对临床医生来说一直是一个挑战[8]。与急性垂体瘤卒中相比,SPAA的临床表现比较缓和、隐匿,没有突发的剧烈头痛、明显的视力视野损害、甚至失明、昏迷、危及生命等特征[9-10]。Zhang等[7]回顾性分析185例SPAA发现,患者没有任何急性卒中的症状,最常见的临床表现为长期的视觉障碍(76.7%)、垂体功能低下(54.6%)、慢性头痛(37.84%)。Liu等[6]报告40例SPAA的临床表现均不典型,主要表现为视觉障碍(70%)、垂体功能低下(47.5%)、头痛(30%)。 本研究中的临床症状均无急性进展及意识障碍,最常见症状为慢性头痛48例(61.5%),特点是间断性发作,无进行性加重,部分患者可以自行缓解。其次症状是缓慢进展的视觉障碍36例(46.2%),表现为视力减退、视野缺损、复视,视觉障碍程度早期均不严重,患者甚至较长时间没有察觉,多数不能自行缓解。分析原因,由于发生了SPAA,鞍区内容物缓慢增多,鞍内压力增高,出现慢性头痛,压迫视觉通路,出现视力视野损伤。肿瘤还可向海绵窦缓慢扩张,压迫Ⅲ、Ⅳ和/或Ⅵ级的颅神经,导致不同程度的眼部麻痹。在垂体功能方面,本研究出现垂体功能减退28例(35.6%),多数为垂体前叶功能减退。但有2例(2.6%)首发症状为厌食和低钠血症,早期在消化内科治疗,后经神经外科、内分泌科会诊,诊断为SPAA伴有全垂体功能减退。研究指出临床上应考虑将垂体瘤卒中作为厌食症、低钠血症的鉴别诊断。本组有5例SPAA是首发症状,由于临床表现不典型,在发病早期不能及时做颅脑CT、MRI等神经影像学和内分泌检查以明确诊断。有文献报告SPPA可以发生在以前未确诊的垂体瘤,可以无垂体功能减退症状[11-13]。 SPAA临床表现具有复杂性,对于功能性垂体瘤,患者可出现与分泌激素相关的异常表现。Popa等[14]指出Cushing’s病可出现自发性缓解,未经特殊治疗,检测血ACTH自发性降低,最常见的原因可能是SPAA,应定期随访,了解其临床、内分泌及影像学变化。Rahman等[15]报告首例儿童库欣病垂体微腺瘤,发生SPAA,患者临床症状、生化检查出现周期性缓解,导致其库欣病诊断较晚。Klimko等[8]和Alam等[16]各报告一例肢端肥大症的患者,未曾系统诊治,由于发生SPAA,内分泌异常自发性缓解。Kumar等[17]报告一例长期应用奥曲肽治疗的GH大腺瘤,出现SPAA,临床症状、肿瘤均自发性消失,生化指标正常。 本研究中,有一例患者具有典型的肢端肥大症体征,临床表现为慢性头痛、体重下降、乏力等,检测血GH/IGF-1水平在正常范围,内分泌检查有垂体功能减退。影像学检查显示垂体大腺瘤,经蝶入路垂体瘤切除术,术后病理检查证实有SPAA。多数学者认为SPAA可导致生长激素腺瘤达到生化治愈。如果有肢端肥大症特征的患者出现GH/IGF-1水平正常或降低,临床医生应该高度怀疑发生SPAA的可能[8,16-17]。对于无功能性腺瘤,Eichberg等[18]报告由于发生SPAA,肿瘤内部少量、缓慢的出血、坏死,肿瘤的占位效应可以逐渐减少,最终完全消除,可能不需要行手术治疗。但是,需要定期随访观察。 SPAA临床表现的复杂性还表现在特殊人群患者,本研究有2例老年SPAA患者,1例既往有双眼白内障病史拒绝手术,1例有黄斑变性,治疗效果不佳;均出现缓慢的视力障碍与既往眼部疾病相混淆。Puglisi等[11]报道老年患者SPAA出现垂体功能低下可能与年龄相关的功能减退相混淆,使内分泌异常被忽略,易误诊或者漏诊。有文献研究青春期垂体瘤卒中的特点,指出与成人相比,青春期患者具有自身的独特性,其症状表现更缓和,神经系统和内分泌预后更好一些[19]。对于妊娠患者,SPAA出现慢性头痛和视力障碍,容易被误诊为子痫前期,由于妊娠期垂体激素分泌的生理变化,垂体功能减退更难检测。如果确诊为SPAA,需要神经外科、内分泌科、产科共同评估,应立即给予相应的治疗,以保证孕妇和胎儿的安全[20-22]。因此,由于SPAA临床症状的非典型性和复杂性,其诊断往往依赖于术前CT、MRI、手术所见以及术后病理检查。 多数学者认为大腺瘤的SPAA发病率明显高于微腺瘤,肿瘤体积越大,出血发生率越高[11,18,23]。有研究表明,由于大腺瘤生长速度较快,造成相对的血液供应不足;瘤体增大压迫鞍膈孔处的垂体上动脉和门静脉,导致肿瘤内部小量坏死、出血。同时,大腺瘤致鞍内高压缺氧的微环境也会导致肿瘤血供障碍引起SPAA[24-25]。本组78例SPAA病例中,微腺瘤20例(25.6%),大腺瘤58例(74.4%),其中巨大腺瘤12例(15.4%)。但是,也有研究显示垂体微腺瘤发生SPAA较多[7,15],原因尚不明确,说明SPAA具有复杂的发病机制,这需要进一步从分子生物学层面深入研究[26]。 随着免疫组化技术的应用,多数研究认为所有组织学类型的垂体瘤均有发生SPAA的可能,其中有研究认为无功能性垂体瘤更易发生SPAA[5],Cebula等[1]研究表明无功能性腺瘤发生SPAA高达34.38%;而有研究认为功能性垂体腺瘤易发生SPAA,其中泌乳素腺瘤最多见[6-7]。本研究中SPAA在无功能性腺瘤患者中最多见,为51例(65.4%),功能性腺瘤27例(34.6%),其中泌乳素腺瘤16例(20.5%),GH腺瘤6例(7.7%),ACTH腺瘤3例(3.8%),混合性腺瘤2例(2.6%)。分析原因可能是由于无功能性腺瘤起病隐匿,没有内分泌症状,经常会被延迟诊断,甚至发生SPAA才被发现,而那些有明显内分泌改变的垂体瘤患者在很早的阶段,就得到了诊断和治疗,从而避免了发生SPAA的危险[1,5]。 随着分子生物学技术的发展,在垂体瘤中有越来越多的侵袭相关性基因及蛋白质被发现。有研究表明,侵袭性垂体瘤与增殖因子、垂体瘤新生血管相关因子、基因突变等因素相关,常常侵犯海绵窦、蝶筛窦、上斜坡、鞍底骨质等,易发生垂体瘤卒中[27]。 张豪等[28]发现垂体瘤的侵袭性与垂体瘤卒中显著相关,Knosp Ⅲ级是垂体腺卒中的危险因素,其较其他级别更易发生卒中出血。因此,研究建议对于伴有海绵窦侵犯的侵袭性垂体瘤患者,无论肿瘤大小均应尽早接受治疗。Hosmann等[29]认为侵犯海绵窦的侵袭性垂体瘤是卒中的高危因素,对于行次全切除术后的患者,海绵窦内残留的肿瘤,建议早期治疗,以减少卒中复发后临床结果恶化的风险。另外,从肿瘤微生态学角度分析,SPAA可能与鞍内压力的慢性变化有关。随着肿瘤生长,鞍内压力逐渐升高,供血减少,阻断了垂体远侧部和肿瘤的营养血管,导致血供障碍、坏死、出血。同时,肿瘤的缓慢生长会产生一种适应机制,蝶鞍缓慢扩大,血流供应相应增多。当肿瘤突破鞍膈,为继续生长创造条件,可能也使鞍内压力降低。因此,突破鞍膈的侵袭性垂体瘤出现垂体瘤卒中比例减少[30]。 综上所述,SPAA的临床症状不典型,以反复的慢性头痛、缓慢进展的视觉障碍、不同程度的垂体功能减退为主;表现形式复杂,早期临床诊断困难,易误诊和漏诊。SPAA的发病率高于急性垂体瘤卒中。发生SPAA的垂体瘤在肿瘤体积、分泌功能、侵袭性等方面具有一定的独特性。 利益冲突:所有作者均声明不存在利益冲突。2 结 果
3 讨 论
