PIGN表达水平对脑胶质瘤治疗的临床意义
2022-08-29王岚生李欢于如同
王岚生,李欢,于如同
多形性胶质母细胞瘤(glioblastoma,GBM)是最常见的原发性中枢神经系统恶性肿瘤[1]。尽管已有无数治疗措施与靶点用于治疗其他癌症,但GBM的治疗仍然依靠手术为主,辅助以放疗和替莫唑胺(temozolomide,TMZ)为主的化疗。虽然脑胶质瘤的治疗已经取得了一定的进展,但是GBM患者的中位生存期仅14个月[2-3],由于肿瘤的自我保护,快速增长及先天药物抗性等特点,使脑胶质瘤成为最具挑战性的癌症[4],传统的手术、放化疗对其治疗效果均不理想。此外GBM患者生存期超过两年之后,复发率高达50%,患者的5年死亡率高达95%[5],因此亟须一个有效的治疗靶点来改善患者的预后。
癌症染色体不稳定性(chromosome instability,CIN)导致染色体数目和结构变化的速率增加,并产生肿瘤内异质性[6-7]。在大多数实体瘤中均观察到CIN,其与不良预后和耐药性相关[8-9]。《自然》杂志发现了编码在18q染色体上新的CIN抑制基因PIGN(也称为MCD4),这个基因在CIN+结直肠癌(colorectal cancer,CRC)中经常丢失拷贝数[10]。相对于CIN-CRC细胞,CIN+CRC细胞复制更易受损并且存在DNA复制错误增加的现象,PIGN基因沉默会导致结构性染色体异常加剧了有丝分裂中染色体的错聚。相关研究表明,当PIGN发生突变时,PIGN表达异常,基因表达增加,但蛋白质生成减少,产生与基因沉默相似的效果[11]。
在对白血病的研究中,对55例MDS患者的基因表达阵列数据进行的随机森林分析表明,GPI锚定生物合成基因表达与基因组不稳定性之间存在显著(P=0.000 7)相关性(Pearson r=-0.406 8),其中参与GPI-AP生物合成的基因PIGN,在预测MDS进展的风险方面,被列为第三重要因素。此外,在白血病转化与进展过程中,PIGN基因表达异常与白血病细胞中GPI-AP缺乏的频率增加有关。将健康的正常人作为对照组,这些患者中的大多数(约60%)具有显著(P<0.000 1)的高表达PIGN基因。此外,在35例接受PIGN转录和翻译检查的患者样本中,有15例存在异常表达模式(即转录活性增加,但减少至无蛋白质产生)。总的来说,这些数据表明,一组高危MDS或AML-MRC患者出现PIGN表达异常,基因表达增加,但蛋白质生成减少[11]。
总之,PIGN的异常表达对脑胶质瘤患者的意义鲜有研究。本研究运用生物信息学方法分析中国胶质瘤基因组图谱计划(Chinese Glioma Genome Atlas,CGGA)数据库中的数据,探究PIGN在脑胶质瘤中的表达及其临床意义。
1 资料与方法
1.1 一般资料 共纳入693例脑胶质瘤患者的信息,肿瘤相关基因信息及对应的临床数据均从CGGA中获取[12-13](www.cgga.org.cn)。为明确PIGN基因的低表达与高表达,将这些患者按照PIGN表达水平的中位数(2.65)分为高、低表达组,高表达组346例患者,低表达组347例患者。为探讨PIGN表达与后续治疗的关系,将510例接受放疗的患者按照PIGN中位表达水平(2.74)分为高、低表达组,每组各255例。同理,将486例接受化疗患者按中位表达水平(2.61)分为高、低表达组,每组各243例。
1.2 生存分析 生存期是指自患者病理学确诊之日起,至患者死亡或末次随访时间之间的时间。运用Kaplan-Meier分析法分析低表达组患者和高表达组患者的生存期。
1.3 相关性分析 运用生物信息学方法整理CGGA数据库中数据,采用Pearson相关分析法筛选与PIGN表达相关的基因,筛选条件为相关系数>0.4,P<0.05。采用SPSS23进行统计学分析。

2 结 果
2.1 PIGN在不同脑胶质瘤中的表达情况 通过整理CGGA数据库,本研究发现PIGN表达于各级别脑胶质瘤中,该表达趋势不受脑胶质瘤级别的影响(P=0.77,图1A)。在各脑胶质瘤的传统病理分型中,PIGN的表达趋势也不受影响(P=0.51;图1B)。根据2016年WHO中枢神经系统肿瘤分类,PIGN在星型细胞肿瘤(IDH野生型/突变型)、间变型星型细胞肿瘤(IDH野生型/突变型)、少突胶质细胞肿瘤(IDH野生型,1p19q联合缺失)和胶质母细胞肿瘤(IDH野生型/突变型)中均匀表达,无明显统计学差异(P=0.48;图1C)。
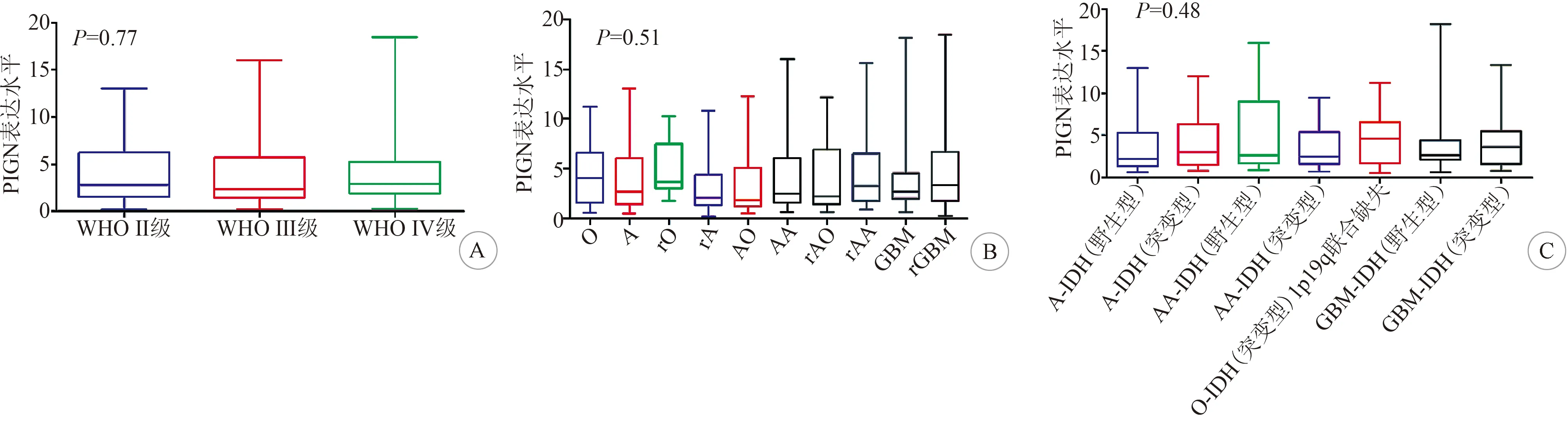
A:WHO分级各级别胶质瘤中PIGN表达量无统计学差异; B:各脑胶质瘤的传统病理分型中,PIGN的表达趋势也无统计学差异; C:中枢神经系统肿瘤分类中,PIGN的表达趋势也不受影响图1 PIGN在各型胶质瘤中的表达
2.2 PIGN表达水平与对脑胶质瘤患者的生存期影响 从CGGA中得到693例mRNA序列样本,患者PIGN的表达水平按其中位数(2.65)分为低表达水平(n=347)和高表达水平(n=346),通过Kaplan-Meier生存分析得出,PIGN低表达组的脑胶质瘤患者总生存期长于高表达组(P=0.003 7,图2)。将这些患者全部的影响因素纳入多因素Cox风险比例回归模型分析,结果表明PIGN的表达水平、年龄、IDH突变及染色体1p19q的联合缺失是评估脑胶质瘤患者生存的独立影响因素(HR分别为1.337,1.332,2.225,1.761;P值分别为0.003,0.008,<0.001,<0.001;表1)。综上所述,PIGN低表达的胶质瘤患者其预后要明显好于PIGN高表达的脑胶质瘤患者,并且PIGN表达水平是脑胶质瘤患者预后的独立影响因子。
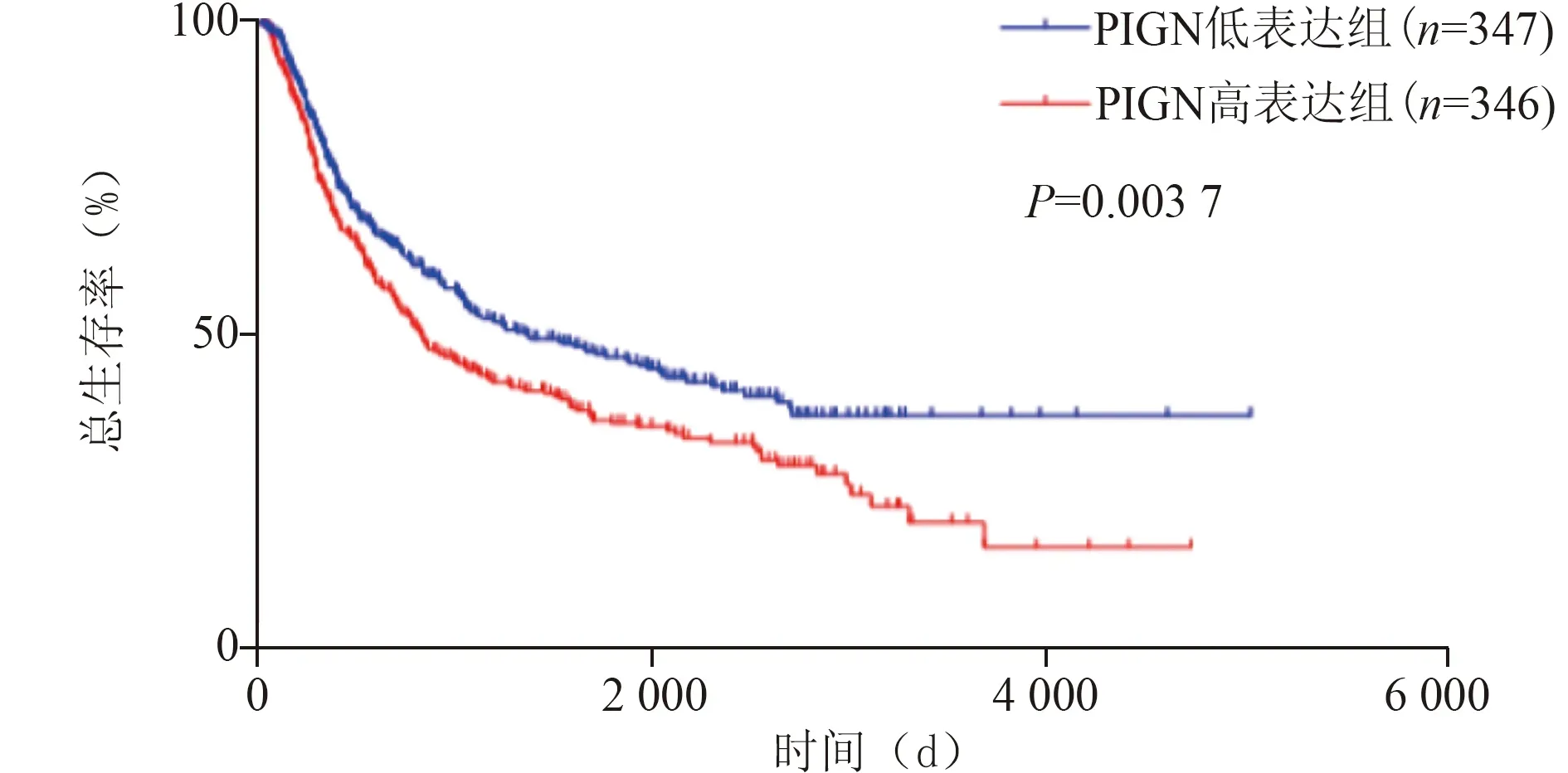
图2 胶质瘤患者的生存曲线

表1 多因素Cox回归分析结果
2.3 PIGN表达水平对脑胶质瘤放疗与化疗的影响本研究中,共510例患者接受了放射治疗,按其PIGN的中位表达水平(2.74)分为低表达患者(n=255)和高表达患者(n=255)。通过Kaplan-Meier生存分析得出,PIGN低表达的脑胶质瘤患者在接受放疗后,生存时间与PIGN高表达的脑胶质瘤患者无统计学意义(P=0.084 4,图3A)。随后本研究统计了486例接受TMZ为主的化疗患者,按其PIGN的中位表达水平(2.61)分为低表达患者(n=243)和高表达患者(n=243)。通过Kaplan-Meier生存分析得出,PIGN低表达的患者在接受化疗后生存时间长于PIGN高表达的脑胶质瘤患者(P=0.034 9,图3B)。
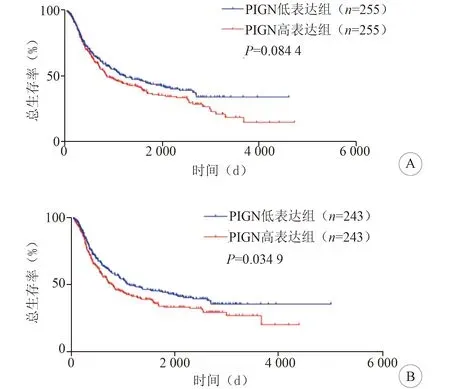
图3 PIGN表达水平对脑胶质瘤放疗与化疗的影响
2.4 PIGN表达与MAD1表达水平的相关性 采用Pearson相关分析法,以相关系数>0.4,P<0.05为筛选条件,对CGGA中693例患者基因表达信息进行筛选。Pearson相关性分析得出,MAD1表达与PIGN表达成明显负相关,相关系数为0.775,P<0.001(图4)。
3 讨 论
PIGN基因是一个编码在18q染色体上的新的CIN抑制基因(也称为MCD4)。PIGN基因表达异常可归因于外显子14和15之间的部分内含子保留,导致移码和提前终止,这与基因组不稳定标志物表达的升高有关。近年来研究表明,PIGN在MDS[11]和结直肠癌[10]中可作为治疗靶点。目前PIGN在脑胶质瘤的表达和具体功能尚未完全阐明。本研究首次通过CGGA数据库对693例患者信息进行大数据分析,发现PIGN广泛表达于脑胶质瘤中,且不会随着脑胶质瘤的级别或病理分型而改变。2016年WHO中枢神经系统肿瘤分类整合了表型和基因型特征进行肿瘤分类,有助于增加诊断的准确性,帮助改善患者的诊疗与管理。在新分类中,本研究发现PIGN的表达也不存在差异性。大量研究表明脑胶质瘤的级别和病理分型对患者的预后影响极大,而本研究发现无论是传统病理分型,还是纳入分子病理特征的最新版的WHO中枢神经系统肿瘤分型,PIGN表达都与分子和病理无关。基于此,本研究推测PIGN有可能是一个独立于其他已知因素的新的影响因子。
关于PIGN对脑胶质瘤患者的预后影响尚无文献报道。运用CGGA数据库中693例脑胶质瘤患者信息,通过Kaplan-Meier生存分析发现,PIGN低表达患者的预后好于高表达患者。而且本研究通过Cox风险比例回归模型进一步证实PIGN是影响胶质瘤患者的独立影响因子。根据以上结果,本研究推测PIGN具有促进脑胶质瘤发生发展的作用,抑制PIGN的表达可以改善脑胶质瘤患者的预后。
为了进一步探究PIGN与脑胶质瘤发生发展之间的机制,本研究通过Pearson相关分析观察到,细胞周期依赖性的PIGN表达与纺锤体装配检查点(SAC)蛋白MAD1的表达呈明显负相关。MAD1是有丝分裂检查点的关键组成部分,该蛋白可以推迟有丝分裂后期开始直到所有染色体正确附着到纺锤体上。线粒体结合的MAD1充当催化剂,帮助蛋白MAD2与有丝分裂调节剂Cdc20结合,从而产生有丝分裂后期抑制剂[14]。在人类细胞中,MAD1蛋白通过与Tpr结合而稳定,有助于促进MAD1和MAD2的线粒体募集[15]。总之,MAD1的正常表达保证了有丝分裂完整性,在维持染色体稳定性和预防癌症转化/进展中至关重要。PIGN和MAD1在细胞周期的G2/M期表达最少, SAC主要负责确保中期到后期过渡过程中染色体的正确分离[16]。即使在源自健康个体的CD34+单核细胞中,PIGN抑制/敲除也会引起MAD1抑制,同时,MAD1抑制导致PIGN的表达降低。这些发现揭示了SAC组件MAD1和PIGN之间的相互调节关系。同时PIGN的基因表达又有其特殊点,当PIGN发生突变时,PIGN表达异常,基因表达增加,但蛋白质生成减少[11]。基于本研究的结果设想,由于PIGN表达和MAD1表达具有显著的负相关性,PIGN基因发生突变时,基因异常高表达,蛋白产生减少,MAD1表达就变低,进而出现有丝分裂的不受抑制,有丝分裂的稳定性下降,进而促进脑胶质瘤细胞的增殖与侵袭。但本研究具有局限性,PIGN低表达改善脑胶质瘤患者预后的机制尚需要进一步的实验研究来证实。
本研究发现,在接受TMZ为主化疗的患者中,PIGN表达水平低的患者的生存期优于高表达患者,而在接受放疗的患者中,PIGN的表达不能预示患者的生存期。基于这一结果,本研究推测PIGN低表达组患者化疗敏感性优于PIGN高表达组患者,抑制PIGN表达可能会改善脑胶质瘤的化疗耐药性,增强临床脑胶质瘤患者的化疗敏感性。化疗是临床治疗脑胶质瘤的重要手段之一,耐化学性仍然是GBM治疗中最严重的障碍。TMZ是目前用于GBM的一线化疗药物,是一种DNA烷基化抗肿瘤药,可在细胞复制过程中诱导DNA链断裂并促进细胞凋亡[17-18]。尽管在过去30年中GBM的治疗取得了显著进步,但中位生存期并未得到明显改善。凋亡抗性是肿瘤细胞的重要特征。线粒体凋亡由Bcl-2家族蛋白调节,该蛋白控制线粒体中细胞色素(Cyt-C)的释放。已知BAD介导内源性线粒体依赖性细胞凋亡[19-20],它们将增加外膜的通透性并触发细胞色素C的释放,并随后级联激活Caspase家族,从而导致关键下游蛋白的激活和相应的基因组DNA损伤[21]。最近的研究表明,TMZ治疗可能通过BAD22改变线粒体凋亡的途径。尽管如此,BAD监管的具体机制仍待探索。简而言之,BAD的表达量越高,癌细胞的化疗抵抗越低,化疗的疗效越好;反之,当BAD低表达时,癌细胞的化疗抵抗增强。为了验证这个想法,本研究对比了BAD与MAD1的相关性,发现两者呈正相关,相关系数为0.587,P<0.001(图5)。基于本研究成果设想,PIGN的异常高表达有可能通过负调节MAD1的表达,参与了胶质瘤细胞BAD的低表达,在化疗的凋亡抵抗中起重要作用。

图5 BAD表达与MAD1表达的关系
总之,PIGN的表达水平是影响胶质瘤患者预后的独立影响因素,其可能成为一个新的有效的治疗靶点。而且PIGN表达水平可以影响化疗患者的预后,因而PIGN抑制剂可能成为临床上的化疗增敏剂,从而改善胶质瘤患者的生存周期。但本研究患者数据量有限,其具体作用机制尚需要进一步实验研究证实。
利益冲突:所有作者均声明不存在利益冲突。
