多肽T9sP对胶质瘤细胞抗肿瘤活性的研究
2022-08-29王榕李博文邵耐远彭亚支枫
王榕,李博文,邵耐远,彭亚,支枫
胶质瘤是颅内原发性恶性肿瘤,占中枢神经系统原发性肿瘤的50%~60%[1]。胶质母细胞瘤(glioblastoma,GBM)是胶质瘤中恶性程度最高的类型,约占胶质瘤的56%,中位生存期约为10个月[2-3]。近年来,虽然手术结合放疗和化疗的联合疗法在治疗胶质瘤上已取得一定进展,但由于胶质瘤的高度增殖和迁移能力,胶质瘤患者的生存率依然很低[4-7]。因此,积极寻找和发现新的有效的胶质瘤治疗药物具有重大意义。
多肽指由几个到几十个天然或非天然氨基酸缩合而成的化合物,既可以人工合成,也可以从天然产物中提取[8]。多肽药物具有合成工艺简单、免疫原性低和药物安全性高、耐受性好等特点,因此,多肽药物尤其是抗肿瘤多肽药物的研究日益受到重视[9]。目前多肽类药物应用于胶质瘤治疗的基础研究已有报道,一种新型的抗胶质瘤血管生成的穿膜肽Tat-C-RP7可以有效地穿透血脑屏障(blood brain barrier,BBB),并在血管内皮细胞中过表达,靶向神经纤毛蛋白1(neurociliary protein 1,NRP1)展现其抗肿瘤活性[10];TAT-Cx43266-283,一种基于间隙连接蛋白43(connexin 43,Cx43)的穿膜肽,选择性靶向胶质瘤细胞,通过抑制c-Src活性从而抑制小鼠胶质瘤生长[11-12]。
本研究发现,E3泛素连接酶TRIM9的短亚型TRIM9s可通过与MKK6相互稳定来增强p38信号通路协同抑制胶质瘤的进展[13],而多肽T9sP是一段来自TRIM9s蛋白的片段。细胞穿透肽(cell penetrating peptides,CPPs)是一类可作为药物运送载体的多肽,反式转录激活因子(trans-activator of transcription,TAT)GGRKKRRQRRR是胶质瘤中常用的一种CPPs,已被证实可以穿透BBB,由于其操作简单且安全性高,本研究选择TAT作为多肽T9sP的载体,形成TAT-T9sP,从而促进T9sP进入肿瘤细胞[11,14]。为了验证T9sP的抗胶质瘤活性,本研究以人胶质瘤U87细胞为材料,研究T9sP对胶质瘤细胞增殖能力的影响,初步探讨T9sP抗胶质瘤的机制,为进一步研究和开发利用T9sP打下一定的工作基础。
1 材料与方法
1.1 材料 TAT-T9sP多肽和TAT-Scr对照肽(Scr为T9sP氨基酸序列随机打乱后形成的对照组多肽,其序列为GQLYEAQRKGITEPSSRLE)及其FITC荧光标记肽(FITC-T9sP和FITC-TAT-T9sP)由南京倍尔博有限公司设计并合成,多肽纯度>98%。DMEM培养基、pH=7.4的磷酸盐缓冲盐溶液(phosphate-buffered saline,PBS)、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素-谷氨酰胺(100×)、0.25%含有EDTA和酚红的胰蛋白酶和ECL化学发光显色液购自Thermo Fisher公司。CCK-8细胞增殖检测试剂盒、Annexin V/PI细胞凋亡检测试剂盒、BCA蛋白浓度检测试剂盒和结晶紫染色液均购自碧云天生物技术公司。Western及IP细胞裂解液购自联科生物。p38抑制剂(SB203580)购自Selleck公司。Western Blot抗体p-p38(#9211),p38(#8690),p-ERK(#9101),ERK(#9102),p-JNK(#9251),JNK(#9252)和β-actin(#4970)购自Cell Signaling Technology公司。辣根过氧化物酶标记山羊抗兔IgG(H+L)购自Jackson ImmunoResearch公司。
1.2 方法
1.2.1 细胞培养 人神经胶质瘤细胞系U87(上海中科院细胞库)置于5% CO2和37 ℃恒温培养箱(Thermo Fisher)中,在含10%FBS和1%双抗的DMEM培养基中进行常规培养。处于对数生长期的细胞经0.25%胰蛋白酶消化后吹打成单细胞悬液,按照一定的细胞密度接种于细胞培养板中,待细胞完全贴壁后用于后续实验。
1.2.2 细胞摄取实验 为了证实多肽穿透细胞的能力,采用异硫氰酸荧光素(fluorescin isothiocyanate,FITC)标记多肽,形成FITC-T9sP和FITC-TAT-T9sP,处于对数生长期的U87细胞接种于6孔板中,分别加入20 μM的FITC-T9sP和FITC-TAT-T9sP处理细胞,24 h后置于荧光倒置显微镜下拍照。
1.2.3 细胞增殖实验 U87细胞按照每孔加入100 μL 8 000个细胞悬液接种于96孔培养板中,待细胞贴壁后,细胞随机分成溶剂组(PBS)、TAT-Scr组(10 μM,20 μM,40 μM,80 μM,160 μM)和TAT-T9sP组(10 μM,20 μM,40 μM,80 μM,160 μM)每个浓度设6个复孔,边缘孔用PBS填充,24 h后每孔加入10 μL的CCK-8溶液,在37 ℃培养箱中继续孵育1 h,用BioTek Synergy 2多功能酶标仪在450 nm处测定吸光度。按照以下公式计算细胞存活率(%):存活率(%)=OD实验组/OD溶剂组×100%。
1.2.4 细胞迁移实验 选对数生长期U87细胞,铺6孔板(约5×105个细胞/孔),37 ℃培养箱过夜培养,待细胞铺满后,用灭菌的20 μL枪头进行划痕标记,PBS清洗细胞以去除划下的细胞,然后换新鲜的无血清培养基进行培养,多肽处理0 h及24 h后将细胞置于倒置显微镜下进行观察并拍照,使用Image J软件计算细胞间迁移距离的变化。
1.2.5 细胞侵袭实验 无血清DMEM培养基制备单细胞悬液,调整细胞密度至2.5×105/mL,取细胞悬液200 μL加入已均匀铺入基质胶的Trans-well小室(康宁,3422,8.0 μm孔径聚碳酸酯膜小室),在Trans-well下室中加入750 μL含10% FBS的DMEM培养基,24 h后用4%多聚甲醛固定细胞,晾干后用棉签小心地擦除上室内残留的细胞,再用结晶紫(碧云天,C0121)染色,充分洗涤后在倒置显微镜Olympus IX71下拍照,并用Image-Pro-Insight软件对各组细胞随机选取6个区域进行分析统计。
1.2.6 细胞凋亡实验 U87细胞随机分为对照组、TAT-Scr阴性组和TAT-T9sP实验组,多肽处理24 h后收集细胞,用PBS洗涤,1 000 g离心5 min,弃上清液,重新悬浮于195 μL Annexin V-FITC结合液中,然后在室温下用5 μL Annexin V-FITC和10 μL PI避光孵育20 min。染色结束后,1 h内流式细胞仪(Guava EasyCyte 6HT-2L)检测凋亡细胞。
1.2.7 Western Blot实验 U87细胞随机分为对照组、TAT-Scr组、TAT-T9sP组和TAT-T9sP+SB203580组,接种于6孔板中,在指定的时间点用预冷的Western及IP细胞裂解液(联科生物)裂解多肽处理后的细胞,收集总蛋白后采用BCA法测定蛋白浓度。100 ℃下蛋白变性5 min,SDS-PAGE电泳分离蛋白,湿转法将蛋白转移至PVDF膜上。随后PVDF膜用封闭缓冲液(5%脱脂奶粉-PBST)室温孵育1 h,然后在4 ℃用一抗孵育过夜。PBST洗涤3次,在室温下与二抗孵育1 h,用ECL显色,Tanon-4600化学发光成像系统观察并分析蛋白条带。

2 结 果
2.1 合成TAT-T9sP 为了增强跨膜通透性,T9sP和Scr与TAT融合形成TAT-T9sP和TAT-Scr(图1A)。Scr为T9sP乱序排列后形成的多肽对照,质谱分析结果显示,TAT-T9sP的分子质量为3 598.1 Da(图1B)。

A:TAT-T9sP序列; B:质谱分析图1 合成TAT-T9sP
2.2 TAT-T9sP在细胞内的蓄积 为了检测细胞摄取多肽的情况,用FITC标记T9sP和TAT-T9sP,生成FITC-T9sP和FITC-TAT-T9sP。用FITC-T9sP或者FITC-TAT-T9sP处理胶质瘤U87细胞24 h,用荧光倒置显微镜观察这些多肽的细胞摄取情况。可以在FITC-TAT-T9sP处理的细胞中观察到较强的绿色荧光,而在用FITC-T9sP处理的细胞中只能检测到较弱的绿色荧光(图2)。

图2 TAT-T9sP在细胞内的蓄积(FITC标记绿色荧光,×200)
2.3 TAT-T9sP对U87细胞增殖的影响 在U87细胞中加入不同浓度的TAT-T9sP,观察TAT-T9sP对胶质瘤细胞的抑制作用。CCK-8实验结果表明,与对照组相比,TAT-Scr仅对细胞产生微弱的抑制效果,而TAT-T9sP可以显著抑制U87细胞的增殖,且随剂量的增加抑制作用越强(图3)。TAT-T9sP在浓度为20 μM的时候对U87细胞增殖的抑制具有显著性差异(P<0.01),在后续实验中选择20 μM浓度的TAT-T9sP处理胶质瘤细胞。

图3 TAT-T9sP抑制U87细胞增殖(**P<0.01,***P<0.001)
2.4 TAT-T9sP对U87细胞迁移的影响 细胞迁移是肿瘤发展的一个重要阶段,因此,采用细胞划痕实验检测TAT-T9sP对细胞迁移的影响。与对照组相比,TAT-Scr处理组对细胞迁移几乎没有抑制效果,而TAT-T9sP可以显著抑制U87细胞的迁移(P<0.001)。见图4。
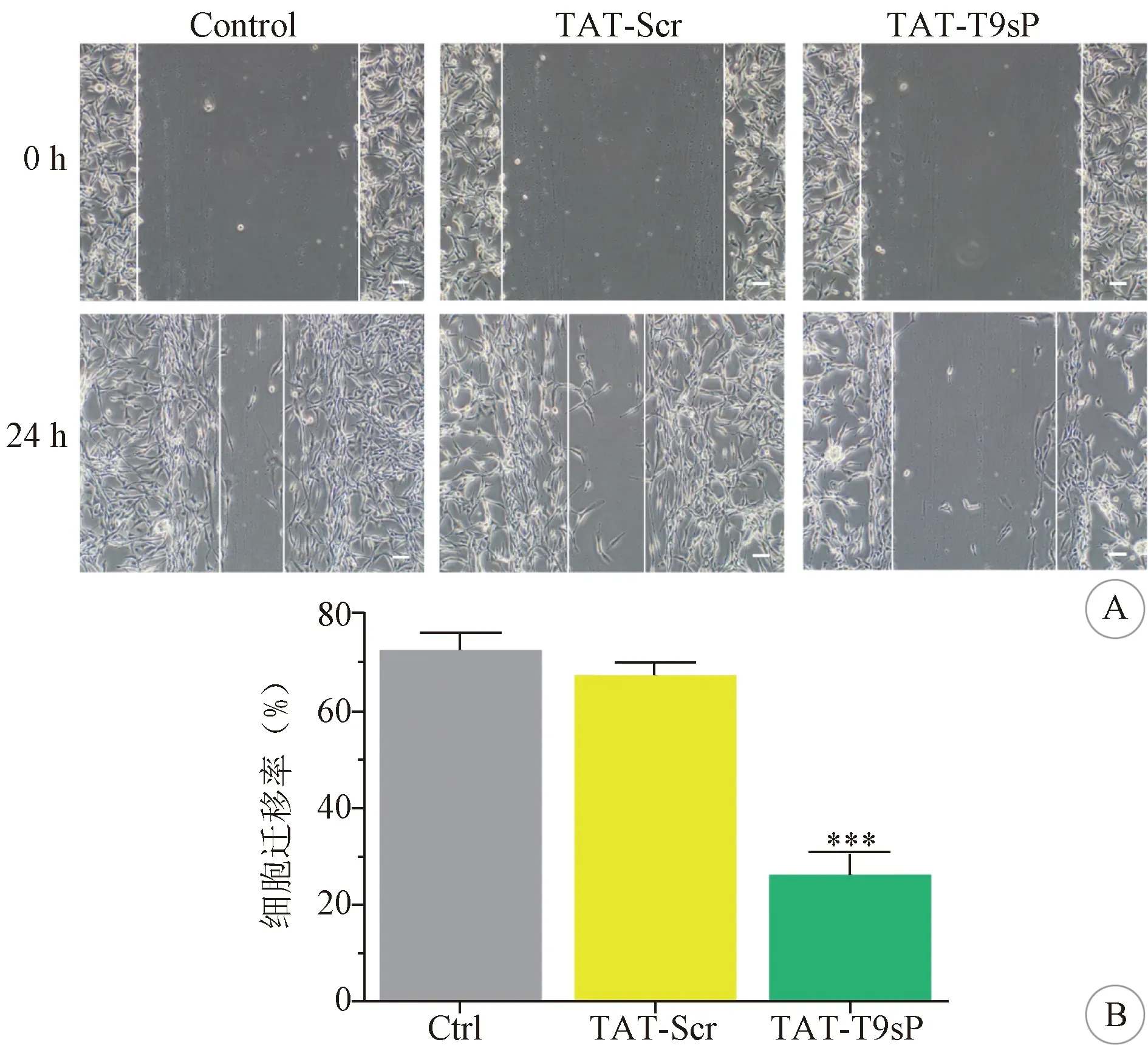
A:划痕实验检测细胞迁移能力图(×200); B:划痕实验检测细胞迁移能力统计结果图(***P<0.001)图4 TAT-T9sP抑制U87细胞迁移
2.5 TAT-T9sP对U87细胞侵袭的影响 Trans-well实验检测TAT-T9sP对U87细胞侵袭能力的影响。与对照组相比,TAT-Scr处理组转移到下室的细胞数量没有显著变化,即对细胞侵袭能力几乎没有抑制效果,而TAT-T9sP可以显著抑制U87细胞转移到下室中的细胞数量,即显著抑制其侵袭能力(P<0.01)。见图5。

A:Transwell检测细胞侵袭能力图(结晶紫染色,×200); B:Transwell检测细胞侵袭能力统计结果图(**P <0.01)图5 TAT-T9sP抑制U87细胞侵袭
2.6 TAT-T9sP对U87细胞凋亡的影响 流式细胞术结果示,与对照组相比,TAT-Scr略微促进了细胞凋亡,而TAT-T9sP可以显著促进U87细胞的凋亡(P<0.01),早期凋亡的细胞的平均比率从3.37%增加到14.30%,晚期凋亡的细胞的平均比率从3.58%增加到13.42%。见图6。
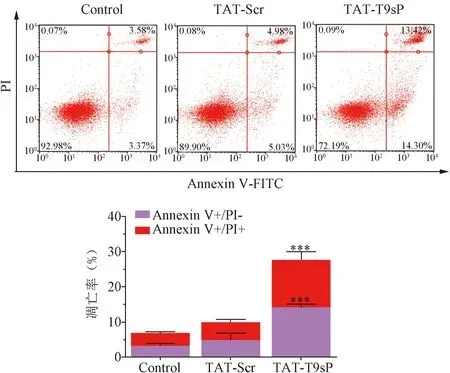
图6 TAT-T9sP促进U87细胞凋亡(***P<0.001)
2.7 TAT-T9sP激活p38 MAPK信号通路 Western Blot实验结果表明,与对照组相比,TAT-T9sP处理组显著增加p38的磷酸化水平(P<0.001),使用p38抑制剂SB203580后,p-p38表达显著降低(P<0.01);而TAT-Scr组细胞相较对照组细胞,p-p38和p38无显著差异(图7A、B);TAT-T9sP和TAT-Scr处理组细胞较对照组的ERK和JNK及其磷酸化表达水平未见显著差异(图7C-E)。此外,SB203580可以显著抑制TAT-T9sP诱导的肿瘤细胞凋亡(图7F-G)。综上,TAT-T9sP激活p38信号通路,而非ERK和JNK MAPKs信号通路。

A:p38 MAPK信号通路的蛋白表达水平; B:p-p38和p38统计分析结果(**P<0.01,***P<0.001); C:ERK和JNK MAPKs信号通路的蛋白表达水平; D:p-ERK和ERK统计分析结果; E:p-JNK和JNK统计分析结果; F:流式细胞仪检测细胞凋亡图; G;凋亡率统计图(和TAT-T9sP组比较,*P<0.05,**P<0.01)图7 TAT-T9sP激活p38信号通路
3 讨 论
胶质瘤作为中枢神经系统中最常见的原发性恶性肿瘤,目前主要的治疗策略为最大限度的手术切除、放化疗结合,近些年虽然技术和手段都有很大提高,但其预后依然很差[2]。近十年来,多肽类药物日益受到人们的重视,与化疗和基因治疗相比,多肽类药物具有高特异性、高耐受性、高选择性、低毒性和低遗传毒性等优点[15],可直接或间接作用于肿瘤细胞,目前大约有140种多肽类药物正在临床试验中进行评估[16],其潜在的抗肿瘤机制主要通过调节免疫功能、促进肿瘤细胞凋亡、抑制肿瘤新生血管生成等[17]。此外,蛋白质工程和分子建模的进展使得短氨基酸序列肽的操作和应用变得容易,可以使其更适合临床应用[18]。
目前多肽类化合物作为新型的抗肿瘤药物,应用于胶质瘤治疗方面已得到研究人员的广泛关注。一种细胞凋亡素衍生肽通过下调HSP70促进胶质瘤细胞凋亡,从而抑制胶质瘤生长[19]。GBMP1α,一种通过Fmoc化学法固相合成的BMP-2模拟肽,被证实在体外可以诱导神经胶质瘤干细胞的分化,有望成为GBM的抗肿瘤药物[20]。通过计算机辅助药物设计构建的epsin泛素相互作用基序(UIM)的模拟肽被证实可以结合泛素化的血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2),再通过化学合成法构建的UIM模拟肽UPI可以通过调控VEGFR2信号通路抑制肿瘤血管生成,从而抑制肿瘤生成,并在U87荷瘤小鼠中得到证实[21]。树突状细胞衍生因子(dendritic cell derived factor 1,DCF1)与TAT形成新肽TAT-DCF1可以显著降低U251胶质瘤细胞增殖和迁移能力,并促进细胞凋亡[22]。然而,目前仍然缺乏具有较好的胶质瘤治疗效果、副作用小,且可在临床上广泛展开应用的多肽药物。本研究发现了一条具有胶质瘤细胞增殖、迁移和侵袭并促进细胞凋亡的多肽,该多肽为全新的氨基酸序列,目前针对它的研究仍有待继续。虽然本研究尚处于细胞实验阶段,但是现有结果表明TAT-T9sP有望成为一种新的抗胶质瘤药物。
肿瘤细胞中活性多肽发挥功效的主要障碍之一是细胞通透性低[23]。因此,研究者们开发了各种药物递送系统,例如脂质膜纳米载体、聚合物载体和无机载体等用于增强活性多肽的细胞通透性。比如,Pucci等[24]开发了一种angiopep-2修饰的脂质纳米载体包裹了nutlin-3a和氧化铁,它能够穿透BBB并选择性地促进GBM细胞死亡。Yuan等[25]开发了一种细胞穿透肽R8修饰的脂质体,它可以有效地穿过血脑屏障,并将阿霉素递送到肿瘤区域,抑制体内和体外肿瘤的生长。研究将TAT与T9sP融合形成TAT-T9sP,TAT-T9sP能有效地穿透细胞膜进入细胞质,抑制肿瘤细胞生长。鉴于高浓度的穿膜肽TAT仍然具有些许的细胞毒性,未来将考虑更换新的具有更强穿透效率和更低细胞毒性的多肽载体。
p38 MAPK信号通路作为最常见的信号通路之一,响应各种细胞刺激而被激活,参与调控了胶质瘤细胞的增殖、迁移和凋亡。报道称,替莫唑胺作为一种临床上胶质瘤患者的一线用药,可部分通过激活p38的磷酸化水平抑制U87和U251胶质瘤细胞系的增殖、迁移和侵袭[26]。而p38抑制剂可以显著减少重楼皂苷Ⅵ诱导的胶质瘤细胞系U87的凋亡[27]。本研究之前报道过,TRIM9s,而非TRIM9l,通过增强p38信号通路抑制恶性胶质瘤的发展[13]。本研究发现来自TRIM9s的多肽片段T9sP,可以通过激活p38 MAPK信号通路而非ERK/JNK信号通路,显著抑制胶质瘤细胞的增殖、迁移,和促进肿瘤细胞凋亡。虽然多肽T9sP可以激活p38 MAPK信号通路,但是由于p38 MAPK信号通路同时也广泛参与体内的其他多种生理功能,因此多肽T9sP是否会对其他的生理功能产生影响需要通过动物体内实验进一步验证。
总之,本研究为T9sP进一步发展成为治疗胶质瘤的新肽药物提供了初步证据,但仍需进一步探讨其功效及机制。
利益冲突:所有作者均声明不存在利益冲突。
