胶质瘤中TRP基因家族预后模型的开发和验证
2022-08-29郭兆刚
郭兆刚,栾 涛,邓 超,岳 博,祖 静,万 研
胶质瘤是一种发病率最高的原发性脑肿瘤,根据WHO指南,可分为高级别胶质瘤(Ⅲ-Ⅳ)与低级别胶质瘤(Ⅰ-Ⅱ)。目前外科手术联合放化疗治疗效果有限,患者中位生存期依然保持在15个月以下。寻找新的分型并预测患者预后对指导胶质瘤的临床治疗具有重大意义。瞬时受体电位(transient receptor potential, TRP)通道为位于细胞膜上的离子通道蛋白,通过形成四聚体结构行使非选择性阳离子跨膜运输功能。在哺乳动物中,有7个TRP亚家族,包括TRPC、TRPV、TRPM、TRPA、TRPP、TRPML和TRPN。除调节感觉及激素和信息素信号传导的作用外,TRP基因家族也可通过影响细胞周期、细胞凋亡、氧化应激等促进肿瘤进展。本研究通过分析TCGA数据库和CGGA数据库中的胶质瘤测序数据,探讨有影响的TRP家族蛋白对胶质瘤预后的影响。
1 资料与方法
1.1 数据来源 使用Perl语言从UCSC Xena网站中下载的TCGA target GTEx数据集中提取胶质瘤(低级别胶质瘤523例、高级别胶质瘤171例)和正常脑皮质(105例)的基因表达数据及胶质瘤患者的临床信息,并从CGGA数据库中提取了1018例胶质瘤患者的基因表达数据及临床信息。
1.2 预后模型的构建与验证 在R语言中,使用TCGA中数据进行单因素COX回归分析以确定与预后相关的TRP家族基因,使用“glmnet”包建立LASSO-COX回归和多因素COX回归模型,在此基础上进行风险评分计算以评估患者预后,并使用CGGA数据进行预后模型的效能验证。
1.3 临床特征的预后分析 采用R语言对患者年龄、病理分级、性别、复发类型及风险得分进行单因素和多因素COX分析以探究其对胶质瘤预后是否有影响。
1.4 免疫浸润分析 使用CIBERSORT以评估患者风险评分与免疫细胞浸润之间的相关性。
1.5 统计学处理 TRP基因家族在胶质瘤组织及正常对照组织中的表达差异使用Wilcoxon检验;TRP基因家族表达情况及不同风险亚组与胶质瘤患者的预后相关性使用Kaplan-Meier方法分析及log-rank检验进行比较;<0.05为差异有统计学意义。
2 结 果
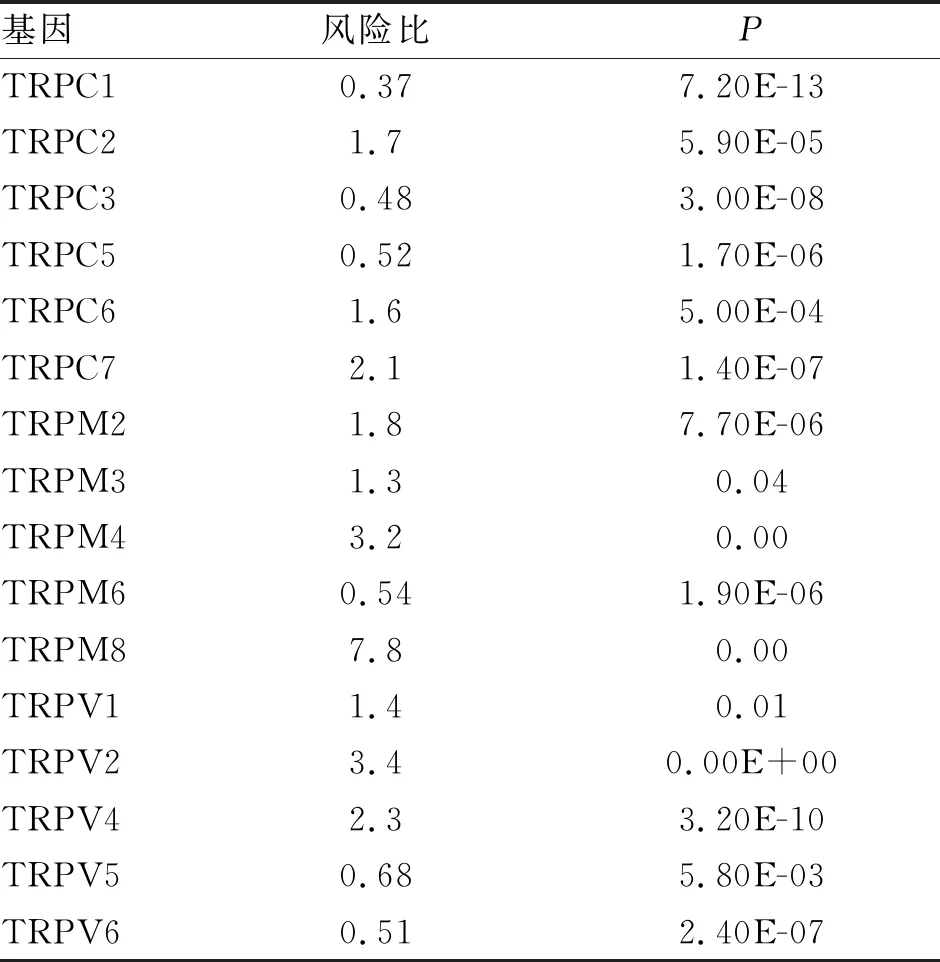
2.1 TRP家族在胶质瘤的表达及与预后的关系 与105组正常脑皮质样本相比,在胶质瘤患者中,TRPC2、TRPC4、TRPC6、TRPC7、TRPM7、TRPM8、TRPV4表达显著上调,TRPA1、TRPC5、TRPM2、TRPM3、TRPM4、TRPM5、TRPM6、TRPV1、TRPV3、TRPV5显著下调(图1);使用GEPIA网页工具评估TRP基因家族与患者预后相关性(表1),提示TRP基因家族在胶质瘤中表达失调且会影响胶质瘤患者的生存周期。
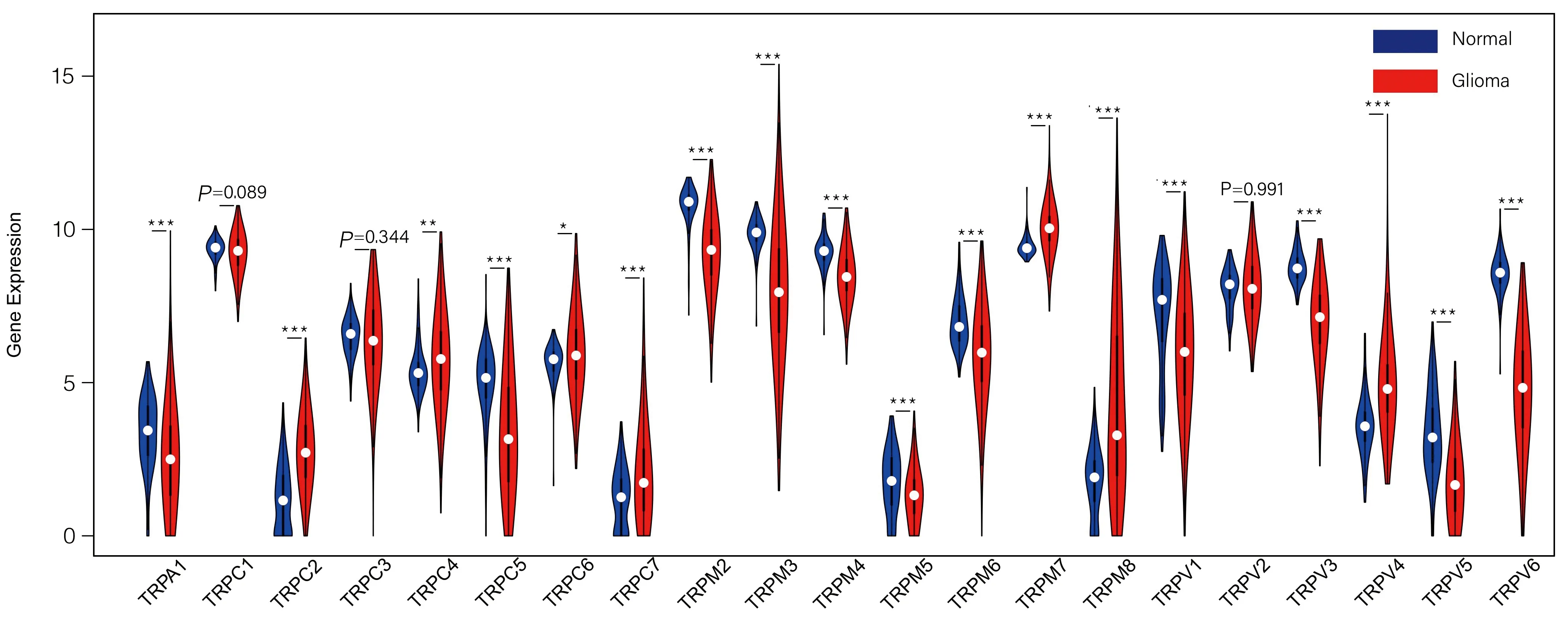
2.2 预后模型构建与效能验证 为进一步理解TRP基因家族与胶质瘤患者预后的相关性,使用单因素COX回归分析确定与胶质瘤预后相关的18个TRP基因(TRPA1、TRPC1、TRPC2、TRPC3、TRPC4、TRPC5、TRPC6、TRPC7、TRPM2、TRPM4、TRPM6、TRPM7、TRPM8、TRPV1、TRPV2、TRPV4、TRPV5、TRPV6),进一步利用LASSO-COX回归分析,从上述18个TRP基因家族中筛选出7个基因TRPC1、TRPC3、TRPM4、TRPM6、TRPM8、TRPV2、TRPV4以构建预后模型[风险得分= Exp×(-0.1067)+Exp×(-0.0286)+Exp×0.1614+Exp×(-0.1432)+Exp×0.2074+Exp×0.2022+Exp×0.0114)]。
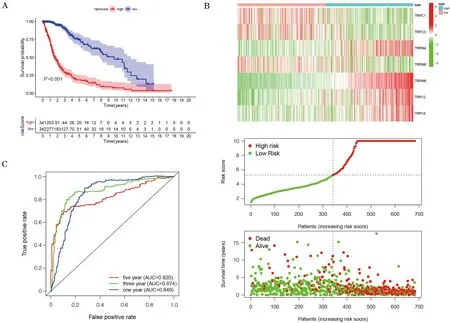
根据得分中位值,将患者分为高危亚组(=341)和低危亚组(=342),结果显示,在高危组中TRPM8、TRPV4、TRPM4、TRPV2表达水平较高,在低危组中TRPM6、TRPC1、TRPC3表达水平较高。使用KM分析发现,高危组5年生存率(0.0586)显著低于低危组(0.1491),差异有统计学意义(<0.001)。为进一步评估TRP家族基因的预后模型对总生存期预测的累积效应,计算受试者操作特征曲线下面积,1、3、5年的AUC值均>0.8,提示该预后模型有优秀的预测效能(图2)。在CGGA数据库中进一步验证该预后模型,高危组五年生存率依然明显低于低危组,差异有统计学意义(<0.001);1、3、5年的AUC值均>0.6,提示该预后模型在CGGA验证集中依然有较高的可信度(图3)。
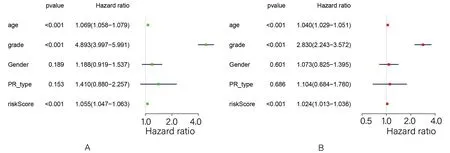
2.3 患者临床特征的预后分析 为阐明胶质瘤患者的临床特征与预后之间的关系,进行了单因素与多因素COX回归分析。单因素COX回归及多因素COX回归分析结果显示患者风险评分与患者的年龄和疾病病理分级均可作为独立因素评价患者预后(图4)。
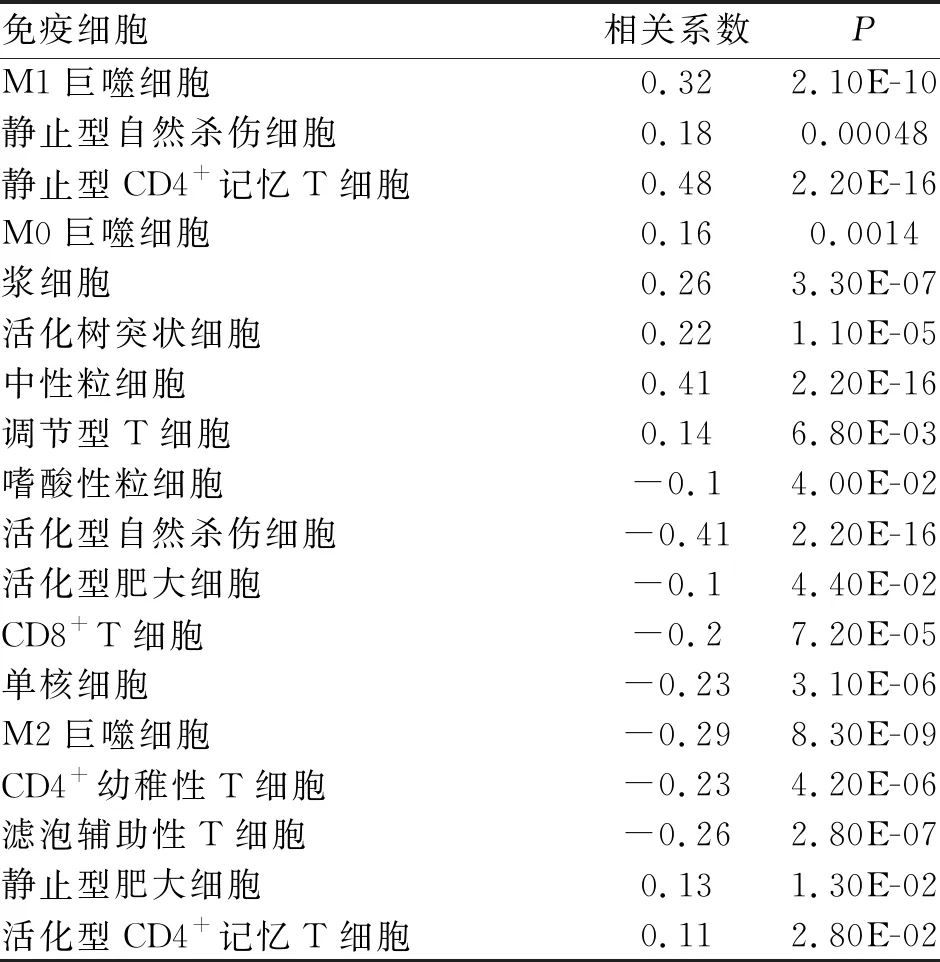
2.4 高低风险组免疫浸润分析 使用CIBERSORT免疫浸润算法评估风险评分与患者免疫浸润之间的相关性。发现树突状细胞、M0巨噬细胞、M1巨噬细胞、静止型肥大细胞、中性粒细胞、静止型自然杀伤细胞、浆细胞、活化型记忆CD4T细胞、静止型记忆CD4T细胞、调节型T细胞与风险评分呈正相关型,嗜酸性粒细胞、M2巨噬细胞、活化型肥大细胞、单核细胞、活化型自然杀伤细胞、CD4幼稚性T细胞、CD8T细胞、滤泡辅助性T细胞与风险评分呈负相关性,表明高风险患者中自然杀伤细胞的活性降低及记忆CD4T细胞的休眠导致其免疫系统抗肿瘤的活性相较低风险组较弱;而低风险组患者中CD4幼稚性T细胞、滤泡辅助性T细胞的增加使得患者免疫系统的抗肿瘤活性更高;提示免疫微环境中不同免疫细胞的组分差异是高低评分亚组生存率差异的原因之一(表2)。
3 讨 论
TRP基因家族于1969年首次在果蝇中被发现。1997年,Caterina等首先报道了TRPV1可被辣椒素及加热所激活,确认了TRP基因编码的蛋白质在感觉系统中发挥重要功能。随后,有学者对TRP家族基因所编码的蛋白在温度、拉伸/压力、化学物质、氧化/还原、渗透压和pH值等细胞周围环境的感受作用进行了报道;研究发现,除作为细胞感受器作用外,TRP家族基因在胶质瘤的发生发展中起着重要作用。使用SKF96365抑制TRPC亚家族可以导致胶质瘤细胞系D54MG发生G/M期阻滞并最终导致细胞死亡;TRPM2的表达上调导致氧化应激和细胞内钙离子浓度升高,从而促进胶质瘤细胞系的凋亡;过表达TRPM8可以通过ERK通路依赖的方式增强胶质瘤细胞的侵袭性和增殖能力;在胶质母干细胞中,TRPV2的过表达会导致胶质纤维酸性蛋白及βⅢ型微管蛋白的表达上调,从而促进角质表型的分化,同时抑制胶质干细胞在体内和体外的增殖。
随着分子病理学进展,越来越多的分子标志物被应用于判断胶质瘤患者的预后,但单个临床因素或者单个基因特征易受多个因素的影响,对患者预后判断的准确程度有待评估,胶质瘤患者需要更为严谨的预后模型以指导精准化医疗。本研究通过探索与胶质瘤进展相关的TRP基因家族,结果发现TRP基因家族在胶质瘤中存在广泛异常表达,且与患者预后有关。使用TRP基因家族基于523例低级别胶质瘤和171例高级别胶质瘤样本的表达数据构建的预后模型在训练集(1、3、5年AUC均>0.08)和验证集(1、3、5年AUC均>0.06)中均表现出了良好的预后效能。单因素及多因素回归分析显示,基于TRP家族基因的风险评分可以作为预测患者不良预后的独立因素。此外,基于预后模型对胶质瘤患者进行高低风险分组,低风险组预后均明显优于高风险组。本研究免疫浸润分析结果提示,低风险组中活化性自然杀伤细胞、CD4幼稚型T细胞、滤泡辅助性T细胞的比例均高于高风险组,低风险组患者对胶质瘤的免疫反应性更强。
综上所述,TRP基因家族构建的预后模型具有预测胶质瘤患者预后的能力,且可以指导胶质瘤的临床诊疗,但TRP基因家族在胶质瘤进展及影响免疫细胞浸润的潜在分子机制仍需进一步实验探究。
