PMA-RF-SRCA 检测乳中单增李斯特氏菌活菌
2022-08-28王新潮张蕴哲杨倩卢鑫徐慧张伟
王新潮,张蕴哲,杨倩,2,卢鑫,徐慧,张伟,4,5
(1. 河北农业大学食品科技学院河北保定 071001; 2. 河北大学公共卫生学院河北保定 071002; 3. 河北农业大学理工学院 河北 沧州 061100; 4. 河北农业大学生命科学学院 河北 保定 071001; 5. 河北省人畜共患病原微生物分析与防控重点实验室 河北 保定 071001)
0 引 言
单增李斯特氏菌为需氧或兼性厌氧的革兰氏阳性杆菌,广泛存在于各类食品中[1-2]。感染该菌能引起流产、脑膜炎、败血症、胃肠炎等,严重的可以导致死亡[3-4]。此外,该菌也是我国乳制品中致病菌检测指标之一。因此,开发快速灵敏检测单增李斯特氏菌活菌,对于保障食品安全具有重要的意义[5]。
传统的微生物培养方法结果可靠但耗时费力[6],快速检测方法如PCR 可以快速检出食品中的单增李斯特氏菌[7-8]。该方法需要昂贵的热循环仪,操作复杂且耗时较长。本研究基于在前期研究中发现Bst DNA聚合酶扩增DNA 的新特性,创建了跨越式滚环等温扩增(SRCA)检测靶基因的新方法[9]。叠氮溴化丙锭(Propidium monoazide,PMA)作为一种能够区分死活菌的核酸染料,目前已被广泛报道并应用[10-12]。本研究将实时荧光SRCA 技术(RF-SRCA)与PMA 结合,建立可实时检测单增李斯特氏菌活菌的PMA-RFSRCA 方法,为食源性致病菌检测提供新途径、新策略。
1 材料与方法
1.1 试剂与试剂盒
细菌基因组提取试剂盒、PMA 染料、20×EvaGreen染料,北京索莱宝生物科技有限公司;PMD18-T 载体,大连宝生物工程有限公司;Bst DNA 聚合酶大片段,New England Biolabs;dNTP、大肠杆菌感受态细胞、胶回收DNA 试剂盒,天根生化科技有限公司;单增李斯特氏菌增菌肉汤(LB1),北京陆桥技术股份有限公司; 单增李斯特氏菌显色培养基, 法国CHROMAgar;正反引物由上海生工生物工程股份有限公司合成。
1.2 仪器与设备
StepOne Plus 荧光定量PCR 仪,美国Applied Biosystems 公司(ABI);Synergy HTX 全波长酶标仪,美国BioTek 公司;紫外凝胶成像分体系统,北京君意东方电泳设备有限公司;DDY-8C 型电泳仪,北京六一仪器厂;DK-8D 型电热恒温水槽,上海一恒科技有限公司;TG16A 型离心机,上海卢湘仪器有限公司;生化培养箱,上海博迅实业有限公司;恒温培养摇床,上海一恒科学仪器有限公司。
1.3 方法
1.3.1 引物设计
本研究所采用的的SRCA 方法仅需一对引物,无需人为环化及锁式探针连接,即可实现对双链线性DNA 模板的等温高效扩增,目前已被成功用在多种致病菌的检测[13-17]。该方法以单增李斯特氏菌溶血素基因(hlyA)作为靶基因,在GENbank 中挑选同源性较高的hlyA 基因序列(GENBANK 号:AF253320.1),利用DNAMAN 和Oligo7 软件辅助筛选特异性引物,所得引物见表1。

表1 引物信息
1.3.2 活菌培养、DNA 模板与死菌的制备
将单增李斯特氏菌活化后接种到LB1 液体培养基中进行前增菌,在30 ℃下摇床过夜培养,以此为菌原液,进行10 倍系列梯度稀释。用细菌基因组DNA提取试剂盒提取各梯度菌悬液制备DNA 模板。分别取500 μL 菌原液于1.5 mL 的离心管中,采用高温煮沸法处理5 min,采用平板计数法评估致死效果,以确保无活菌生长[18]。
1.3.3 PMA 处理条件的优化
1.3.3.1 PMA 工作浓度的优化
将1 mg PMA 染料溶于98 μL ddH2O,制备终浓度为20 mg/mL 母液,并放置-20 ℃冰箱中避光保存。取上述制备好的死菌菌悬液500 μL,分别加入不同体积的PMA 母液使其最终的工作浓度为0、10、20、30、40 μmol/L。混匀后暗孵育10 min,随后在距500 W卤钨灯20 cm 处进行光反应15 min。为了防止因强光照射导致温度的升高,光反应阶段全部在冰上进行。将处理好的菌悬液按照核酸提取试剂盒说明书提取DNA 并进行PMA-RF-SRCA 反应,通过观察扩增结果来确定PMA 抑制死菌DNA 扩增的最适工作浓度。
1.3.3.2 PMA 暗孵育时间优化
取制备好的死菌菌悬液500 μL,加入1.3.3.1优化后的最适浓度的PMA,混匀后分别进行暗孵育0、5、10、15、20 min。随后在距500 W 卤钨灯20 cm 处进行光反应15 min,后续步骤与1.3.3.1 相同。
1.3.3.3 PMA 光反应时间优化
取制备好的死菌菌悬液500 μL,加入1.3.3.1 优化后的最适浓度的PMA,混匀,采取1.3.3.2 优化后的最适暗孵育时间进行孵育,随后于冰上分别进行光反应0、5、10、15、20 min。后续步骤与1.3.3.1 相同。
1.3.4 PMA-RF-SRCA 方法建立
通过优化得出PMA-RF-SRCA 最佳的反应体系为:dNTPs 5 μL(0.5 mmol/L)、Mg2+3 μL(5.96 mmol/L)、10×Buffer2.5μL(1×)、FWP 与RVP 各1.5 μL(0.6 mmol/L)、模板2 μL、Bst DNA 聚合酶1 μL(0.32 U/μL)、甜菜碱溶液3 μL(0.6 mol/L)、20×Eva Green 荧光染料1.25 μL(1×),用ddH2O 补齐至25 μL 反应体系。反应程序为:62 ℃,10 s;62 ℃,1 min,设定40 个循环,同时进行信号采集;最后80 ℃,5 min 终止反应。
1.3.5 PMA-RF-LAMP 方法建立
参照行业标准[19]建立PMA-RF-LAMP 方法。反应体系为:dNTPs 4 μL(1.6 mmol/L),F3 和B3 各0.5 μL(0.2 μmol/L),FIP 和BIP 各1 μL(1.6 μmol/L),甜菜碱4 μL(0.8 mol/L),Mg2+1 μL(8 mmol/L),Bst DNA聚合酶0.5 μL(0.16 U/μL),10 × ThermoPol 缓冲液2.5 μL(1×),20 × Eva Green 荧光染料1.25 μL(1×),用ddH2O 补齐至25 μL 反应体系。反应程序为:65 ℃,10 s;65 ℃,1 min,设定40 个循环,同时进行信号采集;最后80 ℃,5 min 终止反应。
1.3.6 SRCA 产物测序分析
SRCA 反应产物进行凝胶电泳后,在紫外灯下自下而上选取3 条清晰条带,按照胶回收试剂盒进行切胶回收,之后进行连接、转化、纯化等操作,最后送至测序公司进行测序。
1.3.7 PMA-RF-SRCA 特异性试验
采用建立好的PMA-RF-SRCA 方法,针对6 株单增李斯特氏菌和12 株非单增李斯特氏菌分别提取模板DNA,进行特异性验证。菌株信息和结果如表2 所示。
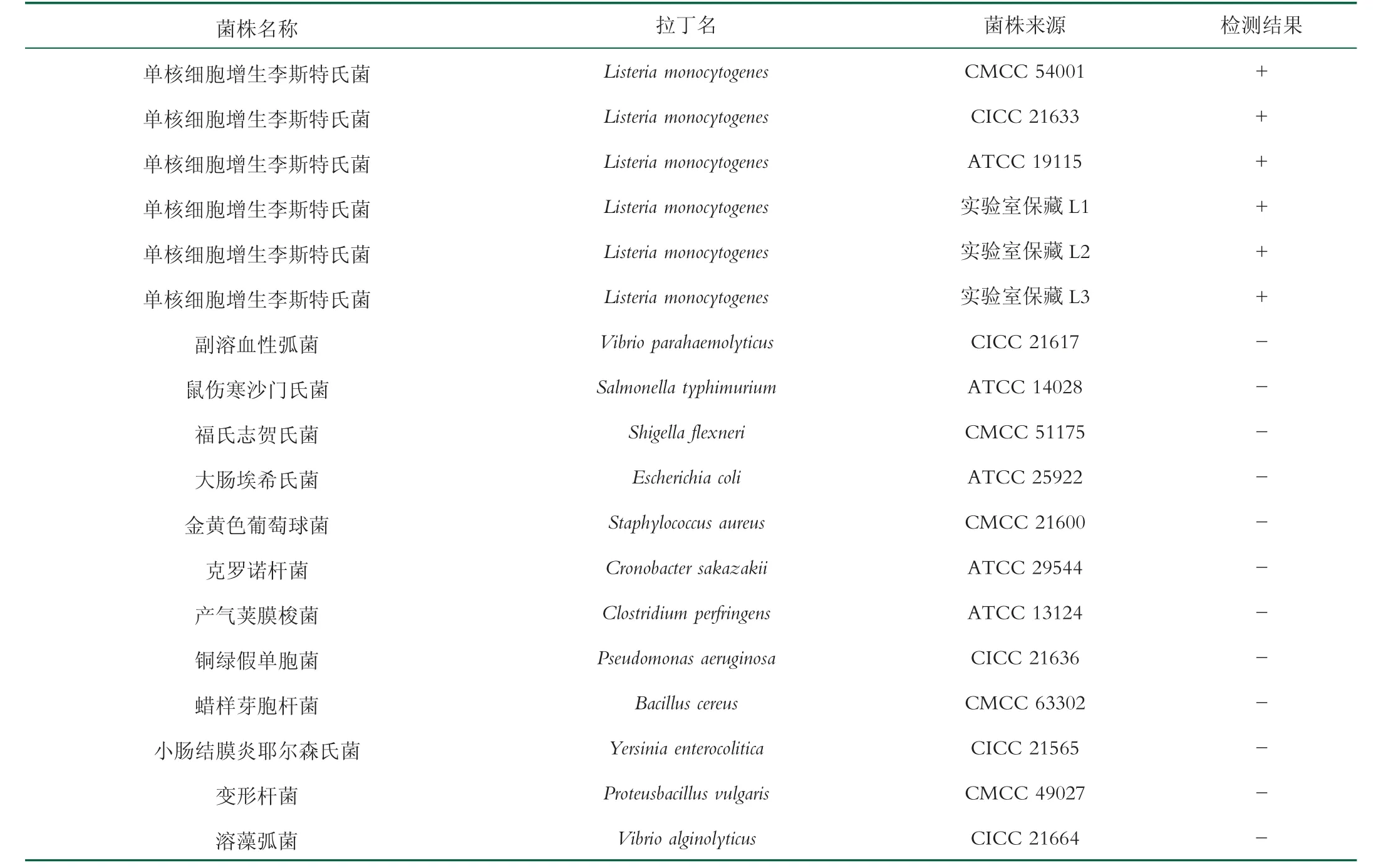
表2 本研究用到的菌种及其来源和检测结果
1.3.8 纯培养物灵敏度试验
选取单增李斯特氏菌CMCC 54001 作为标准菌株进行培养,取100 μL 菌悬液进行涂布计数,得知浓度为3.9 × 108CFU/mL,用无菌LB1 液体培养基进行10 倍梯度稀释,获得浓度为3.9×107~3.9 CFU/mL 的菌悬液。用试剂盒提取DNA 模板后进行PMA-RFSRCA 反应,通过分析实时荧光扩增曲线确定该方法的灵敏度。
1.3.9 人工污染乳检出限试验
本研究中使用纯牛奶(购自当地超市)作为加标样品,试验前先按照《GB 4789.30-2016》[20]对所用样品进行检测,以确定纯牛奶中不含单增李斯特氏菌。取上述所得已知浓度的菌悬液1 mL 分别加入24 mL 的阴性样品中,制备成1.56 × 107~1.56 CFU/mL 的人工污染样品,用试剂盒提取DNA 模板后进行PMARF-SRCA 和PMA-RF-LAMP 反应,比较两种方法的检出限。
2 结果与分析
2.1 PMA 处理条件的优化
叠氮溴化丙锭(PMA)可以穿透死菌或者膜损伤菌体的细胞膜,与DNA 结合形成稳定的复合物,致使死菌或者膜损伤菌体的DNA 无法进行扩增,只有活菌的DNA 才能进行正常的扩增,以此达到区别死菌和活菌的目的。在使用不同浓度的PMA 处理死菌后,PMA-RF-SRCA 扩增结果如图1 所示。随着PMA终浓度逐渐提高,死菌DNA 的扩增起峰时间明显增长,这充分说明PMA 与死菌的DNA 交联并抑制后续扩增反应。此外,当PMA 终浓度达到30 μmol/L时,无荧光信号。因此,本文选取30 μmol/L 为PMA处理死菌的最佳浓度。
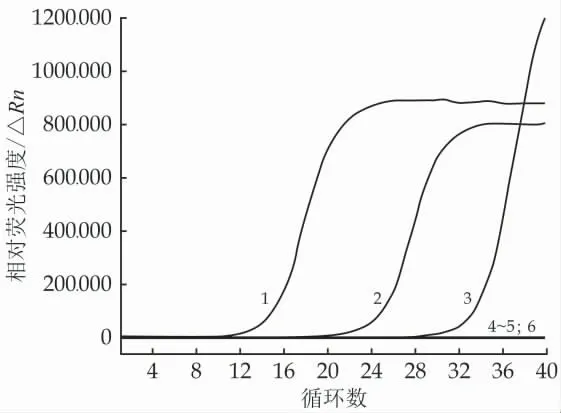
图1 PMA 工作浓度优化
2.2 PMA 暗孵育及光反应时间优化
在暗孵育时PMA 可以侵入死菌的细胞膜并与dsDNA 交联,当进行光照处理时PMA 分子中叠氮基团能够和DNA 骨架上的碳氢化合物交联形成稳定的共价结合物,从而抑制死菌DNA 的扩增反应。而残留在溶液中未结合的PMA 分子在强光照射下迅速分解成无交联活性的羟胺化合物,避免与后续提取的活菌DNA 结合,以防出现漏检[21]。
添加终浓度为30 μmol/L 的PMA 后,经过不同时间的暗孵育后,如图2 所示,结果表明:当暗孵育时间为10 min 时,未出现荧光信号,这说明10 min 的暗孵育足以使PMA 与死菌DNA 完全交联,同时不影响活菌DNA 扩增。因此,选取10 min 为PMA-RFSRCA 的最佳暗孵育时间。

图2 PMA 暗孵育时间优化
添加终浓度为30 μmol/L 的PMA,并进行10 min的暗孵育后,置于冰上进行不同时间的光反应。如图3所示,结果表明:在0~20 min 的光反应过程中死菌DNA 扩增的起峰时间显著增加,其增加趋势与光反应时间呈正相关。当光反应时间为15 min 时,PMA 对于死菌DNA 扩增的抑制效果最为明显。虽然更长的光反应时间也具有同样的抑制效果,但是基于节省时间的理念,本方法选取15 min 作为光反应的最佳时间。
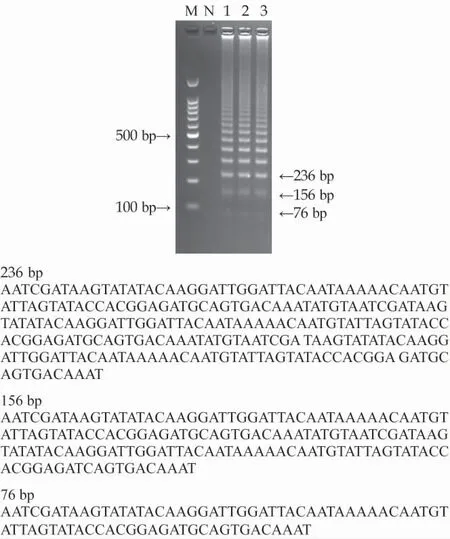
图3 PMA-RF-SRCA 扩增产物电泳及测序结果
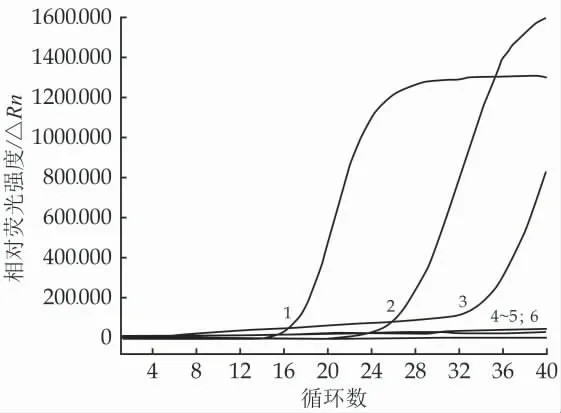
图3 PMA 光反应时间优化
2.3 PMA-RF-SRCA 扩增产物及特异性分析
PMA-RF-SRCA 的扩增产物测序结果如图4所示。从图中可以看出扩增产物呈现明显的梯形条带。自上而下第一条扩增片段长度为76 bp,第二条扩增片段包括两段76 bp 长度的目的片段以及添加片段。第三条扩增片段包括三段76 bp 长度的目的片段以及两段添加片段。这符合理论的扩增方式,因此,该方法的扩增结果正确。
特异性试验结果如表2 所示。6 株单增李斯特氏菌均为阳性结果,而12 株非单增李斯特氏菌均为阴性结果。结果表明,该引物对具有良好的特异性。
2.4 灵敏度分析
将处于指数生长期的菌悬液(菌液浓度为:3.9 ×108CFU/mL)进行10 倍系列梯度稀释后,使用试剂盒提取DNA 进行PMA-RF-SRCA 检测。由图5 得知,浓度为3.9 × 107~3.9 CFU/mL 的菌悬液均有荧光信号。因此,所建立的PMA-RF-SRCA 方法检测活菌的灵敏度为3.9 CFU/mL。

图5 PMA-RF-SRCA 方法灵敏度分析
2.5 人工污染乳的检出限分析
将加标后的牛奶按照试剂盒要求进行DNA 提取,分别进行PMA-RF-LAMP 和PMA-RF-SRCA反应。PMA-RF-SRCA 扩增结果如图6(a)所示,在1.56×107~1.56×10 CFU/mL 的范围内均能发生扩增,但是当菌液浓度降低至1.56 CFU/mL 时,未出现扩增的荧光信号,故该方法的检出限为1.56×10 CFU/mL。同样对于PMA-RF-LAMP 反应如图6(b)所示,当菌液浓度为1.56 CFU/mL 时也未出现扩增曲线,因此,PMA-RF-SRCA 方法和PMA-RF-LAMP 方法具有同样的检出限。
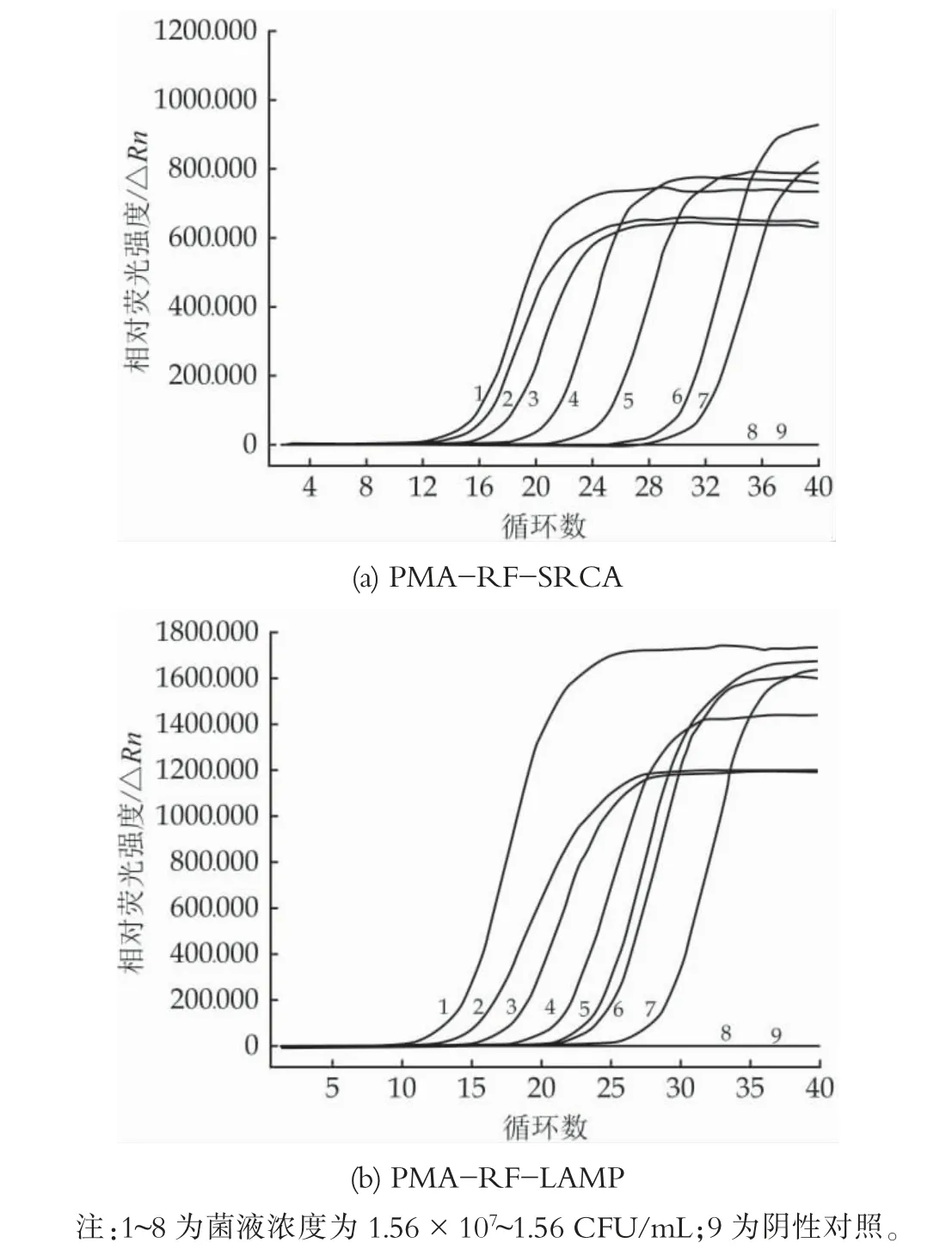
图6 检出限分析
3 结 论
本研究利用PMA 能特异区分死活菌的特性与RF-SRCA 结合,建立了一种新的检测单增李斯特氏菌活菌的方法即PMA-RF-SRCA。通过对PMA 处理条件的优化得出最佳处理方案:PMA 终浓度30 μmol/L、暗孵育10 min、光反应15 min。结果表明在此条件下该方法具有良好的区分死活菌的检测效果,引物特异性良好,纯培养物灵敏度为3.9 CFU/mL,加标样品检出限低至1.56 × 10 CFU/mL,本方法的灵敏度显著高于传统的培养方法且与行业标准中分子方法检测能力相当[22]。总之,本研究建立了一种灵敏度高、特异性强的检测食品中单增李斯特氏菌活菌的PMARF-SRCA 方法,为其他食源性致病菌的活菌检测提供了新思路,对保障食品安全具有重要的现实意义和参考价值。
