基于网络药理学探讨牛黄治疗阿尔茨海默病的作用机制
2022-08-28付新邓琦川张佳宁常惠
付新,邓琦川,张佳宁,常惠
(1. 黑龙江中医药大学,黑龙江 哈尔滨 150040;2. 黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
阿尔茨海默病(Alzheimer's disease,AD)是一种严重损害老年人健康的慢性进行性中枢神经系统退行性疾病,以渐进性记忆减退、显著性语言功能障碍、加剧性认知功能缺陷以及人格行为改变等为主要特征,最终导致重度痴呆、智力全面下降等严重症状。目前普遍认为,阿尔茨海默病在神经病理学上存在两种经权威证据证实的主要特征:β 淀粉样蛋白(β amyloid,Aβ)沉积和携带APOE e4 等位基因[1]。调查阿尔茨海默病的患病情况可以发现,患有AD 的人数随着世界人口老龄化程度的加剧而不断增加。据《世界阿尔茨海默病报告2018》估计,到2050 年,全球患阿尔茨海默病的人数将增至1.52 亿[2]。由于AD 改变了一系列分子细胞进程,其发病机制复杂,发病原因多样,目前为止尚未找到合适的治疗方案。尽管不断开发新的治疗药物,但只能减缓症状,并不能有效地治愈AD,无法改变其病理进程[3]。因此,研发预防、缓解及治疗AD 的药物具有极为重要的临床价值。
中医药具有“多活性成分-多靶点-多通路-多疾病”的治疗特点,契合AD 发病机制的复杂性和病因的多样性,以及其改变一系列分子细胞进程的特征,通过探讨两者潜在的协同效应,以此挖掘中医药同时靶向多种AD 相关靶点的优势[4]。牛黄是一种常用的中药材,始载于《神农本草经》,为牛科动物牛的干燥胆结石[5],在许多中医著作中,用于治疗与中枢神经系统相关的疾病,临床应用已有两千多年的历史。基于大量药理学及药效学研究证实,牛黄对中枢神经系统有显著作用,主要包括镇静催眠、抗惊厥、抗癫痫、抗脑损伤、保护脑血管、解热镇痛以及通过促进神经系统的生长发育和增殖分化以增强学习记忆能力的作用[6]。此外,相关药理学研究表明,牛黄可与多味中药配伍制成复方药剂,用于医治中枢神经系统类疾病,如神经重症等[7]。近年来,研究者们不断对牛黄的活性成分、作用靶点以及相关作用机制等进行研究探讨,权威研究结果显示,牛黄可能对AD 等一系列神经性疾病有良好的预防与治疗作用[8]。因此,牛黄有望成为预防及治疗AD 的生物活性药物,对其进行深入研究具有极大临床价值。
1 材料与方法
1.1 化学成分的获得、检索及主要活性成分的筛选
通过中药系统药理学基础研究数据库和专业分析平台(TCMSP),以中药牛黄为检索词,得到牛黄的全部活性成分及化学成分作用靶点,根据TCMSP 初步筛选标准,设定口服利用度(oral bioavailability,OB)≥15%,类药性(drug likeness,DL)≥0.18 为初步筛选参数,并结合已有的药理学研究收集符合条件的有效成分。此外,通过中国知识资源总库(CNKI,https://kns. cnki.net/),主题检索2015 年1 月1 日—2020 年12 月1 日文献中牛黄的化学成分。通过生物医学和健康科学信息检索系统PubMed(https://pubmed. ncbi. nlm.nih.gov/)以牛黄的化学成分为主要关键词进行检索,根据已发表的药物相关成分的文献报道,补充有效活性成分及其预测的相关靶点,并结合TCMSP 得到的相关靶点,利用Uniprot 数据库(http://www. uniprot. org)将靶蛋白转换成为基因,并剔除非人源基因。
1.2 阿尔茨海默病的相关靶点筛选
应用GeneCards 数据库、OMIM数据库、TTD数据库和DrugBank 数据库进行检索,同时为保证研究数据的科学性、准确性及全面性,以“Alzheimer's Disease”“Alzheimer disease”“Senile Dementia”“AD”等阿尔茨海默病相关名词作为检索词,分别获取AD 的核心作用靶点。利用Draw Venn Diagram 在线绘图工具平台将各个数据库基因取并集,并绘制AD 疾病基因韦恩图。
1.3 牛黄有效成分-AD疾病靶点的蛋白质-蛋白质相互作用网络构建
蛋白质相互作用网络(protein-protein interaction,PPI)是指从蛋白质分子层面深入挖掘化合物和疾病两者之间的相关性,再从基础生物化学,相关信号转导和分子遗传网络等角度构建网络以研究相关性。为更加明确阐述其靶蛋白在分子系统水平上的主要作用,将上述获得的主要靶点于STRING 11. 0 数据库在线上传,物种筛选为“智人”,同时设置靶点关联的置信度为0. 40,以获得PPI关系网络。
1.4 生物信息学注释
将牛黄核心靶点进行KEGG 主要通路分析。使用生物化学在线基因信息学功能注释专业分析工具Metascape(http://metascape. org/),以P< 0.05 为初步筛选条件,对关键靶点进行平台在线KEGG 通路富集分析,并对得到的气泡图和柱状图进行分析。
1.5 分子对接验证
在PDB 数据库中下载靶蛋白的相应3D 结构。蛋白质受体与主要配体的获取方法如下:
醛糖还原酶的三维晶体结构来源于Protein Database(PDB 代号为1US0)。中药牛黄的主要活性成分(共计3 种小分子化合物)的SDF 文件全部来源于PubChem(https://pubchem.ncbi.nlm.nih.gov/),通 过将从成分-靶点-疾病的网络药理学图中找出的3 种主要化学成分输入PubChem 中,以SDF 形式下载其3D Conformer 并保存在文件夹中,由此获得主要配体的3D 模型。阿尔茨海默病的蛋白质受体的3D 模型主要通过PDB(https://www. rcsb. org/)这一网址进行搜索,首先排除非人的靶点,再以从最好到最坏的方式将其A 值进行排列(A 值越小,蛋白质受体越好),通过下载其PDF格式,便可获得蛋白质受体不同类型的3D模型。接下来便可通过CB-Dock 软件将蛋白质受体与主要成分配体进行分子对接。
2 结果
2.1 牛黄的活性成分筛选
通过在TCMSP 数据库中检索牛黄,获取牛黄的全部化学成分共133 种。根据标准筛选条件,得到活性成分共计13 个,其中具有中强度渗透性的活性成分有3 种,不透过BBB 的活性成分有10 种。见表1。

表1 牛黄的主要活性成分

续表1
2.2 活性成分的靶点筛选结果与预测
排除各化合物对应的相同靶点后,共对应133个潜在靶点。其中11个橙红色菱形方块节点表示有对应靶点的牛黄活性成分,周围的133个蓝色圆形节点表示活性成分对应的靶蛋白,即潜在的药物靶点,边缘表示交互作用,节点的大小与程度成正比,绘制结果见图1。

图1 牛黄活性成分与对应靶点的复合目标网络
2.3 AD相关病理靶点的筛选
TTD 数据库检索得到AD 相关靶点156 个;GeneCards 数据库检索到AD 初始靶点11 207 个,以≥1.5为筛选条件得到AD 相关靶点7 214个;OMIM 数据库检索得到377 个相关结果后删除重复靶点得到AD相关靶点200个;DrugBank数据库检索得到AD相关靶点99 个。对各个基础工具检索的结果进行合并,删除重复靶点后共得到10 437 个AD 相关靶点,绘制的Venn图结果见图2。
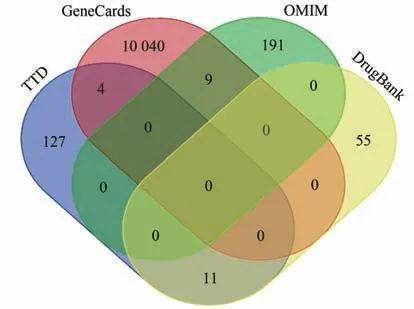
图2 筛选AD相关靶点的Venn图
2.4 牛黄活性成分-AD共同靶点的筛选及构建网络
将筛选后获取的133 个药物靶点与10 437 个疾病靶点上传至在线绘图工具平台Cytoscape,找出交集靶点共4 个,并将靶点上传至STRING 数据库以构建PPI网络。网络图显示共有23 个节点,97 条边,平均节点度为8.43,见图3。其中节点表示相关蛋白,边表示蛋白与蛋白之间的相互作用。

图3 靶标蛋白相互作用核心网络图
2.5 牛黄活性成分治疗AD关键靶标的KEGG通路富集分析结果
为了讨论牛黄对AD 作用的分子机制,我们通过KOBAS 数据库对牛黄活性成分与疾病的5 个交集基因CHRM3、CHRM1、CCND2、MTTP、BCL2进行了KEGG 富集通路分析。选择每个聚类富集率最高且P值< 0. 05 的5 条通路,并将得到的通路进行可视化,见图4、表2。图中纵坐标表示KEGG 富集所得的通路,横坐标表示负的P值的对数。

图4 富集分析通路图
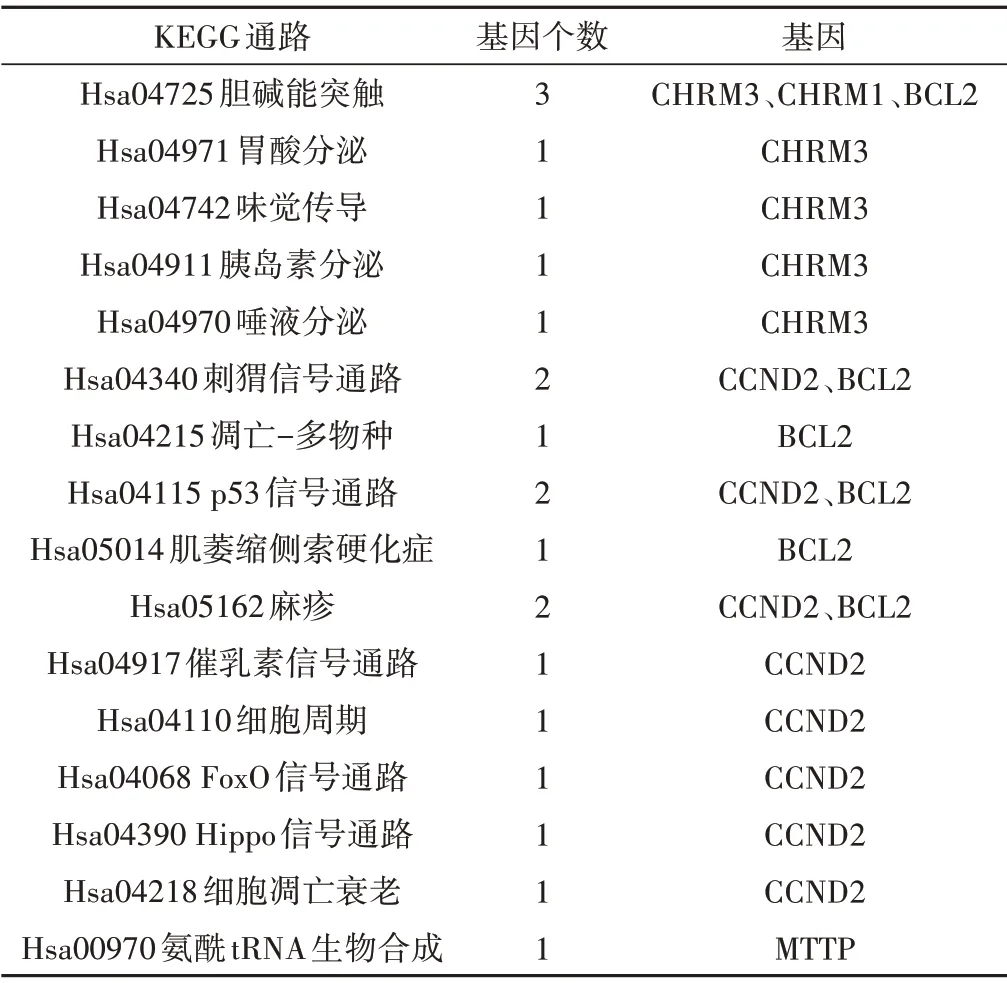
表2 5个交集基因的KEGG通路富集结果
分析富集结果显示,其可能生物学进程主要包括氧化应激、细胞凋亡[9]、线粒体动态变化分裂与融合[10]、癌症坏死因子、炎症介质、神经生长因子[11]、神经元调节体内能量平衡[12]等;信号通路主要为胆碱能突触、胃酸分泌、唾液分泌、凋亡-多物种、p53 信号通路、肌萎缩性侧索硬化症、催乳激素信号通路、FoxO 信号通路、细胞衰老等,以上富集分析数据显示,牛黄的主要成分可能通过作用于神经系统相关的信号通路,如含血清素的胆碱能神经突触等,还对凋亡-multiple specesp53 信号通路、肌萎缩性侧索硬化症、催乳激素信号通路、FoxO 信号通路、唾液分泌通、胃酸分泌等进行调控,从而发挥治疗AD 的潜在作用。信号通路的显著性通过展示图中气泡的大小来表示,气泡越大代表富集该通路的基因越多,说明该通路在牛黄发挥治疗AD 的作用中越重要。该结论研究初步揭示牛黄神经作用的关键靶点及涉及的信号通路,为进一步研究其AD 作用机制提供参考和依据。
2.6 活性成分-疾病交集基因与通路的网络互作图
橙色的5 个节点表示牛黄活性成分与疾病交集基因;外面的圆圈为基因对应的通路;有深蓝色圈的通路表示P值<0.05且选择每个聚类富集率最高的5条的通路。见图5。

图5 活性成分-疾病交集基因与通路的网络互作图
2.7 分子对接
2.7.1 牛黄活性成分与AD 所对应的靶蛋白的交集——受体
2004 年发表于PubMed 的超高分辨率药物设计关于人醛糖还原酶抑制剂复合物首次提出了一个36 kDa蛋白质的亚原子分辨结构[13],即醛糖还原酶(P 代号1S0)。其分辨度为0.66Å,该模型总体上非常有序,此外,这个蛋白模型和电子密度详细显示了较多细微特征,例如氢原子、键密度和标砖立体化学的显著偏差等。同时,该模型的氢键网络、多重构想以及溶剂结构也有相对完善的定义。更为重要的是该模型的活性中心区域的大部分原子具有极好的有序性,以此可以确定与催化作用有关的残基的质子化状态。以人模型结构1US0 为蛋白受体对牛黄主要成分及其主要活性小分子进行分子对接,可为研究中药牛黄对阿尔茨海默病的作用机制提供一些参考,故分子对接选用1US0作为受体。
2.7.2 牛黄活性成分——配体
牛黄为牛科动物牛的干燥胆结石,通过对2020 版《中华人民共和国药典》和TCMSP 数据库内容进行整合,得出其主要成分为oleanolic acid、ergosterol、ursolic acid、methyl(4R)-4-[(3R,5S,7S,8R,9S,10S,12S,13R,14S,17R)-3,7,12-trihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1H-cyclopenta[a]phenanthren-17-yl]pentanoate、Methyl desoxycholate、chenodeoxycholic acid、Cherianoi、methyl(4R)-4-[(3R,5S,7R,8R,9S,10S,13R,14S,17R)-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1H-cyclopenta[a]phenanthren-17-yl]pentanoate、Deoxycholic Acid、ZINC01280365 和CLR这11 种[5],其中能与阿尔茨海默病受体进行分子对接的活性成分只有Cherianoine、ursolic acid、chenodeoxycholic acid 这3种。
2.7.3 关键靶点的分子对接结果
根据成分-疾病-通路网络的结果,确定关键靶点为 Muscarinic acetylcholine receptor M1、Prostaglandin G/H synthase 2、Neuronal acetylcholine receptor protein,alpha-7 chain、Carboxylesterase 2;关键成分为Cherianoine、ursolic acid、chenodeoxycholic acid。经PDB数据库对四种关键靶点中的蛋白质从好到坏进行分析提取,发现能够与活性成分进行分子对接的蛋白质活性成分均为aldose reductase(醛糖还原酶)。利用CB-Dock软件对关键靶点中的活性蛋白和关键成分的相互作用进行分子对接预测,见图6。CB-Dock 会对每一种预测模型进行vina值打分,vina值表明化合物与蛋白质之间具有一定的结合活性,vina值越负,表明该化合物与蛋白质的结合越稳定。经软件对接得出关键靶点蛋白aldose reductase与关键成分的相互作用vina值分别为−6.1、−9、−9、−6.4、−6.4、−9,均≤−6.4,表明aldose reductase 与Cherianoine、ursolic acid、chenodeoxycholic acid之间均有较强的结合能力,其中aldose reductase 与ursolic acid、chenodeoxycholic acid 的vina 值均为−9,表明它们的结合能力最强。牛黄极有可能是通过其中的活性成分ursolic acid和chenodeoxycholic acid 作用于人体阿尔茨海默病靶点中的aldose reductase结构从而发挥治疗阿尔茨海默病的作用的。

图6 分子对接结果示意图
3 分析与讨论
中医古籍中没有阿尔茨海默病的名称记载,可被定义为“痴呆”“呆病”“健忘”等,明代张景岳《景岳全书·杂证谟》中最早提出“痴呆”病名。其发病机制是五脏虚损为本,痰浊、瘀血邪实蒙蔽清窍为标[14]。牛黄具有清心、化痰、利胆、镇惊的作用。本研究主要通过网络药理学和分子生物学相互结合的方法,初步研究探讨牛黄治疗AD的可能作用靶点及机制,具体见图7。
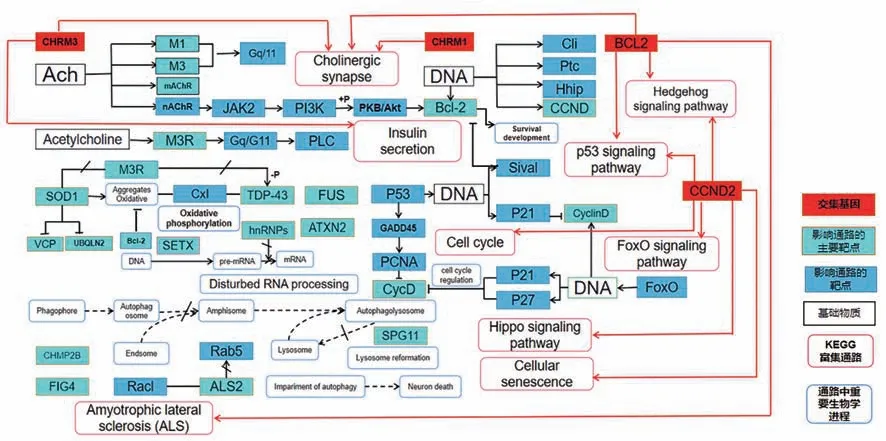
图7 网络药理学联合代谢组学构建的靶点-基因-通路图
3.1 潜在有效成分分析
3.1.1 熊果酸
有研究显示,熊果酸作用于阿尔茨海默病模型后,Aβ25-35处理的细胞存活率水平显著升高,细胞凋亡率水平降低,Cleaved Caspase-3 蛋白表达能力下降,MDA、ROS 水平降低,SOD 活性提升,SNHG14表达降低,miR-105表达升高(P< 0.05),而SNHG14 过表达或干扰miR-105 表达可降低熊果酸对Aβ25-35诱导的PC12 细胞起到保护作用。因此,熊果酸可能通过调控SNHG14/miR-105 分子轴从而抑制Aβ25-35诱导的PC12 细胞凋亡,并减轻细胞氧化损伤,从而起到对阿尔茨海默病的预防作用[15]。
3.1.2 鹅去氧胆酸
通过查阅文献,鹅去氧胆酸具有对抗DEX 诱导的小鼠巨噬细胞系RAW264.7 凋亡作用,且与上调凋亡抑制蛋白mRNA 表达有关[16]。还可显著抑制LPS 诱导的细胞炎症反应,其机制可能与激活TGR5、抑制Akt/NF-κB 信号通路有关[17]。这些作用均可直接对阿尔茨海默病的抑制产生影响,从而极大地降低发病率。
3.2 潜在靶点分析
3.2.1 毒蕈碱型乙酰胆碱受体M1
毒蕈碱型乙酰胆碱受体(M 受体)亚型M1 受体(M1R)在脑内的分布量极大,且在海马和大脑皮层中高度表达,发挥着举足轻重的促进学习记忆的作用,激活M1R 可增强长时间电位(long-time potentiation,LTP)并诱导神经元树突棘头部丝状伪足的形成,从而改善神经突触可塑性[18]。通过对突触可塑性和学习记忆促进作用进行探索,可能为阿尔茨海默病等认知功能障碍疾病的研究和治疗提供新的思路和可能的新靶点。
3.2.2 前列腺素G/H合酶
白细胞介素-1在传递信息,激活与调节免疫细胞,介导T细胞和B细胞的活化、增殖与分化及在炎症反应中至关重要,它的作用可能部分通过前列腺素介导。前列腺素G/H合酶(PGHS)是合成前列腺素的关键酶[19],其可能间接对细胞的凋亡和炎症反应起重要作用。
3.2.3 α7烟碱型乙酰胆碱受体
在探究激活α7 烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAchR)对大脑皮质神经元氧糖剥夺损伤的作用及可能机制后发现,与氧糖剥夺组相比,PNU-282987可提高大脑皮质神经元的存活率、降低LDH的含量、抑制大脑神经元细胞凋亡、降低ROS产量(P< 0.05),同时使HO-1 蛋白的表达显著升高、HIF-1α蛋白表达显著减少(P<0.05)[20]。这些结果均表明激活α7烟碱型乙酰胆碱受体具有抗大脑皮质神经元氧糖剥夺损伤作用,该作用可能与抗氧化应激有关,进而对阿尔茨海默病的发生起到一定的调节作用。
3.2.4 羧酸酯酶2
羧酸酯酶(CES)是一类药物代谢I相酶,属丝氨酸水解酶家族,广泛分布于哺乳动物体内,是大部分前药代谢活化过程中的一个关键性酶类。近年来有研究发现肥胖、糖尿病患者CES2 表达水平显著升高,说明糖尿病和羧酸酯酶2 之间存在某种关联[21],而决定糖尿病是否发生的关键性因素——胰岛素,和阿尔茨海默病也有着千丝万缕的关系。因此,可推断羧酸酯酶2和阿尔茨海默病之间可能存在着某些关联。
3.3 生物富集分析
为了讨论牛黄对AD 作用的分子机制,笔者通过KOBAS 数据库对牛黄活性成分与疾病的交集基因CHRM3、CHRM1、CCND2、MTTP 和BCL2 共5 个基因进行了KEGG 富集通路分析。在给定路径中观察至少m个疾病相关基因的P值可按照公式1 进行计算,其中m是疾病相关基因数,M是与给定疾病相关的基因总数,N是已经科学验证的基因数量,n是通路中的基因数量[22]。P值越小,表示与疾病相关的基因列表在这一途径中的比例越高,一般认为相关通路的统计显著性阈值为P<0.05 即可表示否定无效,假设的两组差别有显著意义。
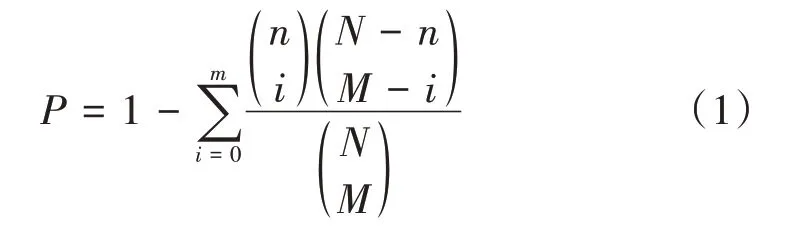
因此,笔者在不同的集群中均选取P<0.05 的数据进行分析,其中每个集群仅显示富集率最高的5 条通路,最终共得到16 条通路,分别为胆碱能突触[hsa04725]、胃酸分泌[hsa04971]、味觉传导[hsa04742]、胰岛素分泌[hsa04911]、唾液分泌[hsa04970]、刺猬信号通路[hsa04340]、凋亡-多物种[hsa04215]、p53 信号通路[hsa04115]、肌萎缩侧索硬化症(ALS)[hsa05014]、麻疹[hsa05162]、催乳素信号通路[hsa04917]、细胞周期[hsa04110]、FoxO 信号通路[hsa04068]、Hippo 信号通路[hsa04390]、细胞凋亡衰老[hsa04218]及氨酰tRNA 生物合成[hsa00970]。笔者通过参考各种文献,确定了目前已经证实的和阿尔茨海默病相关的通路共10 条,分别为胆碱能突触、胰岛素分泌、刺猬信号通路、p53 信号通路、肌萎缩侧索硬化症、细胞周期、FoxO 信号通路、Hippo信号通路、细胞凋亡衰老和氨酰tRNA生物合成。
3.3.1 胆碱能突触
阿尔茨海默病是最常见的年龄相关神经退行性疾病。其特征是出现β-淀粉样蛋白(Aβ)斑块和神经元纤维缠结积聚,这最终会导致基底前脑胆碱能神经元的减少[23]。胆碱能突触在人类中枢神经系统中普遍存在,它们在丘脑、纹状体、边缘系统和新皮质的高密度表明胆碱能传递可能在学习记忆、注意力和其他高级脑功能等方面发挥着中流砥柱的作用。而胆碱酯酶抑制剂可显著增加乙酰胆碱在大脑中的有效含量,是临床上证明可用于治疗阿尔茨海默病的少数药物疗法之一,可见胆碱能系统是该病的重要治疗靶点[24]。
3.3.2 胰岛素分泌
越来越多的证据表明阿尔茨海默病、葡萄糖代谢、胰岛素活性和记忆之间存在潜在的联系。微管相关蛋白tau(MAPT)主要是微管动力学和组装以及神经突起生长所必需的微管蛋白结合蛋白。而胰岛素信号对突触可塑性和记忆形成非常重要,因此可推断其对正常的大脑功能至关重要[25]。最近,tau 被认为是胰岛素信号的重要调节者,有证据表明tau与大脑和外周胰岛素抵抗以及β细胞功能障碍有关。反过来说,胰岛素抵抗也会导致tau 功能障碍,出现身体功能的恶性循环[26]。也有实验研究表明,在AD 患者中,胰岛素抵抗与血浆胰岛素水平升高和第一时相胰岛素分泌降低可能与AD的发生有关[27]。因此,可得出阿尔茨海默病的发生和胰岛素分泌这条通路密切相关这一结论。
3.3.3 刺猬信号通路
已有实验证明了PN-1 可通过阻断刺猬信号通路,减少海马神经元凋亡,提高空间学习记忆能力,从而对AD 起到保护作用。刺猬信号通路可通过机体的一些途径导致阿尔茨海默病的产生,深入研究这条通路可对阿尔茨海默病的治疗起到一定作用[28]。
3.3.4 p53信号通路
TREM2 突变可引起神经退行性疾病,可初步判断其与阿尔茨海默病风险增加相关。通过体外诱变等报告分析,证实了TREM2 启动子中存在p53 RE。此外,CHIR-98014 这种特异性抑制剂,可强烈抑制p53 激活TREM2 和酪氨酸bp。由此可得出:TREM2 是一个直接的p53 靶基因,阿尔茨海默病的抑制可通过作用于p53通路的TREM2进而进行调节[29]。
3.3.5 肌萎缩侧索硬化症
细胞因子介导的炎症在阿尔茨海默病(AD)和肌萎缩侧索硬化症(ALS)等神经退行性疾病的发生和发展中起着重要作用。通过建立发现的某些细胞因子与神经退行性疾病之间的联系,可推断脑脊液炎性细胞因子可能在未来被用作这些疾病的生物标志物[30]。肌萎缩侧索硬化症的病因——细胞因子介导的炎症,可能间接对阿尔茨海默病的发生起到一定的推动作用。
3.3.6 细胞周期
通过异常的细胞周期再发生,以及慢性氧化损伤阻止细胞凋亡,神经元获得了类似于肿瘤细胞的“永生”,即会在整个脑组织中形成并产生老年斑和神经纤维缠结[31]。新证据表明,异常的细胞周期重入可能在β 诱导的神经元死亡中起着核心作用。一些信号介质,如Id1、缺氧诱导因子-1(HIF-1)、细胞周期蛋白依赖性激酶-5(CDK5)和音速刺猬信号通路(Shh),可能有助于有丝分裂后神经元中β 诱导的细胞周期重入。此外,Id1 和CDK5/p25 能够相互拮抗对方的活性[32]。因此,Id 蛋白可能通过调节细胞周期在AD 的防治中发挥潜在的临床应用,即细胞周期对阿尔茨海默病的产生有一定的调节作用。
3.3.7 FoxO信号通路
氧化应激是阿尔茨海默病发病的一个重要决定因素,氧化应激可能促进FoxO 蛋白的转录活性,导致高血糖和活性氧(ROS)的进一步增加,即FoxO 蛋白可能为AD的治疗提供潜在的分子靶点[33]。
3.3.8 Hippo信号通路
AD 的根本原因之一是产生疏水性淀粉样β42(Aβ42)肽,这些肽聚集形成淀粉样斑块。这些斑块诱导氧化应激和异常信号,导致神经元死亡和其他与神经退行性变相关的病理过程。通过查阅文献可知,Hippo 通路在对抗Aβ 诱导的小胶质细胞炎症反应中起着关键作用,靶向Hippo 信号可能是治疗AD 的有前景的治疗方法[34-35]。
3.3.9 衰老细胞凋亡
衰老是痴呆相关神经退行性变的主要风险因素,在持续的压力下,大部分细胞均可导致慢性衰老,其特征是促炎症分子的分泌,促进组织和器官的功能衰退。切除衰老细胞被认为是一种有希望的治疗手段,可以针对衰老表型,预防或减轻与衰老相关的疾病,即有可能成为治疗阿尔茨海默病的新兴手段[36]。
3.3.10 氨酰tRNA生物合成
一些标记神经退行性病变的蛋白质,如tau缺乏色氨酸。TrpRS 以细胞质(WARS)和线粒体(WARS2)形式存在,这两种形式的致病基因变体导致TrpRS 缺乏,从而导致人类智力和运动障碍。AD 患者色氨酸依赖性蛋白质生物合成的减少证明了基于模型的疾病概念,即色氨酸tRNA 合成酶缺乏极有可能导致阿尔茨海默病[37]。
4 结论与展望
网络药理学能够反映和阐明药物化学成分-多个靶点-多种疾病之间的相互关系,并根据这种三通路关系建立网络药理学模型,从系统的角度说明中药牛黄对人体生物网络的作用,这个构建体系与中医药多组分、多靶点、多途径的治疗方法不谋而合。但是,单纯用传统的试验方法来检测某种中药的精确作用机制相对困难。
本篇研究通过对牛黄活性成分靶点和阿尔茨海默病的靶点进行收集和作图,得到两个对疾病有一定作用的活性成分靶点,这两个靶点指向同一活性成分,表明牛黄通过这个成分治疗阿尔茨海默病。
以前对药物的研发主要遵循“一个药物对应一个基因进而治疗一种疾病”这种一一对应的模式,这是导致绝大多数新药在临床试验中失败的主要原因。实际上,临床上的多种慢性病如阿尔茨海默病、糖尿病、心脑血管疾病等都是多基因、多因素、多靶点共同作用的结果,仅根据单一作用靶点很难将机体各方面进行调节,从而达到良好治疗的效果。基于网络药理学形成药物-成分-疾病靶点-疾病的新模式,是发展创新药物的重要途径。
随着网络药理学的诞生,我们便可借助于现代化软件技术将药物研发模式进行研究与改进,逐渐转变常规的研发理念,从多靶点与复杂疾病交互成网这一角度,通过计算机来模拟构建药物与疾病的网络关系图,增强研究前的筛选数据范围,形成一种新型的药物研发模式,以此通过该模式研制的药物治疗更多疾病。
本研究主要通过各个数据库挖掘中药牛黄的活性成分和作用靶点以及疾病AD 的关键作用基因,应用网络药理学和分子生物学的研究方法从分子水平为中药研究提供了相对科学可行的理论研究。
