基于PI3K/Akt信号通路探讨黄芩苷调节复发性流产小鼠子宫母胎界面免疫状态的影响
2022-08-28钱秋然王杰平张艳荣张圆圆
钱秋然,王杰平,张艳荣,张圆圆
(河南大学第一附属医院,河南 开封 475000)
复发性流产(recurrent spontaneous abortion,RSA)是妊娠期最常见的病症之一,主要指与同一性伴侣连续2 次及2 次以上在妊娠前20 周发生自然流产的现象[1]。RSA 的发生率约占育龄妇女的2%~5%[2],主要与生殖道感染、内分泌紊乱、生殖免疫异常等因素紧密相关[3],严重影响妇女的身心健康和家庭生活。《神农本草经》中记载,黄芩具有清热安胎的作用[4]。黄芩不仅在诸多沿用至今的安胎方剂中频繁使用,临床实践也证实了其有效成分黄芩苷的安胎效果。现代药理研究发现,黄芩苷具有抗炎、抗氧化、抗癌和促进T 细胞增殖等免疫调节的特性[5]。因此,本研究通过建立RSA 小鼠模型,探讨黄芩苷对RSA 小鼠子宫母胎界面免疫的影响,为黄芩苷临床治疗RSA提供理论支持。
1 材料与方法
1.1 实验动物
SPF 级雌性CBA/J 小鼠80 只,体质量20~22 g,6 周 龄,未产;雄性DBA/2 小鼠32 只、BALB/C 小鼠8 只,6 周龄,体质量20~22 g。购自武汉生物制品研究所有限责任公司,许可证号:SCXK(鄂)2017-0013,室温常规饲养,自由采食饮水。
1.2 药物、主要试剂和仪器
黄芩苷(纯度:99%,陕西帕尼尔生物科技有限公司);白介素-10(interleukin-10,IL-10)、白介素-4(interleukin-4,IL-4)、γ干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(美国R&D 公司);BCA 蛋白定量分析试剂盒(美国Thermo Fisher Scientific 公司);鼠抗人磷脂酰肌醇3-激酶(Phosphoinositide 3-kinase,PI3K)抗体、丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)抗体、p-Akt 抗体(美国Cell Signaling Technology 公司);CD3、CD4、CD8 抗 体(美 国Thermo Fisher Scientific公司)。
RM2235 徕卡切片机(德国徕卡显微系统贸易公司);PowerPac 电泳仪(美国BIO-RAD 公司);iBright CL750成像系统(美国赛默飞世尔科技公司)。
1.3 动物模型制备
小鼠适应环境1 周后,采用阴道涂片法观察母鼠发情情况。将发情的CBA/J雌鼠和DBA/2雄鼠(2∶1)合笼交配,制备RSA 模型;发情的CBA/J 雌鼠和BALB/C雄鼠(2∶1)合笼交配,制备正常妊娠模型[6]。合笼次日对雌鼠进行阴道涂片,将雌鼠有阴栓脱落,阴道涂片显微镜观察存在大量精子作为妊娠第1天[7]。
1.4 分组及干预
将RSA模型小鼠随机分为模型组、黄芩苷低剂量组(给药剂量为25 mg/kg)、黄芩苷中剂量组(给药剂量为50 mg/kg)、黄芩苷高剂量组(给药剂量为100 mg/kg)[8],正常妊娠模型为对照组,每组16 只。黄芩苷各剂量组按5 mL/kg液体量配制相应剂量黄芩苷生理盐水药液并灌胃,对照组和模型组灌胃等体积的生理盐水,每日灌胃1次,连续14 d。
1.5 指标观察
1.5.1 流产率和胚胎丢失率
末次给药5 h 后,准确称取各组小鼠体质量,以30 mg/kg 戊巴比妥腹腔注射麻醉小鼠,剖开腹部,观察子宫并记录胚胎着床数目和吸收数目,计算流产率和胚胎丢失率。
流产率(%)=流产小鼠数/实验小鼠总数×100%
胚胎丢失率(%)= 丢失胚胎数/(丢失胚胎数+存活胚胎数)×100%
1.5.2 组织学观察
各组分别取8 只小鼠分离的蜕膜组织,放置于10%中性甲醛中固定48 h,酒精脱水,石蜡包埋,制作4 μm 的连续切片,进行常规HE染色,中性树胶封片后显微镜下观察。
1.5.3 子宫组织CD4+、CD8+T淋巴细胞检测
取各组剩余8 只小鼠子宫组织研磨,取一部分经Ⅳ型胶原酶消化过滤,制成细胞密度为5×106个/mL的悬液,取100 μL 单细胞悬液加入CD3、CD4、CD8 一抗,室温染色30 min,PBS 清洗10 min,重复2 次,经离心后弃上清,加500 μL PBS混匀,流式细胞仪上样检测。
1.5.4 子宫组织IL-10、IL-4、IFN-γ 和TNF-α水平
取“1.5.3”项下的研磨子宫组织50 mg,加入1 mL含6倍量0.75 μg/mg的蛋白酶抑制剂的PBS进行匀浆,匀浆液于离心机10 000 r/min 离心10 min,取上清,按照ELISA 试剂盒说明书进行检测,酶标仪测定450 nm处OD 值,根据样品OD 值计算样品IL-10、IL-4、IFN-γ和TNF-α的浓度水平。
1.5.5 子宫组织PI3K、p-Akt蛋白表达水平
取子宫组织100 mg置于1.5 mL规格的无酶EP 管中,加入0.6 mL RIPA 试剂后充分剪碎,使用组织匀浆机匀浆,摇匀、静置5 min,重复3 次,于高速低温离心机13 000 r/mim 离心10 min(4 ℃),取上清液进行BCA蛋白定量,取20 μg 样本与20 μg 上样缓冲液混匀后进行SDS-PAGE 电泳,100 V 电转30 min,转至聚偏二氟乙烯膜,加入5%脱脂奶粉室温封闭2 h,加入稀释1∶1 000 的PI3K、Akt、p-Akt、β-actin 一抗,4 ℃摇床孵育过夜,TBST 洗膜10 min 2 次,加入稀释1∶5 000 的二抗室温孵育1 h,TBST 洗膜10 min 2 次,ECL 显色,Image J 软件分析,以目的蛋白条带/β-actin 内参灰度值比值表示目的蛋白相对表达水平。
1.6 统计学分析
采用软件SPSS 24.0 分析处理数据。计数资料组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,多样本计量资料比较采用单因素方差分析,两组间比较采用LSD-t检验。以P< 0.05 代表差异具有统计学意义。
2 结果
2.1 各组小鼠流产率和胚胎丢失率比较
与对照组比较,模型组小鼠流产率和胚胎丢失率均显著升高(P<0.05);与模型组比较,黄芩苷各剂量组流产率和胚胎丢失率均显著降低(P<0.05)。流产率和胚胎丢失率与黄芩苷呈剂量依赖性降低(P<0.001)。见表1。
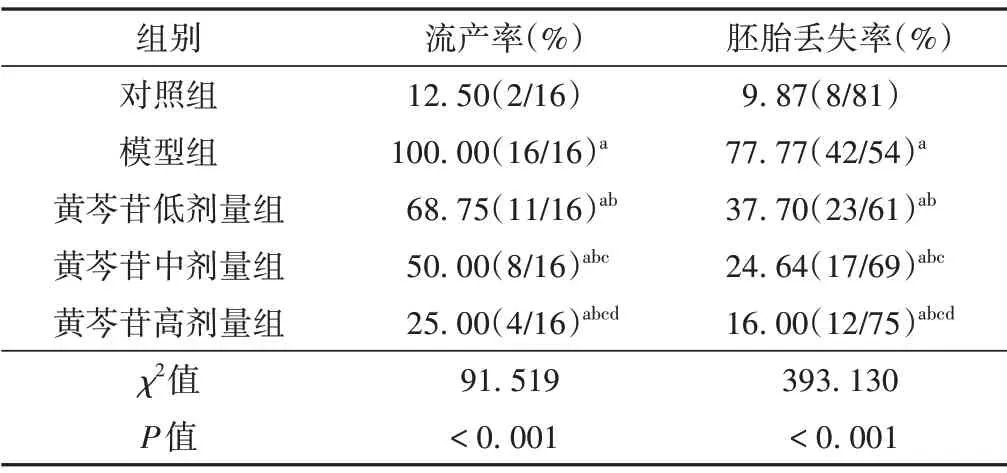
表1 各组小鼠流产率和胚胎丢失率比较(n=16)
2.2 各组小鼠子宫蜕膜组织情况比较
对照组小鼠蜕膜组织细胞排列整齐,细胞界限分明,血管丰富。模型组小鼠子宫内膜蜕膜样变,细胞排列紊乱,部分蜕膜细胞坏死,间质水肿,间质血管数量减少,血管减少,炎性细胞明显可见。黄芩苷各剂量组蜕膜组织细胞形态明显改善,间质细胞排列规则,间质水肿减少、血管数量增多,趋向对照组,且蜕膜组织细胞形态改善情况与黄芩苷剂量呈正相关。见图1。

图1 子宫蜕膜组织HE染色图(×400)
2.3 各组小鼠子宫组织CD4+、CD8+ T 淋巴细胞水平比较
与对照组比较,模型组小鼠CD4+T 淋巴细胞比例及CD4+/CD8+降低,CD8+T 淋巴细胞比例升高(P< 0. 05);与模型组比较,黄芩苷各剂量组CD4+T 淋巴细胞比例及CD4+/CD8+升 高,CD8+T 淋巴细胞比例降低(P< 0. 05)。CD4+T 淋巴细胞比例、CD4+/CD8+与黄芩苷呈剂量依赖性升高,CD8+T淋巴细胞比例与黄芩苷呈剂量依赖性降低(P<0. 001)。见表2。
表2 子宫组织CD4+、CD8+T淋巴细胞水平比较(±s,n=8)

表2 子宫组织CD4+、CD8+T淋巴细胞水平比较(±s,n=8)
注:与对照组比较,aP < 0.05;与模型组比较,bP < 0.05;与黄芩苷低剂量组比较,cP<0.05;与黄芩苷中剂量组比较,dP<0.05。
组别对照组模型组黄芩苷低剂量组黄芩苷中剂量组黄芩苷高剂量组F值P值CD4+T淋巴细胞(%)32.16±3.45 15.24±2.91a 19.35±2.76ab 24.47±3.14abc 29.18±2.17abcd 45.109<0.001 CD8+T淋巴细胞(%)12.46±2.48 27.17±3.11a 23.36±2.78ab 19.64±2.18abc 14.69±1.94abcd 45.667<0.001 CD4+/CD8+2.66±0.38 0.52±0.21a 0.83±0.19ab 1.26±0.27abc 1.97±0.24abcd 85.043<0.001
2.4 各组小鼠子宫组织IL-10、IL-4、IFN-γ 和TNF-α水平比较
与对照组比较,模型组小鼠子宫组织中TNF-α、IFN-γ 水平显著升高,IL-4、IL-10 水平显著降低(P<0.05);与模型组比较,黄芩苷各剂量组TNF-α、IFN-γ 水平显著降低,IL-4、IL-10 水平显著升高(P<0.05)。TNF-α、IFN-γ 水平与黄芩苷呈剂量依赖性降低,IL-4、IL-10 水平与黄芩苷呈剂量依赖性升高(P<0.001)。见表3。
表3 子宫组织IL-10、IL-4、IFN-γ和TNF-α水平比较(±s,μg/L,n=8)

表3 子宫组织IL-10、IL-4、IFN-γ和TNF-α水平比较(±s,μg/L,n=8)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄芩苷低剂量组比较,cP<0.05;与黄芩苷中剂量组比较,dP<0.05。
组别对照组模型组黄芩苷低剂量组黄芩苷中剂量组黄芩苷高剂量组F值P值TNF-α 18.32±4.45 87.64±5.76a 64.41±6.13ab 51.28±4.71abc 29.54±4.36abcd 231.347<0.001 IFN-γ 34.46±4.31 93.26±5.16a 82.74±5.31ab 64.27±5.89abc 42.94±5.23abcd 186.238<0.001 IL-4 104.25±8.13 43.55±6.37a 59.14±6.48ab 72.33±6.23abc 91.46±8.22abcd 92.949<0.001 IL-10 62.12±4.41 31.25±3.78a 39.11±3.91ab 45.36±4.32abc 57.46±4.97abcd 70.465<0.001
2.5 各组小鼠子宫组织PI3K、p-Akt 蛋白表达情况比较
与对照组比较,模型组小鼠PI3K、p-Akt 蛋白表达均显著降低(P<0.05);与模型组比较,黄芩苷各剂量组PI3K、p-Akt 蛋白表达均显著升高(P< 0.05)。PI3K、p-Akt 蛋白表达与黄芩苷呈剂量依赖性升高(P<0.001)。见表4、图2。
表4 各组小鼠PI3K、p-Akt蛋白比较(±s,n=8)

表4 各组小鼠PI3K、p-Akt蛋白比较(±s,n=8)
注:与对照组比较,aP < 0.05;与模型组比较,bP < 0.05;与黄芩苷低剂量组比较,cP<0.05;与黄芩苷中剂量组比较,dP<0.05。
组别对照组模型组黄芩苷低剂量组黄芩苷中剂量组黄芩苷高剂量组F值P值PI3K 0.92±0.08 0.41±0.06a 0.53±0.07ab 0.71±0.06abc 0.83±0.08abcd 70.843<0.001 p-Akt/Akt 0.84±0.07 0.35±0.05a 0.48±0.06ab 0.59±0.07abc 0.72±0.05abcd 80.935<0.001

图2 子宫组织PI3K、p-Akt蛋白检测
3 讨论
RSA 是一个多因素疾病[9],目前关于RSA 的分析研究主要集中在免疫和炎症相关方面,并认为RSA 和免疫机制之间存在重要联系[10-11]。RSA 属“滑胎”范畴,肾为胎元稳固之本,治疗滑胎应以养阴清热、补肾固胎为主。黄芩自古便被用来治疗胎动和流产,黄芩苷是其主要有效成分,研究证实不论是中药黄芩还是单体黄芩苷的形式均具有显著的保胎作用[12]。近年来有许多关于黄芩苷的研究,但对其治疗RSA 的研究鲜有所见。因此,本研究通过建立RSA 小鼠模型,探究黄芩苷对RSA小鼠的作用机制。
本研究中,黄芩苷各剂量组小鼠流产率和胚胎丢失率较模型组降低,提示黄芩苷可促进RSA 小鼠胚胎健康生长,有较明显的保胎效用。母胎界面免疫微环境为胚胎提供稳定健康的生长环境,在妊娠胚胎生长发育维持以及临产的发动过程中起着重要作用。CD4+、CD8+T 淋巴细胞是调节母胎免疫耐受状态细胞群中的两种重要亚群[13]。CD4+T 淋巴细胞发挥免疫效应即增强母体对胚胎的免疫毒性,CD8+T 淋巴细胞发挥负调节作用即母体免疫产生耐受行为,CD4+/CD8+T比例异常,免疫耐受失衡会导致RSA 的发生[14]。CD4+T 细胞受到抗原刺激分化为Th0 细胞,后因不同细胞因子刺激分化为不同生物学作用的Th1、Th2、Th17和Treg细胞[15]。Th1型细胞分泌TNF-α、IFN-γ等因子[16],对正常妊娠有副作用;Th2 型细胞则分泌IL-4、IL-10等因子[17],对正常妊娠有促进作用。研究表明母胎界面中Th1/Th2 细胞因子平衡异常与RSA 的形成有关[18-19]。本研究中黄芩苷各剂量组小鼠CD4+T淋巴细胞、IL-4、IL-10 水平较模型组升高,CD8+T 淋巴细胞、CD4+/CD8+、TNF-α、IFN-γ 水平较模型组降低,提示黄芩苷有助于维持免疫耐受状态,抑制Th1细胞分泌攻击型因子,促进Th2 细胞分泌保护性细胞因子,维持Th1/Th2平衡,促进正常妊娠。
PI3K/Akt信号通路参与调节细胞的分裂、分化、生长、代谢以及凋亡等一系列生物学进程[20]。有研究发现,PI3K 调控下游靶蛋白Akt 发生磷酸化,活化的PI3K/Akt 信号转导可调节人滋养层细胞的生长,影响胎盘形成和胚胎早期的发育维持[21],改善子宫内膜容受性,易于胚胎着床,降低流产率[22]。本研究中黄芩苷各剂量组小鼠PI3K、p-Akt 蛋白表达均较模型组显著升高,提示黄芩苷可能通过调节PI3K/Akt 信号通路蛋白稳固了胚胎的正常发育,降低流产的发生率,促进RSA小鼠正常妊娠。
综上所述,黄芩苷能够降低RSA 小鼠的流产率,促进胚胎的正常发育,改善子宫母胎免疫耐受状态,该作用可能与调控PI3K/Akt 信号通路蛋白有关,本研究为黄芩苷临床治疗RSA提供了一定的理论支持。
