大黄䗪虫丸对下肢动脉硬化闭塞症模型大鼠血脂、ET-1、IL-6及PAF/LP/PLA2信号通路的影响
2022-08-28吕勃川赵钢张百亮侯继野
吕勃川,赵钢,张百亮,侯继野
(1. 黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2. 齐齐哈尔和平医院,黑龙江 齐齐哈尔 161000)
下肢动脉硬化闭塞症(arteriosclerosis obliterans,ASO)是除冠状动脉及脑动脉外最为常见的周围血管疾病,由多种危险因素共同作用引起下肢动脉血管发生粥样硬化病变,继发血管管腔狭窄或阻塞所致的慢性动脉闭塞性疾病。临床采用大黄䗪虫丸治疗血栓闭塞性脉管炎效果显著[1]。中医学认为,脉络血瘀是此类动脉缺血性疾病的病机核心,因此化瘀通脉是治疗此类疾病的基本原则,应大量应用虫类药物[2]。大黄䗪虫丸为久病血瘀之缓剂,其主药䗪虫、水蛭等具有破血逐癖、搜剔走窜、消癥瘕、通血脉的功效,且破而不峻、能和能行[3]。前期研究发现[4],大黄䗪虫丸能够降低血清中ET,升高血清中6-Keto-PGF1α 的含量,治疗下肢深静脉血栓形成(DVT)效果显著。为进一步探讨大黄䗪虫丸对下肢动脉硬化闭塞症的机制,本研究复制ASO 模型大鼠,探讨其对ASO 模型大鼠血脂、ET-1、IL-6 及PAF/LP/PLA2 信号通路的影响,为大黄䗪虫丸的进一步临床应用提供可靠的科学依据。
1 材料与方法
1.1 实验动物
由齐齐哈尔医学院神经药理研究室提供健康SD大鼠,体质量200~250 g,90只,8周龄,雄性。生产许可证号:SCXK(黑)2013-004。饲养环境:温度为(23 ±3)℃,湿度为40%~70%,每天12 h光照。
1.2 主要试剂与仪器
高速台式冷冻离心机(长沙湘仪离心机仪器有限公司);全自动多功能酶标仪(美国Bio-TEK 公司);实时荧光定量PCR仪(美国ABI公司)。
Anti-PAF Receptor Antibody(Abcam 公 司);IP3 Receptor、LP-PLA2 Antibody(Affinity 公司);VD3注射(腹腔注射,大连美仑生物技术有限公司);ET-1、IL-6、TG、TC、LDL-C、HDL-C ELISA 试剂盒(南京建成生物研究所);SYBR®Premix Ex TaqTM(Perfect Real Time)Kit(日本TaKaRa公司);TaKaRa PrimeScript®RTPCR Kit(中国大连宝生物工程有限公司);大黄䗪虫丸(北京同仁堂,批号:Z11020002);通塞脉片(江苏南星药业有限责任公司,批号:Z32020535)。
1.3 模型建立
取健康雄性SD 大鼠,采用复合方法制作动脉(髂-股动脉)粥样硬化模型大鼠,高脂饲料配制:20%猪大油、5%白糖、3%胆固醇、0.15%胆酸钠、2%蛋黄粉及69.85%的基础饲料,共饲养8 周。第1 周适应性喂养。第2周用高脂饲料喂养,第4周沿腹部至膝下纵向切开皮肤,分离并暴露髂、股动脉,动脉夹阻断髂、股动脉远、近端约1.5~2.0 cm,取22 g自制穿刺针,穿刺入股动脉,缓慢注射0.2~0.3 mL 无菌蒸馏水进入阻断部位血管,至血管充盈为止。4~5 min 后取下针头和动脉夹,压迫止血,缝合切口,观察大鼠造模前后一般状态及血清学变化。第5~8周用高脂饲料喂养。
1.4 分组与给药
造模成功后,按照临床等效剂量为低剂量组,大鼠与人用量的换算关系计算得出,灌胃等效剂量为0.54 g/(kg·d)。空白对照组和模型组大鼠给予生理盐水灌胃,每日1 次。阳性对照组给予通塞脉片生理盐水溶液(380 mg/kg)灌胃,每日1 次。高剂量组相当于临床等效剂量的4 倍,给予大黄䗪虫丸生理盐水溶液(2.16 g/kg)灌胃,每日1次。中剂量组相当于临床等效剂量的2倍,给予大黄䗪虫丸生理盐水溶液(1.08 g/kg)灌胃,每日1次。低剂量组相当于临床等效剂量,给予大黄䗪虫丸生理盐水溶液(0.54 g/kg)灌胃,每日1 次。各组灌胃时间均为4周。
1.5 采血与取材
乙醚吸入麻醉,毛细玻璃管沿大鼠目内眦斜刺眼底静脉丛,留取静脉血,4 ℃3 000~5 000 r/min 离心10 min,分离血清,置冰箱备用。戊巴比妥钠(30 mg/kg)麻醉,在不同时间点取材,大鼠取仰卧位固定于无菌手术台上,碘伏消毒手术区皮肤,开腹,剪取髂-股动脉,一部分投入10%福尔马林固定液中;其余部分放入液氮中保存,以备用于Western blot和PCR检测。
1.6 血清生化指标测定
应用双抗体夹心ABC-ELISA 法检测大鼠血清中血脂(TC、TG、LDL、HDL)、ET-1 及IL-6 的含量。操作根据试剂盒说明进行。
1.7 Western blot法检测PAF、LP-PLA2
取出0.1 g 组织,放入2 mL 的EP 管中倒入研磨珠和Western细胞裂解液,用组织研磨机将组织碾碎致匀浆,4 ℃静置30 min 后,4 ℃13 000 rpm 离心10 min,取上清液。用BCA试剂盒测蛋白的浓度,加入5×SDSPAGE蛋白上样缓冲液95 ℃水浴10 min,恢复室温。
1.8 统计学分析
使用SPSS 24.0 软件进行数据分析。实验数据用均数±标准差(±s)表示。采用方差同质性(卡方)检验方差是否齐性,当方差齐性时,使用单因素方差检验;当方差不齐时,使用Welch 方法进行比较,并将LSD 用于多重比较事后检验。P<0.05 为具有统计学意义。
2 结果
2.1 各组大鼠血清ET-1、IL-6含量比较
与空白对照组比较,模型大鼠血清ET-1、IL-6含量明显升高(P< 0.01)。与模型组比较,阳性对照组和大黄䗪虫丸各剂量组大鼠血清ET-1、IL-6含量明显降低(P< 0.01)。与阳性对照组比较,高剂量组大鼠血清ET-1、IL-6含量降低(P<0.01),低剂量组大鼠血清ET-1、IL-6 含量升高(P< 0.05)。中剂量组大鼠血清ET-1、IL-6 含量与阳性对照组比较,差异无统计学意义(P>0.05)。结果见表1。
表1 各组大鼠血清ET-1、IL-6含量比较(±s)
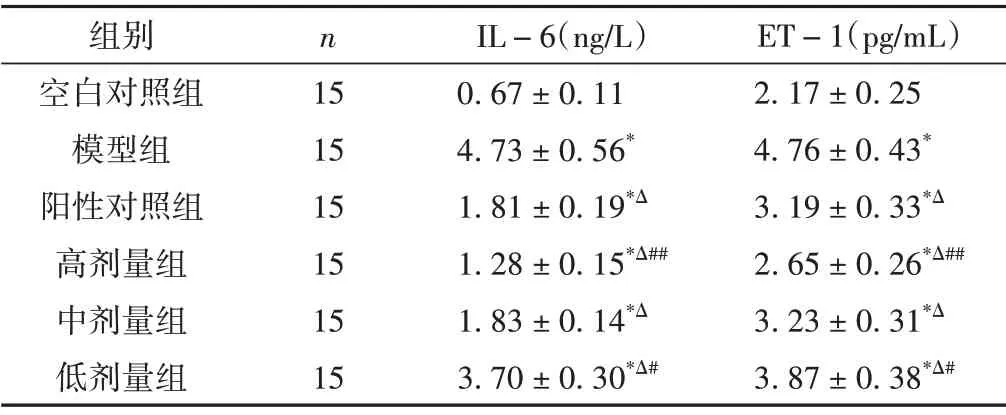
表1 各组大鼠血清ET-1、IL-6含量比较(±s)
注:与空白对照组比较,*P<0.01;与模型组比较,ΔP<0.01;与阳性对照组比较,##P<0.01,#P<0.05。
组别空白对照组模型组阳性对照组高剂量组中剂量组低剂量组n 15 15 15 15 15 15 IL-6(ng/L)0.67±0.11 4.73±0.56*1.81±0.19*Δ 1.28±0.15*Δ##1.83±0.14*Δ 3.70±0.30*Δ#ET-1(pg/mL)2.17±0.25 4.76±0.43*3.19±0.33*Δ 2.65±0.26*Δ##3.23±0.31*Δ 3.87±0.38*Δ#
2.2 各组大鼠血清TG、TC、LDL-C 和HDL-C 含量比较
与空白对照组比较,模型大鼠血清TG、TC、LDLC 含量明显升高,HDL-C 含量明显降低(P< 0.01)。与模型组比较,阳性对照组和大黄䗪虫丸各剂量组TG、TC、LDL-C 水平升高,HDL-C 水平降低,差异具有统计学意义(P<0.01);与阳性对照组比较,高剂量组TG、TC、LDL-C 含量降低,HDL-C 含量升高,差异具有统计学意义(P<0.01);低剂量组TG、TC、LDL-C含量升高,HDL-C 含量降低,差异具有统计学意义(P<0.05)。中剂量组TG、TC、LDL-C、HDL-C 的含量与阳性对照组比较,差异无统计学意义(P>0.05)。结果见表2。
表2 各组大鼠TG、TC、LDL-C、HDL-C含量的比较(±s,mmol/L)
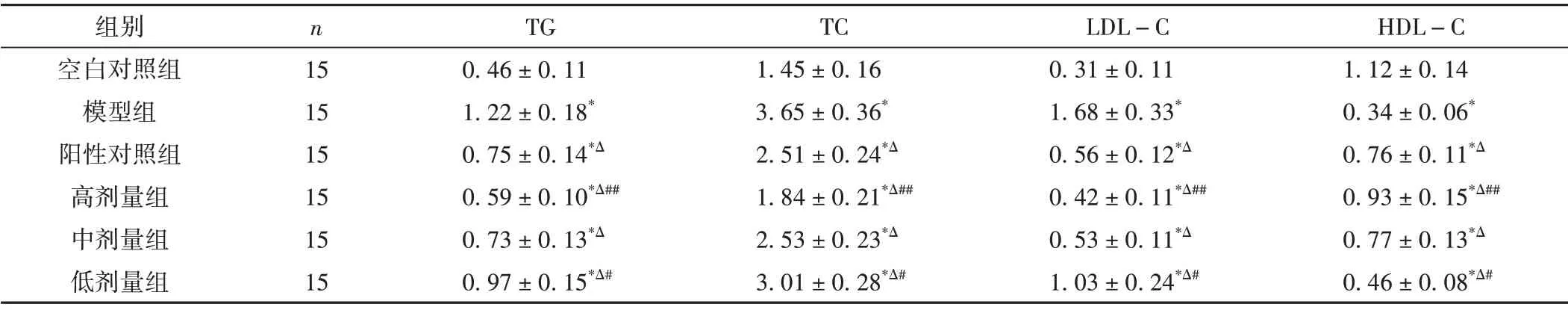
表2 各组大鼠TG、TC、LDL-C、HDL-C含量的比较(±s,mmol/L)
注:与空白对照组比较,*P<0.01;与模型组比较,ΔP<0.01;与阳性对照组比较,##P<0.01,#P<0.05。
组别空白对照组模型组阳性对照组高剂量组中剂量组低剂量组n 15 15 15 15 15 15 TG 0.46±0.11 1.22±0.18*0.75±0.14*Δ 0.59±0.10*Δ##0.73±0.13*Δ 0.97±0.15*Δ#TC 1.45±0.16 3.65±0.36*2.51±0.24*Δ 1.84±0.21*Δ##2.53±0.23*Δ 3.01±0.28*Δ#LDL-C 0.31±0.11 1.68±0.33*0.56±0.12*Δ 0.42±0.11*Δ##0.53±0.11*Δ 1.03±0.24*Δ#HDL-C 1.12±0.14 0.34±0.06*0.76±0.11*Δ 0.93±0.15*Δ##0.77±0.13*Δ 0.46±0.08*Δ#
2.3 Western blot 法检测PAF、LP-PLA2 蛋白表达水平比较
与空白对照组比较模型大鼠PAF、LP-PLA2蛋白表达明显增多(P<0.01)。与模型组比较,阳性对照组和大黄䗪虫丸各剂量组大鼠PAF、LP-PLA2 蛋白表达明显降低,差异具有统计学意义(P<0.01)。与阳性对照组比较,高剂量组PAF、LP-PLA2蛋白表达减少,差异具有统计学意义(P< 0.01);低剂量组PAF、LPPLA2蛋白表达增加,差异具有统计学意义(P<0.05)。中剂量组PAF、LP-PLA2蛋白表达与阳性对照组比较,差异无统计学意义(P>0.05)。结果见表3和图1。
表3 各组大鼠PAF、LP-PLA2蛋白表达水平比较(±s)
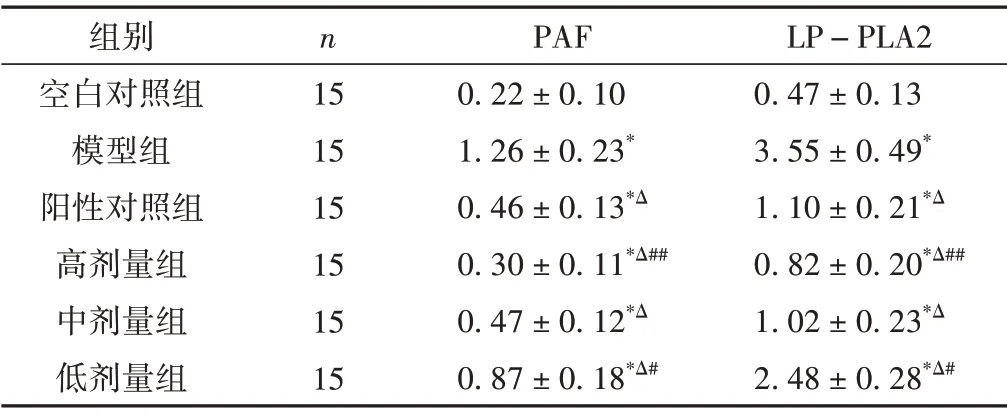
表3 各组大鼠PAF、LP-PLA2蛋白表达水平比较(±s)
注:与空白对照组比较,*P<0.01;与模型组比较,ΔP<0.01;与阳性对照组比较,##P<0.01,#P<0.05。
组别空白对照组模型组阳性对照组高剂量组中剂量组低剂量组n 15 15 15 15 15 15 PAF 0.22±0.10 1.26±0.23*0.46±0.13*Δ 0.30±0.11*Δ##0.47±0.12*Δ 0.87±0.18*Δ#LP-PLA2 0.47±0.13 3.55±0.49*1.10±0.21*Δ 0.82±0.20*Δ##1.02±0.23*Δ 2.48±0.28*Δ#
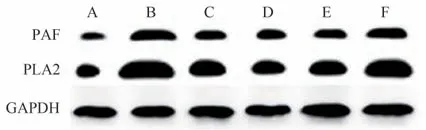
图1 各组大鼠Western blot图
3 讨论
ASO由多种危险因素共同作用引起下肢动脉血管发生粥样硬化病变,随着血管内粥样硬化斑块的增大,会出现管腔完全闭塞,造成严重肢体缺血,甚至截肢。目前,关于动脉粥样硬化(atherosclerosis,AS)发病机制主要有脂质渗入学说、内膜损伤学说及血栓形成学说等,当脂质损伤血管内皮后,激活中性粒细胞、单核细胞及平滑肌细胞,黏附并侵入内膜下,刺激分泌各种炎症因子和血管生长因子,引起血管平滑肌细胞增殖及迁移,继而血管内膜病理性增生,导致管腔狭窄甚至闭塞。据统计[5],全球范围内55~75 岁人群ASO 的患病率约为17%,60 岁以上人群患病率可达20%。目前,全球老年人口约占人口总数的13%,估计至2030 年,该比例预计将达到25%[6]。ASO 作为一种全身性动脉硬化疾病的局部表现,其形成原因复杂,治疗难度较大,具有预后差,致残率及病死率高等特点,已成为世界范围内威胁人类健康的主要疾病之一。
根据该病的发病特点及临床表现,将其归为“脱疽”范畴。脱疽的中医治法,最早见于《灵枢•痈疽》,载:“不衰,急斩之,不则死矣”,以“急斩之”及时切除坏死组织为主要治疗方法。《素问》曰:“脉道不远,气不往来,脉道以远,气血乃行”,指明了治疗该病当以活血化瘀为主。随着对本病认识的逐渐深入,陆续出现了四妙勇安汤、阳和汤、补阳还五汤等治疗脱疽病的经典方剂,并通过大量临床及基础试验研究明确了中药治疗本病的疗效及可能的作用机制[7-8]。
大黄䗪虫丸出自汉代张仲景著《金匮要略•血痹虚劳病脉症并治第六》中,本条因虚致瘀,瘀久成劳,瘀血不去,新血不生,肌肤失养,故治宜祛瘀生新。方中大黄、䗪虫、水蛭、桃仁、虻虫、干漆、蛴螬活血搜络化瘀,熟地黄、芍药养血润燥,杏仁理气润肠,黄芩清解郁热,甘草白蜜益气和中。诸药相合,为久病血瘀之缓剂。因其润以滋干,攻中寓补,峻剂丸服,意在缓攻,达到扶正不留瘀,祛邪不伤正的目的,为扶正祛瘀之方[9]。
现代药理学研究发现,大黄䗪虫丸能通过抗聚之能而发挥抗栓作用[10]。能改善血液黏滞度,增强血浆纤溶酶原活性,而发挥抗栓作用[11]。可降低TC、TG、LDL,升高HDL,说明其可调节血脂异常,改善内皮细胞功能,保护血管内皮,从而发挥抗动脉粥样硬化的作用[12]。使血清中IGF-1含量升高,抑制平滑肌细胞的凋亡,从而阻止AS 的形成,起到防止心脑血管疾病发生的作用[13]。能够明显提升AS 模型大鼠腹主动脉中NO 的含量,有效降低腹主动脉中血浆内皮素(endothelin,ET)的含量[14]。ET 具有调节代谢和内分泌的生理机能,可以促进血管平滑肌细胞的增殖,有着强有力的生物学效应,可以强力收缩气管、血管,有着较强的缩血管的能力。当血管被损伤后,内皮细胞受到刺激从而合成ET,同时也能释放大量使血管收缩的物质,常见的有血浆内皮-1(Eenothelin-1,ET-1),ET-1 与相应受体在特定情况下结合,就会收缩血管平滑肌,引起血流缓慢,使细胞处于失氧状态,同时随着毛细血管通透性的增加,产生大量自由基,激活血小板的生理作用,动脉硬化加重,导致抗凝作用降低,纤溶能力也随之降低,最终导致血栓形成。
动脉粥样硬化的发生和脂质沉积有着密不可分的关系。血脂中的高密度脂蛋白(HDL-C)有着对抗动脉粥样硬化形成的作用,当HDL-C 减少时,低密度脂蛋白被分解渗入至动脉内膜层,如果不能被吸收、吞噬和代谢,最终就会形成粥样硬化物质沉积在动脉内膜上。持续高浓度的LDL、TC、TG 在组织细胞中作用繁多,错综复杂,易导致动脉粥样斑块的发生和发展,甚至导致血栓的形成。IL-6通过刺激肝脏,产生大量的纤溶酶原激活剂的抑制物质(PAI),结合后纤溶酶原激活剂的活性明显降低,从而导致血小板的聚集,促进血栓形成。本研究通过测定血脂(TG、TC、LDL-C、HDL-C)、ET-1 及IL-6 的含量,发现大黄䗪虫丸能降低ET-1、IL-6、TG、TC 和LDL-C 的含量,升高HDL-C的含量,从而有效治疗下肢动脉硬化闭塞症。
血小板在血液的凝固过程中发挥着重要生理作用,是主要接受信号的效应器。血小板受到刺激后,可以释放一系列产物,引起血管收缩,损伤内皮细胞,引起血流流速减慢,从而聚集在血管内膜,导致血液凝固,最终导致形成血栓。
血小板形态的变化、聚集的程度及血小板有效成分能否被激活,都取决于血小板能否被活化[15],血小板只有被活化后,才能参与动脉粥样硬化、血栓形成,在心脑血管、外周动脉血栓性疾病的形成过程中起着重要作用。相关研究发现,在形成血栓前,其体内的血小板已经开始逐渐活化,此时的血小板是导致血栓的主要诱因[16],也是诱发和促使血管壁收缩,引起炎症反应的始动因素[17]。
PAF 是最为有效的血小板激活剂,可以使血小板的形态发生变化、进一步引起聚集、释放,是血小板聚集诱导剂和炎症因子,增强炎性反应和血小板聚集,收缩血管,释放氧自由基用等,在血栓形成的病理、生理过程中起重要作用[18]。也是最强的血小板聚集剂,在体内有着类似于激素的广泛生物学活性,在启动和扩大血栓形成中具有重要意义。与健康人血小板相比,在心、脑、外周血管血栓类疾病中,起关键作用是血小板的活化,一旦血小板活化后便可以激活血液中的中性粒细胞,使之发生聚集,释放大量氧自由基(ROS)[19]。在血栓形成、动脉粥样硬化形成之初,PAF 起了重要的始动作用,使血小板与粒细胞的交互作用[20]。VARGAFITG 等提出,在腺苷二磷酸、血栓素A2 途径导致血小板的聚集之后,PAF 是导致血小板聚集的第三条途径的重要介质[21]。脂蛋白相关磷脂酶A2 是全新的炎症标志物,它们和冠状动脉粥样硬化有着密切的关系[22]。炎症介质及反应在动脉粥样斑块的形成、发生和发展,甚至最后破裂阶段无处不在。研究表明,细胞表面PAF 与其受体结合后,导致G 蛋白与GTP 结合,产生二酰甘油和三磷酸肌醇,脂蛋白相关磷脂酶A2 从细胞膜上释放花生四烯酸转变为血栓素A2,从而引起动脉粥样硬化、血栓形成。
随着动脉硬化的加重,内膜的不断增生,平滑肌纤维排列紊乱加重,内皮细胞脱落增加,炎细胞浸润的增加,平滑肌结构的紊乱,大量泡沫细胞形成,PAF 的含量也随之增加,提示PAF 蛋白的增多与下肢动脉硬化闭塞症密切相关,PAF参与了ASO的发生、发展。本研究中采用Western blot 分析法检测各组下肢动脉硬化闭塞症大鼠血管细胞中PAF 蛋白的表达水平,结果大黄䗪虫丸各剂量组治疗后PAF 表达明显减少,提示PAF蛋白的含量可反映出ASO的严重程度及转归。
脂蛋白相关磷脂酶A2是一种炎症标志物,代表脂类物质的代谢程度和炎症反应程度,与血小板的不稳定性关系密切。在心血管疾病中,被认为是独立的危险因子,越来越受到关注。LP-PLA2是一种新型炎性标志物,由巨噬细胞、泡沫细胞等炎症细胞产生、分泌[23],可体现出血管壁周围炎症状态。LP-PLA2在稳定型和易损型斑块中都可以存在,相比之下,在不稳定斑块中LP-PLA2 浓度异常增高,主要分布于斑块的坏死核心、薄纤维帽的内膜间隙[24]。在AS 的形成、发展过程中,LP-PLA2 起着不可替代的作用,血液中LP-PLA2 的水平能够直接或间接反映出炎性的严重程度,所以在AS相性疾病的评估中可以起到预防和监测的作用[25]。LP-PLA2 可以通过载脂蛋白(Apo)B与脂蛋白结合,生成溶血卵磷脂和氧化游离脂肪酸等脂类促炎物质。从而引起血管内皮细胞凋亡和内皮屏障功能降低,产生各类黏附因子,在趋化炎症细胞的作用下,生成更多促炎物质,促进动脉粥样硬化发生、发展,最终导致动脉粥样硬化的形成。随着动脉硬化的加重,LP-PLA2 的含量也随之增加,提示LPPLA2 蛋白的增多与下肢动脉硬化闭塞症密切相关LP-PLA2 参与了ASO 的发生、发展。本研究中,采用Western blot 分析法检测各组下肢动脉硬化闭塞症大鼠血管细胞中LP-PLA2 蛋白的表达水平,结果大黄䗪虫丸各剂量组治疗后LP-PLA2 表达明显减少,提示LP-PLA2 蛋白的含量可反映出ASO 的严重程度及转归。
总之,大黄䗪虫丸不但能够抑制血栓形成和血小板聚集,并且能够降低血液的黏稠度,抑制胆固醇和甘油三酯的合成,具有抗动脉硬化、改善微循环的作用,对下肢动脉硬化闭塞症有很好的治疗效果。PAF可能通过激活LP-PLA2 通路,从而释放大量促炎物质,导致下肢动脉硬化闭塞症的发生和发展。大黄䗪虫丸在早期通过抑制PAF/LP/PLA2 通路的激活,从而抑制各类炎症因子的激活,减轻血管壁损伤,减轻动脉粥样硬化,减轻血栓的形成,可以有效治疗ASO。
