滤泡辅助性T细胞在重症肌无力发病机制中的研究进展
2022-08-26孙静李晓玲孙梦娇王红霞王满侠
孙静 李晓玲 孙梦娇 王红霞 王满侠
重症肌无力(myasthenia gravis,MG)是一种抗体介导的获得性自身免疫性疾病,其主要临床表现是神经肌肉传递障碍导致的骨骼肌无力和疲劳。MG在普通人群发病率为(0.50~3.00)/10万人,患病率为(10~20)/10万人[1],随着诊断技术的发展和人类寿命的延长,其发病率和患病率不断上升[2]。MG的发病机制主要涉及免疫系统紊乱,也与环境、感染、遗传及用药等因素有关,但调控MG发生发展的细胞和免疫机制尚不完全清楚。MG患者中80%血液中可检测到抗乙酰胆碱受体(acetylcholine receptor,AChR)抗体(acetylcholine receptor antibody,AChR-Ab),而一小部分可以检测到抗肌肉特异性激酶(muscle-specific kinase,MuSK)抗体或低密度脂蛋白受体相关蛋白4(low-density lipoprotein receptor-related protein 4,LRP4)抗体[3]。随着AChR-Ab的发现,体液免疫在MG发病中的作用引起了广泛关注。因此,针对MG抗体产生途径及靶向治疗的研究具有重要的临床价值。
滤泡辅助性T细胞(follicular helper T cells,Tfh)位于B细胞滤泡和生发中心(germinal center,GC),是CD4+T细胞的一个重要子集[4]。源于GC的Tfh是辅助B细胞迁移、增殖、分化为浆细胞并产生高亲和力抗体的主要效应T细胞[5]。GC的Tfh细胞和B细胞相互依赖,识别B细胞表面的同源抗原,并通过共刺激分子如CD28、分化簇40配体(cluster of differentiation 40 ligand,CD40L)、诱导共刺激分子(inducible costimulatory molecule,ICOS)和肿瘤坏死因子受体超家族成员4(tumor necrosis factor receptor superfamily member 4,OX40)等形成稳定的相互作用,有助于促进GC反应。此外,Tfh细胞分泌的效应细胞因子,如白细胞介素21(interleukin 21,IL-21)、IL-4、IL-9和IL-10等,它们不仅维持GC反应,还诱导GC的B细胞最终分化为浆细胞或记忆B细胞[6-9]。因此,Tfh在免疫调节过程中发挥重要作用。
近年来,靶向自身抗体的研究已成为MG研究领域的热点,而Tfh在其中起重要作用。本文将围绕Tfh细胞的表型、分化及调节,以及其与MG 的相关性等方面研究进行综述。
1 Tfh细胞的表型
Tfh细胞被认为是不同于传统Th1、Th2和Th17细胞的一个新型的辅助性T细胞亚群[10]。其在次级淋巴器官(secondary lymphoid organs,SLO)中发育,可根据独特的表面表型、细胞因子分泌谱和特征转录因子对其进行鉴定[11]。由于Tfh细胞是一个异质性细胞群体,因此不能用单一的标记物来定义。Tfh细胞具有多个功能性标记物,包括C-X-C趋化因子受体5(C-X-C chemokine receptor 5,CXCR5)、转录因子B细胞淋巴瘤6(B cell lymphoma 6,BCL-6)、 程序性细胞死亡蛋白1 (programmed cell death protein,1,PD-1)、ICOS 等[12]。其中CXCR5在Tfh细胞的迁移和定位上发挥作用,BCL-6严重影响GC的形成,从而对Tfh细胞的产生起作用,PD-1协助B细胞促进GC的形成,ICOS对Tfh细胞的产生和存活起重要作用[13]。这些转录因子驱动一系列基因的表达,对于Tfh细胞的分化发育和维持非常重要。Tfh细胞的不同表型是由免疫反应的当前阶段及其在组织中的不同定位决定的[14-15](图1)。次级淋巴器官和血液中的所有Tfh细胞亚群均表达CXCR5,但表达不同数量的其他标记物,包括转录因子BCL-6和ICOS。非淋巴组织中的大多数Tfh样细胞不表达CXCR5。次级淋巴器官中Tfh细胞包括前Tfh细胞、GC-Tfh细胞和记忆性Tfh细胞亚群。GC-Tfh细胞通常以CD4+CXCR5hiCCR7-PD1hiBCL-6+为特征。根据PD-1和趋化因子受体7(chemokine receptor 7,CCR7)的表达,血液中的循环Tfh(circulation Tfh,cTfh)细胞可分为效应器记忆(effector memory,cTfh EM)细胞或中央记忆(central memory,cTfh CM)细胞亚群,或根据C-X-C趋化因子受体3(C-X-C chemokine receptor 3,CXCR3)和趋化因子受体6(chemokine receptor 6,CCR6)的表达分为cTfh1细胞、cTfh2细胞和cTfh17细胞亚群[16]。
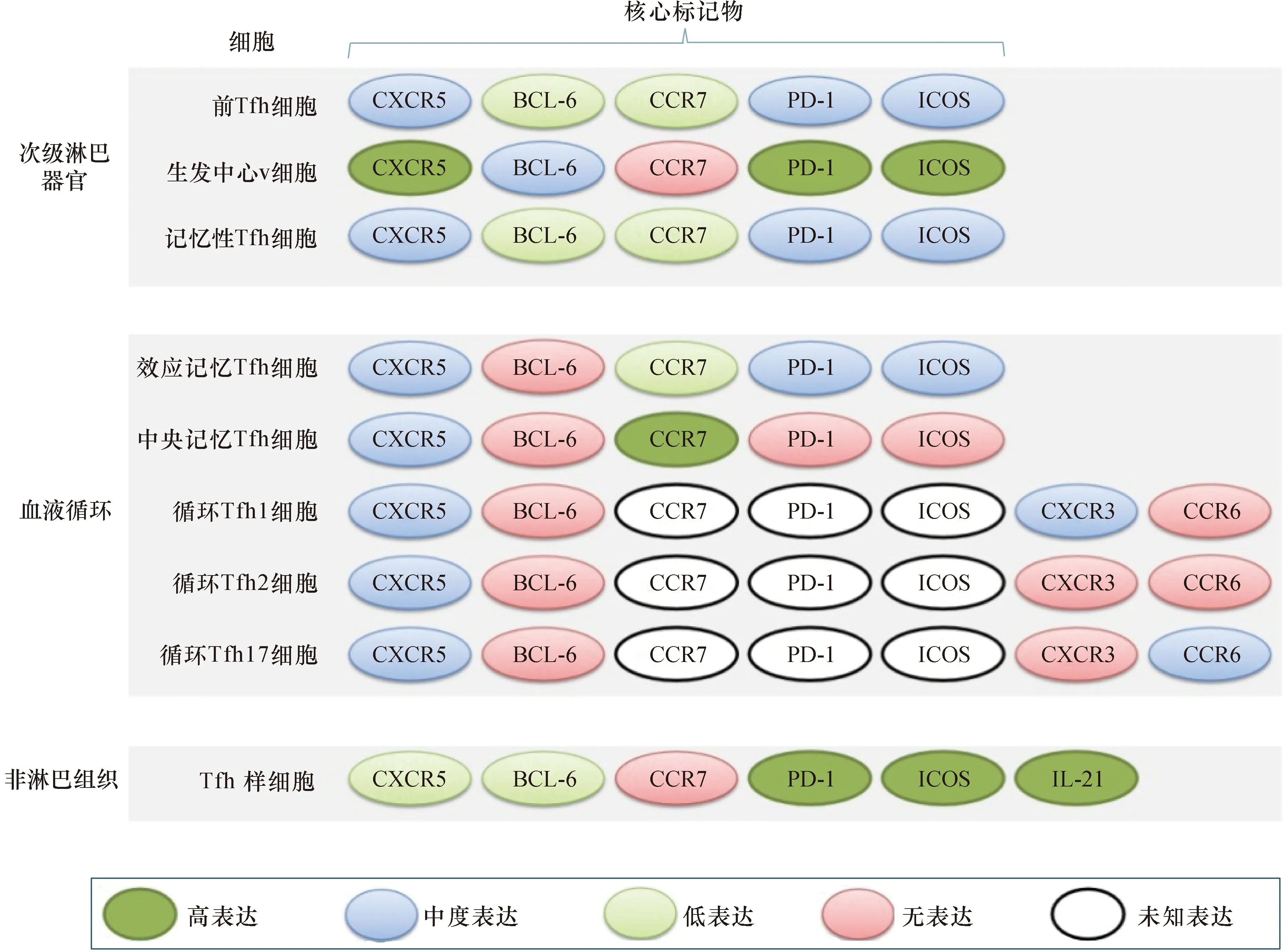
注:CXCR3、5:C-X-C趋化因子受体3、5;CCR6、7:趋化因子受体6、7;PD-1:程序性细胞死亡蛋白1;ICOS:诱导型共刺激分子;IL-21:白细胞介素21;BCL-6:B细胞淋巴瘤6 图1 Tfh细胞表型示意图:根据标记物的表达不同,次级淋巴器官、血液循环以及非淋巴组织中的Tfh细胞分为不同的类别
2 Tfh细胞的分化
Tfh细胞分化指初始CD4+T细胞向Tfh细胞的分化,是一个复杂的、受多因素调节的动态过程,涉及多个环节。正常的Tfh细胞分化通常需要树突状细胞(dendritic cell,DC)和B细胞两个抗原提呈细胞(antigen presenting cell,APC)[14],DC和B细胞在Tfh细胞分化和GC形成中相互合作。初始CD4+T细胞向Tfh细胞的分化过程涉及3个阶段,包括起始、维持和全极化阶段[17]。Tfh细胞分化的起始阶段即DC启动期,多种信号参与了这一过程,包括转录因子BCL-6、共刺激分子ICOS、细胞因子IL-6和IL-21以及高亲和力的T细胞受体( T cell receptor,TCR)。Tfh细胞分化维持阶段:BCL-6+CXCR5+Tfh前体细胞进入T-B边界区,B细胞呈递抗原并提供共刺激信号诱导型共刺激分子配体(inducible costimulatory molecular ligand,ICOXL),BCL-6+CXCR5+Tfh前体细胞与抗原特异性B细胞相互作用发生共定位,表达CXCR5,下调CCR7和Pselectin糖蛋白配体1(pselectin glycoprotein ligand 1,PSGL1)。全极化阶段即GC期,当Tfh细胞迁移进入GC滤泡区并分化为成熟的GC-Tfh细胞时,进入Tfh细胞分化的终末阶段。在此阶段,GC-Tfh细胞黏附于GC-B细胞并调节GC-B细胞向浆细胞和记忆B细胞的分化。GC-Tfh细胞的生物学特性与CXCR5、CCR7、ICOS、信号淋巴细胞活化分子相关蛋白(signaling lymphocytic activation molecule-associated protein,SAP )及相关分子的变化密切相关[18]。在每个分化阶段,Tfh细胞的发育都受到转录因子、细胞因子、趋化因子和细胞环境变化的影响。典型的Tfh细胞分化过程始于初始CD4+T细胞的DC启动[19]。CD4+T细胞在不同条件刺激下会出现不同的分化结果[20]。如果趋化因子受体CXCR5表达,早期Tfh细胞将迁移到B细胞滤泡的边缘,并经历进一步的Tfh细胞分化。如果细胞接收Th1、Th2或Th17信号,则CD4+T细胞遵循Th1、Th2或Th17细胞分化程序,包括炎症趋化因子的趋化因子受体上调,这将驱动效应细胞退出淋巴组织并流向感染或炎症部位[21]。综上所述,Tfh细胞分化途径,涉及多个信号、多阶段过程和两个不同的APC。几乎所有病原体,无论是病毒、细菌、真菌还是多细胞寄生虫,攻击人体组织时均可能发生抗体反应。因此,当人体受到病原体攻击的情况下,免疫系统触发Tfh细胞诱导抗体产生信号至关重要。
3 Tfh细胞分化的调节
Tfh细胞的分化是由细胞内信号通路、下游转录因子和转录后调节等机制参与调控的,这些机制涉及数十种转录因子、RNA结合蛋白和微小核糖核酸[15]。
3.1 Tfh细胞分化相关的转录因子Tfh细胞的分化受复杂的转录因子网络调控,其中一些转录因子能够正向调节Tfh细胞分化,而另一些转录因子能够抑制Tfh细胞分化。BCL-6是调节Tfh细胞分化和发挥生物学功能的主要转录激活因子[22]。自从BCL-6被发现以来,已证实越来越多的转录调节因子影响Tfh细胞发育、迁移和生物学功能。正向调节Tfh细胞分化的转录因子有巨噬细胞活化因子(macrophage activating factor,c-MAF)、活化转灵因子-碱性亮氨酸拉链转录因子(basic leucine zipper ATF-like transcription factor,BATF)、干扰素调节因子-4(interferon regulatory factor 4,IRF4)、信号转导和转录激活因子1(signal transducer and activator of transcription 1,STAT1)、STAT3、STAT4、T细胞因子1(T cell factor 1,TCF1)和淋巴样增强结合因子1(lymphoid enhanced binding factor 1,LEF1)及早期生长反应因子(early growth response factor,EGR)[23-28]等。能够抑制Tfh细胞分化的转录因子,包括B淋巴细胞诱导的成熟蛋白-1(B lymphocyte induced maturation protein 1,Blimp-1)、叉头框蛋白1(forkhead box protein 1,FOXO-1)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptorγ,PPARγ)、Kruppel样因子2(kruppel like factor 2,KLF2)和叉头框蛋白p1(forkhead box protein P1,FOXP1)等[29-33]。FOXO-1可负性调节 KLF2的表达。KLF-2通过与CXCR5基因结合来抑制CXCR5的表达,而KLF2能诱导Blimp-1产生。Blimp-1可抑制BCL-6、c-MAF、CXCR5和PD-1的表达[34]。上述研究表明,多个转录因子网络正向或负向调节Tfh细胞分化,且各个转录因子之间也可相互调节。
3.2 Tfh细胞分化的转录后调节在人类基因组中,大约有1500个RNA结合蛋白(RNA-binding proteins,RBPs)。RBP可识别并直接与信使核糖核酸(messenger ribonucleic acid,mRNA)3′非翻译区的顺式调控元件结合,调节mRNA稳定性或翻译效率,这个过程被称为“转录后调节”[35]。转录后基因调控是适应基因表达和改变细胞反应的一种快速有效的方法。据估计,T细胞激活后发生的50%以上的蛋白质表达变化是由转录后调节引起的[36]。一些蛋白质和微小核糖核酸(miRNA)被证明可以调节Tfh细胞的发育、体内平衡和生物学功能。Roquin(也被称为Roquin 1,由Rc3h1编码)是第一个被证明能抑制Tfh细胞聚集的核糖核酸结合蛋白,其定位于应激颗粒和P体,能与ICOS和OX40(CD134)的TCR结合,诱导其衰变[37]。有研究表明miRNA-17~92家族通过限制非Tfh基因(如Rora)[38]的表达和增强磷酸肌醇3激酶(phosphoinositide 3 kinase,PI3K)信号传导,促进T细胞初始激活后Tfh细胞的形成。它们主要通过直接抑制含有PH结构域亮氨酸丰富的磷酸酶2(pleckstrin homology domain leucine-rich repeat protein phosphatase 2,Phlpp2)发挥作用,Phlpp2使PI3K下游效应器Akt(也称为蛋白激酶B或PKB)失活,第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)的下调起一定作用,PTEN拮抗PI3K通路[39]。其在T细胞中的过度表达可诱发自发性Tfh细胞分化和系统性自身免疫[40]。miRNA-146a可导致GC-B细胞自主抑制,并间接限制GC-B细胞上ICOSL的表达,其是Tfh分化的细胞内在抑制物,缺乏miRNA-146a的小鼠以细胞自主方式聚集Tfh细胞[41];miRNA-155在慢性炎症期间驱动异常GC反应调节Tfh细胞的发育,此外,miRNA-155可下调低聚果糖相关抗原2(FOS associated antigen 2,FOSL2)的表达,从而负向调节Tfh细胞的分化[42]。
3.3 Tfh细胞分化相关的信号转导通路Tfh细胞分化是由多因素、多环节及复杂机制调节的动态变化过程。与Th1、Th2和Th17细胞相比,Tfh细胞的分化更依赖于持续的TCR信号和ICOS的共刺激。Tfh细胞对持续TCR信号和ICOS共刺激的独特依赖性是通过PI3K信号介导的,ICOS介导的PI3K信号通路已被证明在Tfh编程、向GC的迁移以及在Tfh-GC-B细胞结合过程中起着关键作用。ICOS过通过Akt的PI3K信号促进Tfh细胞分化。PI3K p85α亚单位在Tfh细胞分化相关基因的转录调控中具有双重作用。一方面,p85α与细胞内骨桥蛋白(osteopontin,OPNi)形成复合物,后者迁移到细胞核中并保护BCL-6免受泛素依赖性降解。另一方面,PI3K激活Akt通过磷酸化介导的胞质滞留抑制FOXO-1功能,从而上调BCL-6和下调KLF2,促进了Tfh细胞迁移和功能相关的特征基因表达,参与Tfh细胞的形成[43]。其次,酪氨酸激酶-信号转导与转录活化(tyrosine kinase-signal transduction and transcriptional activation,JAK-STAT)信号通路也能调节Tfh细胞的分化,STAT1和STAT4信号通过驱动B细胞表达T-bet(T-box expressed in T cells)和产生γ干扰素(γ interferon,IFN-γ)来控制GC的反应和Tfh细胞的产生[44-45]。STAT3能与BCL-6[46]和IL-21[47]的启动子区相结合,并激活这些基因的转录,间接调节Tfh分化。此外,STAT5是Tfh细胞分化的有效负调节因子[48]。
4 Tfh细胞与MG关系的相关研究
MG是一种由自身抗体介导的神经肌肉接头传递障碍引起的神经免疫性疾病。尽管以前的研究认为 MG 主要与 B 细胞功能有关,但近年来越来越多的实验研究发现Tfh细胞在MG的免疫性致病中发挥了重要的作用。目前普遍认为,Tfh细胞活化不是 MG发生的始动因素,但其却在MG相关自身抗体产生过程中发挥了促进作用。自身抗体在MG发病中发挥直接致病作用,因此,Tfh细胞对MG的发生发展具有重要意义。
4.1 临床研究MG曾被认为是细胞免疫依赖、补体参与的神经免疫性疾病。但AChR-Ab的检出,使体液免疫在MG发病中的作用得到关注,抗体的产生途径成为进一步研究MG的热点。胸腺GC的发现对MG的研究意义重大,源于GC的Tfh细胞能辅助B细胞增殖、分化成熟为浆细胞并产生高亲和力抗体,发挥免疫调节作用。多项临床研究发现MG患者血液中的Tfh细胞异常活化,且Tfh细胞表达水平与疾病严重程度相关。而滤泡调节性T细胞(follicular regulatory T cells,Tfr)作为调节性T细胞(regulatory T cell,Treg)的特殊亚群,可以迁移到GC并抑制Tfh细胞介导的细胞活化和抗体的产生。
Yang等和王丽芳等[49-50]研究报道,与健康对照组相比,MG患者循环中Tfh细胞的比例显著增高,且与血清抗AChR-Ab水平呈正相关。王圣元等[51]发现Tfh/Tfr比值与美国重症肌无力基金会(Myasthenia Gravis Foundation of America,MGFA)分型和定量重症肌无力评分(quantitative myasthenia gravis score,QMGs)呈正相关。Wang等[52]发现MG患者外周血中Tfh细胞比例明显高于健康人,且与MG的严重程度有关。Shinji等[53]报道MG患者外周血中Tfh水平与疾病严重程度相关,免疫治疗后循环Tfh异常改善与临床改善同步,提示循环Tfh的改变是MG发生发展的一个重要特征,其可能成为疾病严重程度和治疗效果的生物标志物。Wen等[54]发现,与健康对照组相比,Tfr细胞在MG患者外周血中的表达比例下降,Tfh细胞表达比例则显著升高;Tfr /Tfh细胞比例与QMGs评分呈显著负相关。上述研究结果表明Tfr细胞比例降低、Tfh细胞比例增多,这些变化可能通过介导相应抗体的生成反应,改变QMGs评分,影响疾病的严重程度而参与MG疾病进程。
单纯眼肌型重症肌无力(ocular myasthenia gravis,OMG)为 MG 的一种亚型。Zhao等[55]发现,与OMG组和全身型MG( generalized masthenia gravis,GMG)组相比较,Tfr细胞在健康对照组表达比例最高,OMG 次之,GMG中最低;相反,Tfh细胞在GMG组中的表达比例最高,OMG组次之,健康对照组中最低;同时,Tfr /Tfh细胞比值在健康对照组中最高,其次是OMG患者,在GMG患者中表达最低。以上研究结果提示Tfr和Tfh细胞平衡表达对维持正常免疫功能和免疫耐受具有重要作用,其免疫失衡可能参与MG的发病。宋阳等[56]报道,与无MG的胸腺瘤组和健康对照组相比,MG合并胸腺瘤组胸腺组织中Tfh细胞比例及其CXCR 5、ICOS、PD-1和BCL-6的表达水平显著增高。Zhang等[57]通过共聚焦显微镜观察到,在MG患者的胸腺中,Tfh细胞和B细胞共同定位在异位GC内,并且Tfh细胞的比例增高、B 细胞和自身抗体滴度增加;体外研究进一步显示Tfh细胞通过效应细胞因子IL-21诱导AChR-Ab的分泌。上述研究结果表明,胸腺内Tfh细胞和B细胞的相互作用在胸腺异位GC的形成和AChR-Ab的产生中起关键作用,这种相互作用可能引发MG。Li等[58]发现在MuSK抗体阳性MG患者外周血中,Tfh细胞比例增高,Tfh/Tfr细胞比值增高,这些结果均提示Tfh细胞在MuSK抗体阳性MG患者中过度活化,有可能促进了MuSK抗体的分泌,引发了MG。以上这些证据都为调控Tfh细胞活化治疗MG 提供了理论基础,尚需要进一步研究Tfh细胞如何参与MG的免疫反应。
4.2 动物实验虽然Tfh细胞与各种自身免疫性疾病有关,并且上述临床研究发现MG患者中Tfh细胞存在异常表达,但目前尚不清楚Tfh细胞是如何以及何时被诱导的,以及它们如何推动MG的进展。因此许多学者相继通过建立实验性自身免疫性重症肌无力(experimental autoimmune myasthenia gravis,EAMG)模型去探究Tfh细胞与MG发生发展的相关性。
Xin等[59]研究证实,EAMG小鼠的脾脏单核细胞中Tfh细胞及相关分子BCL-6、IL-21上调,并且Tfh细胞比例与血清AChR抗体滴度呈正相关。Gong等[60]和Huang等[61]的研究结果显示,EAMG外周血中Tfr/Tfh细胞的比例失衡,Tfr细胞比例下降,而Tfh细胞比例上升;且药物干预结果表明,通过增加Tfr细胞和减少Tfh细胞的数量或比例可以减轻EAMG大鼠疾病的严重程度。Cui等[62]研究报道,Tfh细胞介导的体液免疫反应在EAMG发病中有增强作用。也有研究发现全反式维甲酸可通过平衡Tfr/Tfh的比例来改善EAMG小鼠的肌无力症状[63]。Yang等[64]报道,CXCR5阴性自然杀伤细胞通过抑制Tfh细胞改善EAMG。上述动物实验结果提示,Tfh可能参与MG的发病,且其作用可能与Tfr和Tfh免疫失衡有关。
上述临床研究和动物实验均提示,MG发病中存在显著的Tfh细胞活化。可通过药物干预Tfh细胞活化,降低Tfh细胞比例,有助于维持Tfr /Tfh细胞免疫平衡,进而可影响Tfh细胞与B细胞在GC中的相互作用,导致MG相关自身抗体生成减少,从而减少了MG的发病。因此,以Tfr/Tfh细胞为靶点设计新型药物可能有助于MG的治疗。
综上,Tfh细胞是CD4+T细胞的一个重要亚群,在MG发生发展中的作用引起了广泛关注。Tfh细胞活化和功能的异质性及其在不同抗体类型的MG中是否有不同的作用机制,尚需更加深入的研究证实。因此,深入阐述Tfh细胞表型、功能及相关免疫学因素与MG发生发展的内在联系,有助于进一步揭示疾病的发病机制,为其治疗提供新的思路和方法。
