超声波辅助提取油莎豆粕水溶性多糖及其抗氧化性
2022-08-24吴修利徐雷谢英司美双
吴修利,徐雷,谢英,司美双
(长春大学食品科学与工程学院,吉林 长春 130022)
油莎豆为莎草科莎草属多年生草本植物,是一种优质、高产、综合利用价值很高的油、粮多用新型作物[1-2]。油莎豆基本成分主要由脂肪、糖、淀粉等组成,含量分别为26.50% 、23.35% 和23.21%[3]。经提取油和淀粉后的油莎豆粕中还含有丰富的水溶性多糖,研究表明,植物多糖具有调节和增强机体抗氧化酶活性、有效清除自由基的功能[4]。目前,多糖的抗氧化性测定主要采取体外试验、细胞试验以及活体实验3种方式。由于体外试验具有操作简便、仪器设备要求不高、费用低等优点,在多糖抗氧化性研究中被广泛使用[5]。
近年来,多糖的提取方法有化学法、酶解法、物理强化法或将不同技术进行复合使用的方法[6]。普通化学法存在提取时间长、耗能高[7]等缺点,而酶解法存在成本高等问题[8]。超声波辅助提取作为常用的物理强化法,其原理是利用超声波的空化效应、机械效应以及热效应破坏细胞,利于细胞壁破碎,加快细胞内物质的释放和溶解速率,与传统方法相比,提取液中的杂质较少,同时能缩短提取时间并提高有效物质的提取率[9]。
本研究利用超声波辅助提取油莎豆粕水溶性多糖,采用正交试验法对工艺进行优化,同时对油莎豆粕水溶性多糖的结构、抗氧化性进行研究,为油莎豆粕水溶性多糖的进一步开发利用提供参考依据。
1 材料和方法
1.1 材料与试剂
油莎豆粕:长春大学食品科学与工程学院实验室自制;蒽酮:国药集团化学试剂有限公司;硫酸:西陇科学股份有限公司;硫酸亚铁、过氧化氢:天津市福晨化学试剂厂;水杨酸:天津市华东试剂厂;三羟甲基氨基甲烷:北京沃凯生物科技有限公司;邻苯三酚:北京偶合科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):上海麦克林生化科技有限公司;溴化钾(色谱纯):天津中世沃克科技发展有限公司。以上化学试剂均为分析纯。
1.2 主要仪器与设备
XO-1500DN温控型超声波细胞破碎仪:南京先欧仪器制造有限公司;NICOLETIS5型傅里叶变换红外光谱仪:赛默飞世尔科技有限公司;UV-2700紫外可见分光光度计:岛津仪器(苏州)有限公司;TDL-50B低速离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 油莎豆粕水溶性多糖提取工艺
油莎豆粕→粉碎过40目筛→超声处理→离心沉淀→取上清液→脱蛋白→过滤→旋转蒸发(浓缩至体积的1/5)→醇沉→离心→干燥→粉碎过100目筛→油莎豆粕水溶性多糖。
脱蛋白采用等电点法[10]进行,即用1 mol/L的HCl调节pH值至4.5,搅拌均匀后过滤除去蛋白质沉淀,留上清液。
1.3.2 油莎豆粕水溶性多糖含量测定
多糖含量采用蒽酮-硫酸比色法测定[11]。
葡萄糖标准液配制:取1.0 mL不同浓度葡萄糖标准溶液(0、20、40、60、80、100 μg/mL)于试管中,加入蒽酮试剂5 mL,摇匀,沸水浴中煮沸15 min,取出立即冷却,620 nm处测吸光度,以葡萄糖浓度(x)为横坐标,以吸光度(y)为纵坐标,绘制标准曲线。回归方程为y=0.008 7x-0.014 9,R2=0.998 7。
样品多糖含量的测定:吸取多糖样品溶液1.0 mL,用蒸馏水定容至100 mL。取1.0 mL定容后样液按上述方法测定吸光度。以蒸馏水作为对照,参照葡萄糖标准曲线计算样品多糖浓度。按下式计算多糖提取率。

式中:C为根据吸光度计算得到的油莎豆粕水溶性多糖浓度,mg/mL;V为测定所用油莎豆粕水溶性多糖溶液体积,mL;N为稀释倍数;m为称取的油莎豆粕质量,g。
1.3.3 单因素试验设计
以油莎豆粕水溶性多糖提取率为指标,采用单因素试验研究不同料液比、超声时间、超声功率对多糖提取率的影响,试验水平分别选取为料液比[1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)],超声时间(4、6、8、10、12 min),超声功率(150、300、450、600、750 W)。
1.3.4 正交试验设计
在单因素试验基础上,选取料液比(A)、超声时间(B)、超声功率(C)设计三因素三水平正交试验,以油莎豆粕水溶性多糖提取率作为考察指标,确定油莎豆粕水溶性多糖最佳提取工艺条件。正交试验因素水平见表1。

表1 正交试验因素与水平Table 1 The factors and levels of orthogonal test
1.3.5 傅里叶变换红外光谱分析
采用溴化钾压片法。将干燥的油莎豆粕水溶性多糖样品与溴化钾按照质量比1∶180研磨均匀,压成透明薄片,在400 cm-1~4 000 cm-1波数内进行全波段扫描,绘制红外光谱图。
1.3.6 油莎豆粕水溶性多糖抗氧化性测定
1.3.6.1 DPPH自由基清除能力测定
分别准确吸取浓度为 2、3、4、5、6 mg/mL 的多糖样品2 mL,再吸取2 mL 0.2 mmol/L的DPPH-乙醇溶液加入到试管中摇匀,室温(25°C)下避光静置30 min,在517 nm处测其吸光度。每个待测样品平行测定3次,取平均值。以VC作为阳性对照,按照下式计算DPPH自由基清除率[12]。
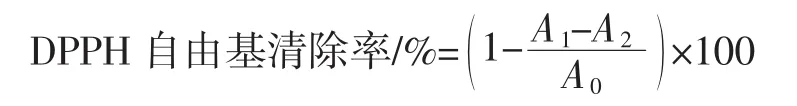
式中:A0为乙醇与DPPH混合溶液的吸光度;A1为样品与DPPH混合溶液的吸光度;A2为样品与乙醇混合溶液的吸光度。
1.3.6.2 羟自由基清除能力测定
参考罗敬文等[13]的方法,略有改动。向15 mL的试管中加入2 mL硫酸亚铁溶液(6 mmol/L)、2 mL过氧化氢溶液(6 mmol/L)、2 mL水杨酸溶液(6 mmol/L)和2 mL 浓度分别为 0.50、0.75、1.00、1.25、1.50 mg/mL 的多糖样品溶液,在37℃下反应1 h,以蒸馏水为参比,在517 nm波长处测定其吸光度,每个试验平行3次。以VC作为阳性对照,羟自由基清除率按下式计算。
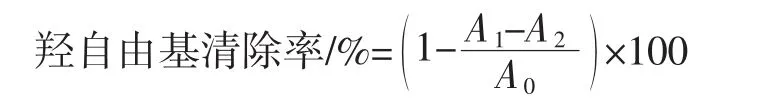
式中:A0为蒸馏水的吸光度;A1为过氧化氢溶液和样品溶液混合后的吸光度;A2为蒸馏水代替过氧化氢和样品溶液混合后的吸光度。
1.3.6.3 超氧阴离子自由基清除能力测定
取浓度分别为 2、3、4、5、6 mg/mL 的多糖样品0.5 mL,向15 mL的试管中加入4.5 mL Tris-HCl缓冲液(50 mmol/L,pH8.2),摇匀,置于 37℃条件下预热20 min,然后加入0.5 mL在37℃条件下预热的邻苯三酚(3 mmol/L),摇匀后立即倒入比色皿。以HCl(10 mmol/L)溶液为参比,在325 nm波长下测吸光度,每个试验平行3次。以VC作为阳性对照,超氧阴离子自由基清除率按下式计算[14]。

式中:A0为蒸馏水与邻苯三酚溶液混合后的吸光度;A1为样品溶液与邻苯三酚溶液混合后的吸光度;A2为样品溶液与蒸馏水混合后的吸光度。
1.4 数据处理
采用Origin 2018 64 Bit、SPSS 21.0软件对试验数据进行分析处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对油莎豆粕水溶性多糖提取率的影响
在超声功率600 W、超声时间6 min的条件下,考察料液比对油莎豆粕水溶性多糖提取率的影响,结果见图1。
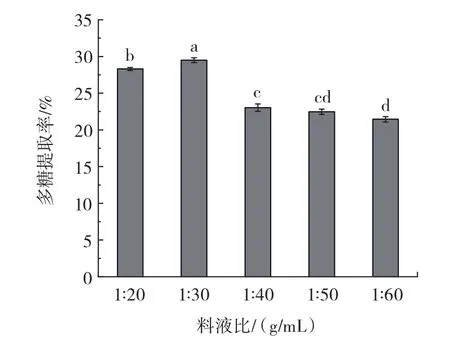
图1 料液比对多糖提取率的影响Fig.1 The effect of solid-liquid ratio on the yield of polysaccharides
由图1可知,随溶剂体积的增加,油莎豆粕水溶性多糖提取率呈先增大后减小的趋势。这是因为溶剂增多后水溶液与油莎豆粕粉末接触更加充分,从而有利于多糖的溶出,在料液比为1∶30(g/mL)时,多糖的提取率达到最大,此时多糖类物质的溶出达到饱和。继续增大溶剂体积时,提取率反而下降。可能的原因:一方面,随着水溶液增多,一部分超声波会被水溶液吸收,从而影响多糖的提取率;另一方面,溶剂体积过大还可能造成溶出的蛋白质重新与多糖结合[15],而且增加了后续处理时间和提取液浓缩成本。因此,选择料液比 1∶20、1∶30、1∶40(g/mL)3 个水平进行后续正交试验。
2.1.2 超声时间对油莎豆粕水溶性多糖提取率的影响
在料液比1∶30(g/mL)、超声功率 600 W的条件下,考察超声时间对油莎豆粕水溶性多糖提取率的影响,结果见图2。
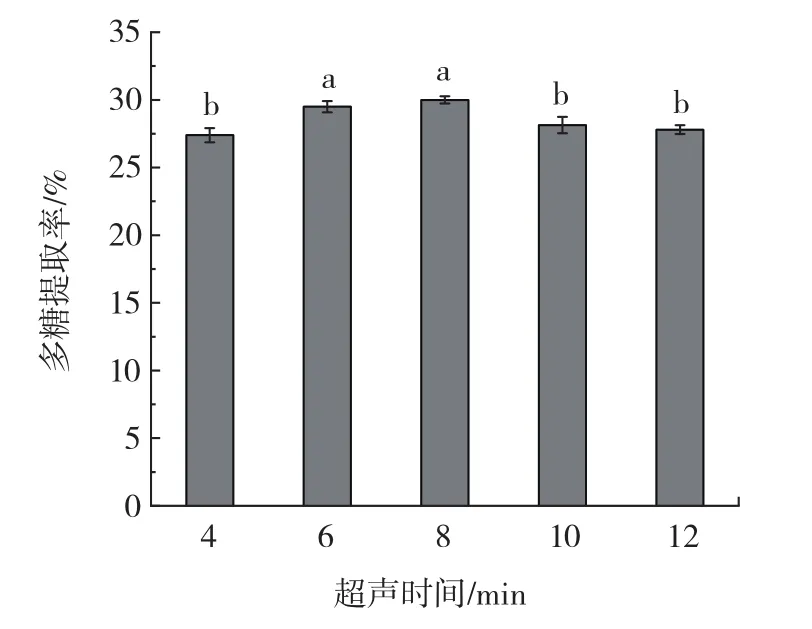
图2 超声时间对多糖提取率的影响Fig.2 Effect of ultrasonic time on the yield of polysaccharides
由图2可知,随着超声时间的延长多糖提取率先增大后减小,当超声时间为8 min时多糖提取率达到最大。足够的超声时间有助于促进多糖从细胞中溶出,提高多糖提取率。当超声时间超过8 min时,造成多糖提取率下降,原因可能是由于超声时间过长,导致细胞完全破裂,细胞内杂质也会溶入水中,从而使多糖的溶解减少[15]。此外,长时间超声处理,较强的机械剪切作用使溶出的大分子多糖更加不稳定,糖苷键断裂,从而导致多糖提取率下降[16]。因此,选择超声时间6、8、10 min 3个水平进行后续正交试验。
2.1.3 超声功率对油莎豆粕水溶性多糖提取率的影响在料液比1∶30(g/mL)、超声时间8 min的条件下,考察超声功率对油莎豆粕水溶性多糖提取率的影响,结果见图3。

图3 超声功率对多糖提取率的影响Fig.3 Effect of ultrasonic power on the yield of polysaccharides
由图3可知,随着超声功率增大,多糖提取率先增大后减小,当超声功率为450 W时提取率达到最大。这是因为超声波产生的机械振动具有空化效应,促进细胞的结构破坏,加快溶质扩散和溶解渗透,从而加速了多糖的溶出,超声波的功率越高空化作用越强,多糖的提取率越高。当超声功率大于450 W时,提取率下降,可能是由于超声功率过高对多糖结构具有破坏性作用[17]。 因而,选择超声功率300、450、600 W 3个水平进行后续正交试验。
2.2 正交试验结果分析
正交试验结果和方差分析结果如表2和表3所示。
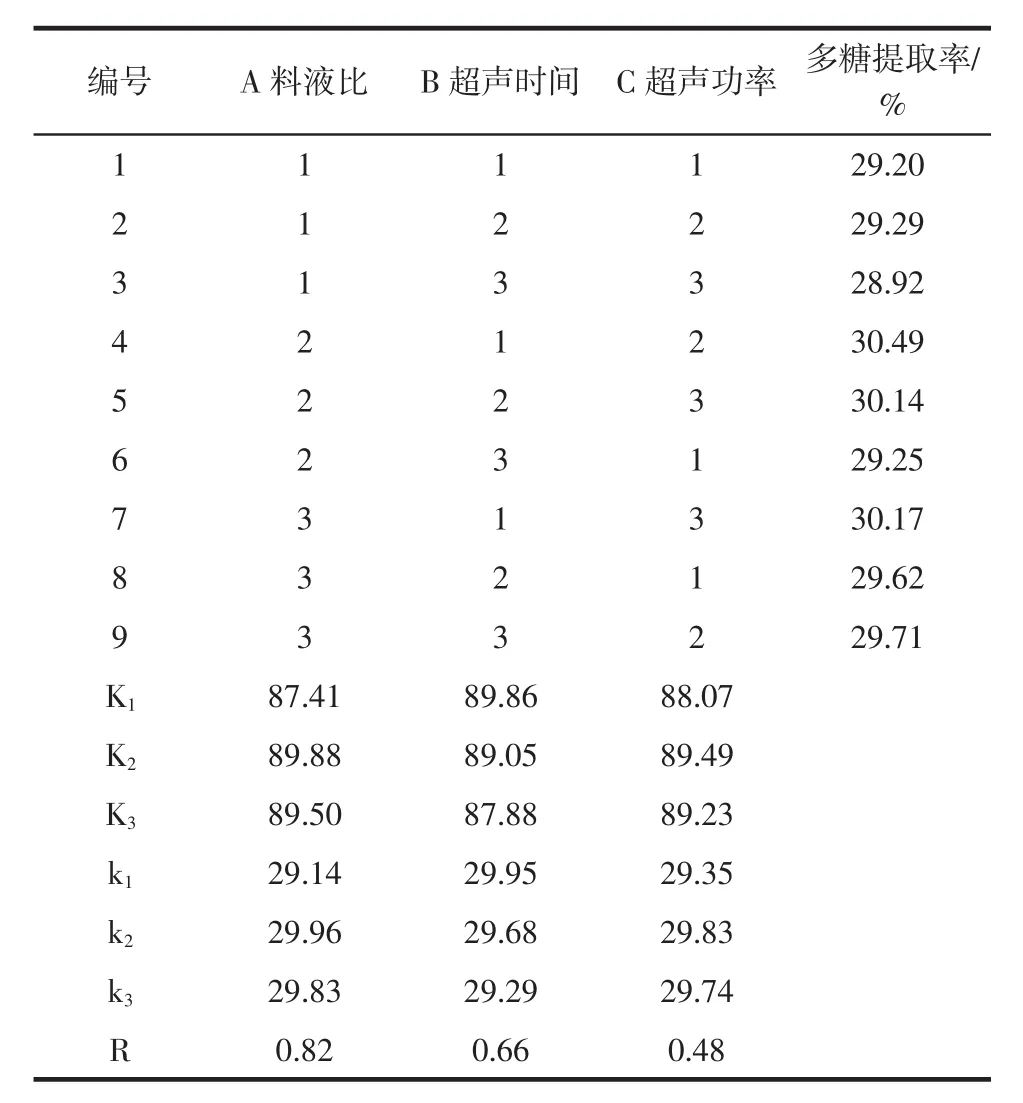
表2 正交试验结果Table 2 Results of orthogonal test
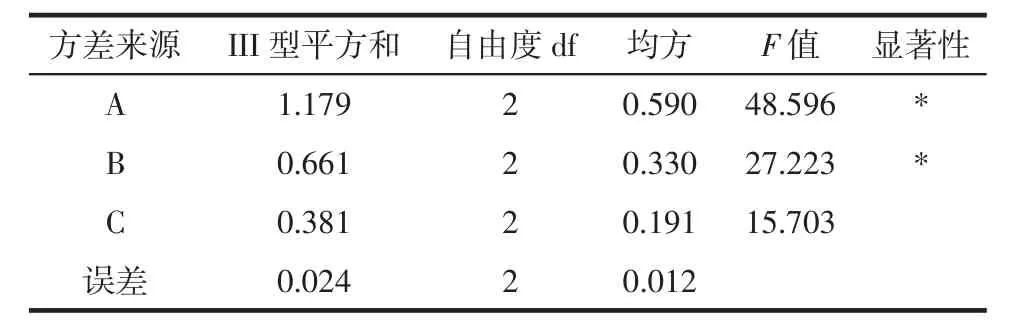
表3 正交试验方差分析结果Table 3 The variance analysis result of orthogonal test
通过表2极差分析可知,影响油莎豆粕水溶性多糖提取率的因素主次顺序为A>B>C,即料液比>超声时间>超声功率。提取油莎豆粕水溶性多糖的最优工艺组合为 A2B1C2,即料液比 1∶30(g/mL)、超声时间 6 min、超声功率450 W。此最优组合恰好为正交试验表中的试验4(提取率最大),因此油莎豆粕水溶性多糖提取率为30.49% 。
2.3 油莎豆粕水溶性多糖红外光谱分析
图4为油莎豆粕水溶性多糖的红外光谱图。

图4 油莎豆粕水溶性多糖红外光谱Fig.4 FT-IR spectra of water-soluble polysaccharide of Cyperus esculentus meals
由图4可知,位于3 384 cm-1附近较宽的吸收峰为O—H或分子间氢键的伸缩振动,2 937 cm-1处为—CH2和—CH的C—H伸缩振动,1 660 cm-1处强吸收峰归因于结合水,1 415 cm-1处为C—H的弯曲振动,均为多糖类物质的特征峰。1 130、1 060、992 cm-1处的3个吸收峰可以证明多糖样品含有吡喃环[18],而916 cm-1处为典型的D-吡喃葡萄糖吸收峰,846 cm-1的吸收峰可以确定样品含有α-糖苷键[19],综上说明油莎豆粕水溶性多糖是以α-吡喃糖为骨架的多糖。
2.4 油莎豆粕水溶性多糖抗氧化性分析
2.4.1 油莎豆粕水溶性多糖对DPPH自由基清除能力的影响
DPPH自由基作为一种比较稳定的自由基,能快速地反映样品的抗氧化性[20]。油莎豆粕水溶性多糖对DPPH自由基清除能力的影响见图5。
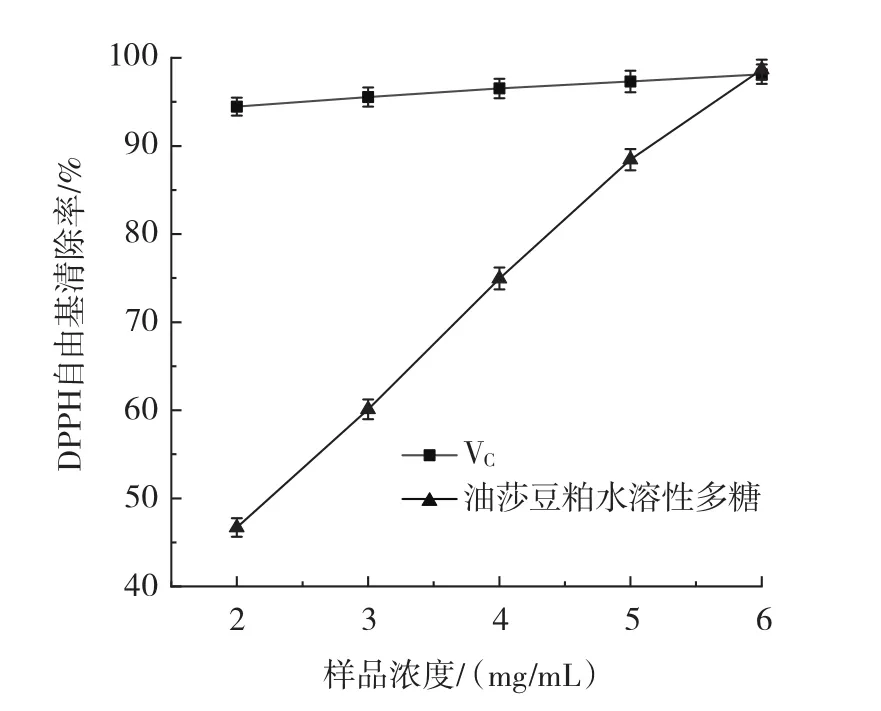
图5 VC与油莎豆粕水溶性多糖对DPPH自由基清除能力的影响Fig.5 The scavenging effect of VCand water-soluble polysaccharide of Cyperus esculentus meals on DPPH free radicals
由图5可知,VC对DPPH自由基具有很强的清除能力,当VC浓度为2 mg/mL时,清除效果已经达到94% 。油莎豆粕水溶性多糖浓度在2mg/mL~6mg/mL时,多糖对DPPH自由基的清除率随着多糖浓度的升高而增大,并且呈现一定的线性关系,当浓度为6 mg/mL时,油莎豆粕水溶性多糖对DPPH自由基的清除率达到98.7% 。由此可见,油莎豆粕水溶性多糖对清除DPPH自由基有明显的效果。经分析,油莎豆粕水溶性多糖对DPPH自由基清除能力的IC50值为2.203 mg/mL,其IC50值小于10 mg/mL[21],说明油莎豆粕水溶性多糖具有较好的抗氧化效果。
2.4.2 油莎豆粕水溶性多糖对羟自由基清除能力的影响羟自由基是生物系统中最具活性的自由基,能导致生物体内DNA、蛋白质和脂质的氧化损伤,引发各种疾病,因此羟自由基的清除率是评价抗氧化性的重要指标[22]。油莎豆粕水溶性多糖对羟自由基清除能力的影响见图6。

图6 VC与油莎豆粕水溶性多糖对羟自由基清除能力的影响Fig.6 The scavenging effect of VCand water-soluble polysaccharides of Cyperus esculentus meals on hydroxyl radicals
由图6可以看出,油莎豆粕水溶性多糖在0.5mg/mL~1.5 mg/mL浓度范围内,羟自由基的清除率随着多糖浓度的升高而逐渐增大,当多糖浓度为0.5 mg/mL时,油莎豆粕水溶性多糖对羟自由基的清除率为30.0% ,浓度为1.5 mg/mL时,羟自由基清除率增大到98.0% ,与该浓度下VC对羟自由基的清除能力比较接近,可见油莎豆粕水溶性多糖对羟自由基有明显的清除效果。油莎豆粕水溶性多糖对羟自由基清除能力的IC50值为0.726 mg/mL。
2.4.3 油莎豆粕水溶性多糖对超氧阴离子自由基清除能力的影响
超氧阴离子自由基是生命代谢过程中产生的一种重要的自由基[23]。油莎豆粕水溶性多糖对超氧阴离子自由基清除能力的影响见图7。
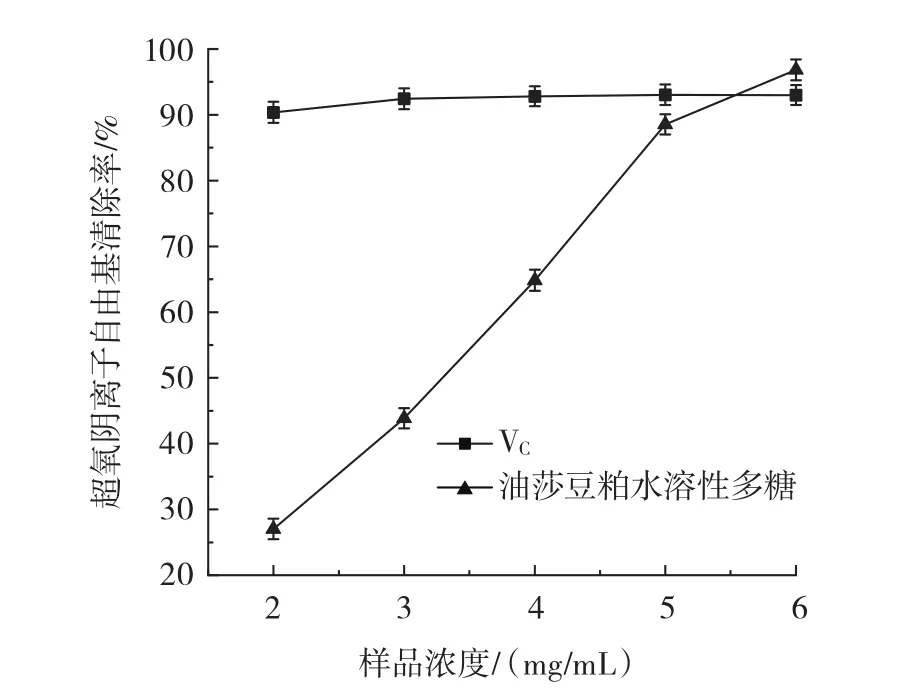
图7 VC与油莎豆粕水溶性多糖对超氧阴离子自由基清除能力的影响Fig.7 The scavenging effect of VCand water-soluble polysaccharide of Cyperus esculentus meals on superoxide anion radicals
由图7可以看出,VC对超氧阴离子自由基具有很强的清除能力,当VC浓度为2 mg/mL时,清除率已经达到90% 。与VC相比,油莎豆粕水溶性多糖的浓度在2 mg/mL~6 mg/mL时,其对超氧阴离子自由基的清除率随浓度增大而逐渐升高,从27% 上升到96.8% ,有明显的线性趋势。油莎豆粕水溶性多糖对超氧阴离子自由基清除能力的IC50值为3.228 mg/mL,对超氧阴离子自由基有较强的清除作用。
3 结论
本试验利用超声波辅助法提取油莎豆粕水溶性多糖,通过L9(33)正交试验优化提取工艺。结果表明,各因素影响油莎豆粕水溶性多糖提取率的大小顺序为料液比(A)>超声时间(B)>超声功率(C)。 油莎豆粕水溶性多糖的最佳提取工艺条件为料液比1∶30(g/mL)、超声时间6 min、超声功率450 W;在此工艺条件下,油莎豆粕水溶性多糖提取率为30.49% 。傅里叶变换红外光谱分析表明,油莎豆粕水溶性多糖具有典型的α-吡喃糖特征吸收峰。此外,抗氧化试验初步验证了油莎豆粕水溶性多糖对DPPH自由基、羟自由基以及超氧阴离子自由基具有较强的清除能力,IC50值分别为2.203、0.726、3.228 mg/mL。油莎豆粕水溶性多糖可以作为天然抗氧化剂应用于食品、医药等行业,具有一定的开发前景和应用价值。
