血清BG、GM在不同免疫状态下肺烟曲霉菌感染大鼠中的实验研究*
2022-08-24黄宛虹磨立达罗晓璐陈松林刘泽端
黄宛虹,磨立达△,罗晓璐,陈松林,刘泽端
1.南宁市第四人民医院/广西医科大学附属南宁市传染病医院/广西艾滋病临床治疗中心(南宁)检验科,广西南宁 530023;2.广西中医药大学第一附属医院检验教研室,广西南宁 530023
近年来,由于抗菌药物的广泛应用、恶性肿瘤发病率升高、器官移植术的开展、人类免疫缺陷病毒感染者增多、各种导管侵入性操作,以及免疫抑制剂、糖皮质激素的使用等导致肺部真菌感染发病率逐年增加,且关于免疫功能正常者患肺部真菌感染相关疾病的报道越来越多。免疫功能正常者感染烟曲霉菌的原因及机制均尚不明确,其中部分患者很可能存在某种潜在疾病,如恶性肿瘤[1-2],因此,明确不同免疫状态下肺烟曲霉菌感染的原因及机制是亟待解决的问题,而CD4+T细胞是目前公认的反映患者免疫力的指标,半乳甘露聚糖(GM)、(1,3)-β-D-葡聚糖(BG)在侵袭性肺烟曲霉菌病(IPA)中有较高的诊断价值,是诊断IPA的良好指标。故本研究通过构建不同免疫状态下肺烟曲霉菌感染的大鼠模型,动态分析血清BG、GM、白细胞计数(WBC)在肺烟曲霉菌感染中的水平变化,以明确免疫缺陷严重程度与肺烟曲霉菌感染的关系。
1 材料与方法
1.1材料来源 烟曲霉菌菌株购自中国科学院微生物研究所,编号3.15720。实验动物为BALB/c清洁级雄性SD大鼠150只,6~8周龄,体质量为280~320 g,购自浙江维通利华实验动物技术有限公司[SCXK(浙)2019-0001]。大鼠分组分笼饲养,每笼2只,清洁级环境,标准饲养,自由饮水。本研究符合动物实验要求,经过医院动物实验伦理审查。
1.2仪器与试剂 环磷酰胺和地塞米松购自Sigma 公司;沙保弱培养基购自广州迪景科技有限公司;生理盐水购自旭东海普药业有限公司;甲醛组织固定剂由中山市康乃欣生物医疗科技有限公司生产;苏木精-伊红染色剂由上海化学试剂有限公司生产;全自动细菌内毒素检测系统及其配套的BG检测试剂为湛江安度斯生物有限公司产品;嘉兴科瑞迪医疗器械有限公司生产的HB-300E全自动酶联免疫分析仪及丹娜生物科技有限公司生产的GM检测试剂;美国BD公司生产的FACSVia流式细胞仪及其配套试剂;日本SYSMEX公司生产的XT-2000i全自动血液分析仪及其配套试剂;德国徕卡公司生产的EG11504显微镜。所有试剂均于有效期内使用。
1.3方法
1.3.1培养基配制 1 g葡萄糖、1 g蛋白胨和0.5 g酵母提取物加入100 mL的蒸馏水中,混合均匀,分装至玻璃试管中,将松紧适宜的棉塞塞进试管,牛皮纸包扎灭菌。
1.3.2烟曲霉菌孢子悬液的制备 将烟曲霉菌株冻干粉用液体培养基复活后,取30 μL移植于含液体培养基的试管中,28 ℃培养5 d,孢子悬液转入15 mL离心管中,3 000 r/min离心15 min,去除上清液,孢子重悬在生理盐水中,调整孢子悬液浓度为1×107CFU/mL。
1.3.3实验分组及模型构建 将150只大鼠均分为以下6组:组1为正常对照组;组2为低剂量免疫抑制组;组3为高剂量免疫抑制组;组4为正常状态感染组;组5为低剂量免疫抑制感染组;组6为高剂量免疫抑制感染组。组1、组4连续注射生理盐水3 d,组2、组5连续注射地塞米松0.3 mg/kg+环磷酰胺37.5 mg/kg 3 d,组3、组6连续注射地塞米松0.6 mg/kg+环磷酰胺75 mg/kg 3 d;第4天、第5天组1、组2、组3经鼻滴生理盐水,组4、组5、组6经鼻滴1×107CFU/mL孢子悬液;各组将实验开始第6天定义为感染1 d,在感染1、3、5、7、9 d这5个时间点分别处死1/5大鼠取肺组织及血液标本。
1.3.4实验室指标检测 通过酶联免疫吸附试验的竞争法检测GM水平,光度法检测BG水平,全自动全血五分类法检测WBC、中性粒细胞计数(NEUT)。流式细胞计数:取 100 μL大鼠抗凝全血,加入相应水平抗体,避光孵育 30 min,加入红细胞裂解液,混匀后避光静置10 min,离心弃上清液,加入 500 μL磷酸盐缓冲液(PBS),离心弃上清液,重复洗涤两次。加500 μL流式上样缓冲液重悬后,用流式细胞仪分析CD4+T细胞水平。
1.3.5肺组织真菌培养及病理组织检查 所有大鼠自实验开始每天均观察一次至实验结束,实验中大鼠死亡后或麻醉处死大鼠后,于无菌条件下取出完整肺组织,左肺用40%甲醛溶液固定,石蜡包埋切片,苏木精-伊红染色法(简称HE染色法 )染色,光镜下观察。右肺采用5 mL 0.9%氯化钠注射液漂洗后,用300目筛网过滤,制成悬液,加1 mL 0.9%氯化钠注射液稀释,取0.2 mL接种于沙保弱琼脂培养基斜面,置于28 ℃温箱培养4 d,观察结果。
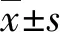
2 结 果
2.1实验动物的一般状况 组1饮水、进食、活动无明显异常,体质量每天增加约7 g,无死亡;组2饮水、进食、活动先减少后增加,体质量在感染1~5 d每天减轻约8 g, 感染6~7 d未见明显改变,到感染9 d时增加约6 g,全程均无死亡;组3饮水、进食、活动减少,体质量在感染1~7 d每天减轻6~10 g,感染9 d时体质量未见改变,全程均无死亡;组4一般情况同组1;组5饮水、进食、活动减少,精神萎靡,体质量在感染1~5 d每天减轻约10 g,感染6~7 d未见明显改变,到感染9 d时增加约5 g,感染8 d时有1只出现尿血,全程均无死亡;组6饮水、进食、活动减少,毛无光泽、蜷缩、颤抖,体质量每天减轻9~10 g,在感染8~9 d时1只血便,2只死亡。
2.2不同免疫状态下烟曲霉菌感染大鼠外周血NEUT动态分析 在感染1 d时,组2、组5、组3、组6 NEUT均不同程度降低,特别是组3、组6 NEUT<0.10×109/L,达到NEUT缺乏标准,且与组1比较,NEUT明显降低,差异有统计学意义(P<0.05)。组6感染9 d 时NEUT较该组其他时期明显升高,差异均有统计学意义(P<0.05),且与同时期组1比较,差异有统计学意义(P<0.05)。见表1。

表1 不同免疫状态下烟曲霉菌感染大鼠NEUT动态分析
2.3不同免疫状态下烟曲霉菌感染大鼠外周血WBC动态分析 与组1比较,感染1~7 d 时,组3、组6 WBC明显降低,而组4 WBC在感染1~5 d明显升高,差异有统计学意义(P<0.05),但到感染7 d及以后组1和组4 WBC比较,差异无统计学意义(P>0.05)。组3和组6在感染1 d 时WBC均处于极低水平,感染3 d时升高,至感染9 d时较前面几天明显升高,达正常或高水平,组3和组6同组中其他时期WBC与感染9 d时比较,差异有统计学意义(P<0.05)。见图1、表2。

图1 不同免疫状态下烟曲霉菌感染大鼠WBC动态图

表2 不同免疫状态下烟曲霉菌感染大鼠WBC动态变化分析
2.4不同免疫状态下烟曲霉菌感染大鼠免疫细胞动态分析 同时期组间CD4+T细胞水平比较,感染7 d 时,组1与组4比较,差异有统计学意义(P<0.05);组2与组5比较,除在感染7 d 时差异无统计学意义(P>0.05),其余各时期比较,差异均有统计学意义(P<0.05);而各时期组3与组6比较,差异有统计学意义(P<0.05)。在组内不同时期CD4+T细胞水平比较中,组2感染1、3、5 d 低于感染7、9 d,差异有统计学意义(P<0.05),感染3 d 明显低于感染1 d,差异有统计学意义(P<0.05);组3感染3 d达低值,与其他时期比较,差异有统计学意义(P<0.05),感染5 d明显低于感染7 d,差异有统计学意义(P<0.05);组4感染7 d达低值,明显低于感染1、 3、5、9 d,差异有统计学意义(P<0.05);组5感染3 d明显低于其余时期,差异有统计学意义(P<0.05);组6感染3、5、7、9 d比感染1 d时明显降低,差异有统计学意义(P<0.05)。不同免疫状态下大鼠吸入烟曲霉菌后CD4+T细胞水平变化不同,达到低值的时间不同,组4在感染7 d CD4+T细胞水平达低值,组5在感染3 d 时达低值,组6在感染5 d 时达低值。见表3。

表3 不同免疫状态下烟曲霉菌感染大鼠CD4+T细胞水平动态分析个/微升)
2.5不同免疫状态下烟曲霉菌感染大鼠GM、BG水平动态分析 组内各时期GM水平比较,组4感染3 d分别与组内其他时期比较,GM水平明显升高,差异有统计学意义(P<0.05);组5感染1 d与感染9 d比较,差异无统计学意义(P>0.05),感染1、5、7、9 d与感染3 d比较,差异有统计学意义(P<0.05);组6中,GM水平从感染3 d起均明显高于感染1 d,差异有统计学意义(P<0.05),其余组内各时期比较,差异无统计学意义(P>0.05)。感染3 d 时组4 GM水平较组1明显升高,差异有统计学意义(P<0.05);感染5 d时,组5 GM水平较组2明显升高,差异有统计学意义(P<0.05);感染1~9 d,组6 GM水平较组3明显升高,差异有统计学意义(P<0.05)。见表4。组6有3只大鼠在感染9 d时BG>100 pg/mL,而BG水平在各组各时期比较,差异无统计学意义(P>0.05)。见表5。

表4 不同免疫状态下烟曲霉菌感染大鼠GM水平动态分析
2.6不同免疫状态下烟曲霉菌感染大鼠肺组织培养与病理表现 组4与组5在感染3 d 时部分培养阳性,到感染9 d时再无真菌生长;而组6肺组织在感染1、3、5、7、9 d时培养阳性,烟曲霉菌菌落呈烟绿色;光镜下,组1大鼠肺泡结构完整,肺泡间隔无增宽,肺间质无明显水肿,肺泡腔内无炎症细胞及液体渗出(图2A);组2、组3可见轻至中度肺泡支气管水肿,组4可见轻度的弥漫性肺水肿,上述3组均可见中性粒细胞浸润、出血等病理改变(图2B、C、D);组5、组6较组4肺部病变程度加重,病变程度随着免疫抑制剂剂量的增加呈明显加重,呈现较明显的剂量依赖性,且随着给药时间的增加,病变程度呈明显加重趋势,时间依赖性较强(图2E、F)。组2、组3、组5感染9 d时病理改变持续存在。

表5 不同免疫状态下烟曲霉菌感染大鼠BG水平动态分析或M(P25,P75),pg/mL]

注:A、B、C、D、E、F分别为组1、组2、组3、组4、组5、组6感染5 d 时肺组织病理图。
3 讨 论
肺烟曲霉菌感染是一种严重的机会性感染,在机体免疫力低下时,容易经呼吸道吸入烟曲霉菌而引起感染。正常情况下人体吸入少量烟曲霉菌不致病,但近年来免疫轻度受损者感染烟曲霉菌的情况越来越多[3-5]。发生肺烟曲霉菌感染患者的免疫状态有所不同,约18%无基础肺疾病[6-7]。非粒细胞缺乏的肺烟曲霉菌感染患者中,约19%无任何潜在疾病,并且非严重免疫缺陷患者的病死率不低于严重免疫缺陷患者[8-9]。本研究中,组4与组5在感染3 d时GM水平有一过性升高,考虑出现该结果与烟曲霉菌进入大鼠体内初期阶段,机体免疫屏障未能短时间内清除病原菌有关,但在感染5 d后逐渐恢复正常。在大鼠吸入烟曲霉菌后,机体免疫对其作出反应,不同免疫状态下CD4+T细胞水平变化不同,组4大鼠机体在抵抗烟曲霉菌感染,机体清除烟曲霉菌后即感染7 d时有一过性的免疫力降低状态,而后则恢复正常;组5前期受到免疫抑制及烟曲霉菌感染的双重作用,在感染3 d时免疫力最低,表现为CD4+T细胞水平最低,而后CD4+T细胞水平升高但在感染9 d时又降低,考虑为机体免疫力与病原菌相互作用产生的结果;组6 CD4+T细胞水平达低值的时间比组1早,且比组5的轻度免疫抑制大鼠晚,分析原因为由于免疫抑制严重,机体在烟曲霉菌入侵时未能在短时间内清除病原菌,导致烟曲霉菌感染,从而使机体免疫力进一步降低,因此表现为CD4+T细胞在感染5、7 d时处于低水平,感染9 d时有所回升,考虑为免疫抑制剂作用减弱引起。早期研究中烟曲霉菌可诱导树突状细胞产生曲霉特异性T细胞,且曲霉特异性T细胞过继免疫疗法可使造血干细胞移植受者产生特异性免疫应答反应,同时形成长期的抗真菌保护作用,说明免疫力在肺烟曲霉菌感染中发挥重要作用[10-12]。同时免疫力正常或轻度受损者在肺烟曲霉菌入侵时的病理机制变化及转归引起了学者们的重视,本研究推荐在构建大鼠模型进行相关机制的研究时选择感染后5~7 d的大鼠为佳。
本研究中组4 WBC在感染1~5 d时明显升高,到感染9 d 时恢复正常水平,组4与组5 GM水平在感染3 d时明显升高,其他时期相对正常,考虑这两组在感染3 d 时机体与烟曲霉菌相互作用,原始CD4+T细胞水平较高,免疫力相对正常,在烟曲霉菌入侵时,血液中的单核-巨噬细胞和中性粒细胞系统能够立即识别病原菌,启动Toll样受体等信号转导通路,引起感染部位中性粒细胞和单核-巨噬细胞聚集,并释放细胞因子及趋化因子,吞噬并杀灭烟曲霉菌[13-15];也正因为对烟曲霉菌的抵抗作用,导致组4 CD4+T细胞水平降低并在感染7 d或感染3 d 时达低水平后又逐渐升高。在真菌培养中,组4和组5感染3 d 时培养出真菌,但到感染9 d 时再无真菌生长,同时组4 肺组织显示轻度的弥漫性肺水肿、中性粒细胞浸润等病理改变,而组2、组3、组5肺组织均表现为轻至中度肺泡支气管水肿、炎症细胞浸润等病理改变,到感染9 d 时病理改变持续存在,可见机体的免疫反应仍对肺组织产生了一定损伤[16]。
组6中由于使用了高剂量免疫抑制剂,WBC、NEUT在感染1~3 d 普遍较低,处于粒细胞缺乏状态,CD4+T细胞水平在感染5 d 时低于50个/微升,使得机体在烟曲霉菌入侵时不能及时发挥作用,导致烟曲霉菌增殖,表现为肺组织烟曲霉菌培养阳性及GM水平自感染3 d 起较组1明显升高,组织病理表现为肺泡壁毛细血管充血明显,片状的肺泡腔内可见蓝紫色颗粒状的渗出物,存在少量炎症细胞浸润,以单核-巨噬细胞为主并伴少量中性粒细胞浸润。随着免疫抑制剂对血液系统骨髓抑制作用的减弱,大鼠血液NEUT升高,在感染9 d 时,组6 WBC、NEUT明显高于组1,CD4+T细胞仍处于低水平,提示烟曲霉菌感染的发生。该研究结果与李志云等[17]的研究结果一致。GM保持高水平,真菌培养阳性,大鼠肺组织炎症反应进一步发展,肺组织大量弥漫性出血、水肿,正常肺泡结构消失,提示在免疫抑制作用消失后,一方面烟曲霉菌的侵袭作用和毒素对肺组织结构进一步破坏,造成肺组织坏死,另一方面高水平的免疫反应进一步造成肺组织的病理损伤[18-19]。据报道,血液BG水平升高出现较迟,主要用于疾病监测[20],本研究中仅组6在感染9 d 时有3只大鼠BG>100 pg/mL,与赵勇等[21]研究结果有一定差距,分析可能与试剂的灵敏度、临界值、标本量等有关,具体原因有待进一步研究。
综上所述,免疫力正常或轻度受损者感染烟曲霉菌后,GM水平表现为一过性升高,但仍有肺组织病理损伤,重度免疫抑制者受烟曲霉菌侵入及增殖的影响,GM水平持续增高,肺组织损伤明显加重,可见不同免疫状态可影响肺烟曲霉菌感染的发展和转归。
