CIK细胞对裸鼠人肝癌移植瘤生长的抑制作用
2022-08-24冯虎翼余福财陈元文
吴 念,冯虎翼,刘 桦,曹 阳,余福财,陈元文
重庆市第五人民医院肝胆胰甲乳外科,重庆 400062
肝癌不仅恶性程度高,还具有起病隐匿的特点,大部分患者就诊时已经是中晚期,因此其也是目前临床治疗较为困难的疾病之一。 虽然肝部分切除、肝移植、介入栓塞全身化疗是目前治疗肝癌的主要方法,但治疗后肝癌复发转移仍十分常见,且中晚期肝癌患者免疫力低下,临床治疗效果差。寻找新的治疗方法对改善终末期肝癌患者的生活质量,提高其生存率有重要意义。近年来,生物免疫治疗已成为一种新的治疗肿瘤的方法,并逐渐受到研究者的重视,其有较高的抑瘤率,被认为是最有前景的中晚期肝癌治疗方法之一[1-3]。细胞因子诱导的杀伤细胞(CIK细胞)是通过γ干扰素 (IFN-γ)、抗CD3单克隆抗体和白细胞介素(IL)-2与外周血单个核细胞在体外扩增和激活的T淋巴细胞,是一群异质的免疫活性细胞,同时表达CD3和CD56两种膜蛋白分子,兼有自然杀伤细胞(NK细胞)非主要组织相容性复合体(MHC)限制杀瘤特点和T淋巴细胞的强大抗瘤活性,不仅可通过非特异性免疫杀伤作用消除肿瘤患者体内的微小残留病灶,还可以调节和增强机体的免疫功能[4-8]。本研究通过观察CIK细胞静脉注射对裸鼠人肝癌移植瘤生长的抑制作用,旨在为肝癌的生物免疫治疗提供实验依据。
1 材料与方法
1.1标本来源 BALB/c裸鼠,雄性,4~5周龄,16~18 g,32只,购自中国医学科学院医学实验动物研究所(京)[2009-0004]。SMMC-7721人肝癌细胞由重庆医科大学感染分子病学重点实验室惠赠。
1.2仪器与试剂 RPMI-1640培养基、胎牛血清购自美国HyClone公司,DeadEndTM比色法凋亡检测系统购自美国Peomage公司,检测T淋巴细胞亚群的相关抗体购自美国BD公司,抗CD3单克隆抗体购自北京军事医学科学院,Ki-67购自北京中杉金桥生物技术有限公司,重组人白细胞介素2(rhIL-2)、重组人γ干扰素(rhINF-γ)购自北京双鹤药业有限公司,人外周血淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司,BriCyte E6流式细胞仪购自深圳迈瑞公司。
1.3细胞培养
1.3.1SMMC-7721人肝癌细胞培养 SMMC-7721人肝癌细胞常规培养于含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、含5%CO2的饱和水蒸气培养箱中培养,隔天对指数增生期的细胞进行传代。取对数生长期的培养细胞,用0.25%的胰酶消化、离心、生理盐水重悬后,对细胞悬液进行计数及台酚蓝染色,当细胞活力达95%以上时,调整细胞浓度后接种于裸鼠皮下。
1.3.2CIK细胞制备 采集健康志愿者外周血30 mL,经人淋巴细胞分离液密度梯度离心后获得外周血单个核细胞,用磷酸盐缓冲液(PBS)洗涤2次,置于含10%胎牛血清的RPMI-1640培养基中,调整细胞浓度至1×106个/毫升,加入rhINF-γ(1 000 U/mL),24 h后加入抗CD3单克隆抗体(50 ng/mL)、rhIL-2(500 U/mL),以后每3天补加新鲜培养基,并补加rhIL-2(500 U/mL),第14天行流式细胞术(FCM)检测CIK细胞表型,CD3+CD56+CIK细胞达20%以上为合格。
1.4动物模型建立及分组实验 将对数生长期的SMMC-7721人肝癌细胞(2×106个/毫升)以每只0.2 mL,种植于32只BALB/c裸鼠右侧背部皮下,约第4天成瘤,成瘤率约95%,第10天移植瘤最大径达0.4~0.5 cm,将其中30只合格的模型裸鼠随机分为CIK细胞组(A组)、空白对照组(B组),每组15只。A组给予尾静脉注入3×107个检测合格的CIK细胞,每周1次,共4次;B组不予处理。
1.5观察指标及检测方法
1.5.1肿瘤生长情况 在治疗前及治疗开始后每4天测量肿瘤的最大纵径(a)及最大横径(b),计算肿瘤体积(V),V=a×b2/2,观察肿瘤的生长情况。治疗至第32天时,计算CIK细胞抑瘤率,抑瘤率=(B组肿瘤平均体积-A组肿瘤平均体积)/B组肿瘤平均体积×100%。
1.5.2病理组织学检查 在治疗第32天处死所有裸鼠,取肿瘤组织,立即用4%的多聚甲醛浸没,常规制备石蜡包埋切片,进行苏木精-伊红染色(HE染色),光学显微镜下观察肿瘤组织病理改变。
1.5.3免疫组织化学法检测肿瘤组织Ki-67蛋白表达 瘤块固定、石蜡包埋、切片、脱蜡、过氧化氢封闭,微波修复抗原。肿瘤组织切片滴加Ki-67一抗,湿盒中过夜,加二抗,二甲基联苯胺(DAB)染色。用已知阳性标本作为阳性对照,用PBS代替一抗作为阴性对照。阳性表现为细胞核为棕黄色或棕褐色,并呈颗粒状,背景为紫蓝色。用专业图像分析软件(Image-Pro Plus6.0)分析阳性程度。
1.5.4脱氧核苷酸末端转移酶介导的dUTP缺口末端标记(TUNEL)法检测肿瘤细胞凋亡 采用TUNEL法检测肿瘤细胞凋亡情况,石蜡包埋、切片、脱蜡、过氧化氢封闭,按TUNEL试剂盒说明书分别加入b-11-DUTP、TDT、Streptavidin-HRP,DAB显色,苏木精复染,以PBS代替TUNEL反应液为阴性对照。阳性表现为细胞核为棕黄色或棕褐色,背景为紫蓝色。用专业图像分析软件(Image-Pro Plus6.0)分析阳性程度。
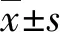
2 结 果
2.1CIK细胞表型鉴定 体外将外周血单个核细胞培养14 d后,细胞总量扩增约20倍,CD3+、CD3+CD56+、CD3+CD8+效应细胞亚群的比例明显增高,分别由最初的58.0%、6.7%、24.6%上升至93.5%、41.7%、43.0%。经FCM检测,CIK细胞中CD3+CD56+CIK细胞比例达41.7%,合格,见图1。

图1 CIK细胞FCM检测图
2.2病理组织学检查结果 光镜下A、B组均可见不同程度的肿瘤细胞结构和数量改变。A组肿瘤细胞排列松散,肿瘤细胞内部发生核固缩,细胞质减少,嗜酸性增强;B组肿瘤细胞生长活跃,排列紧密,核大深染,有较多核分裂象,呈增殖样改变,见图2。

注:A为A组;B为B组。
2.3CIK细胞抑制裸鼠人肝癌移植瘤生长 治疗前,A、B组肿瘤体积比较,差异无统计学意义(P>0.05)。从治疗第4天开始,A组肿瘤体积增长慢于B组,12 d以内两组肿瘤体积增长趋于缓慢,12 d以后,两组肿瘤体积增长明显加快,但A组肿瘤体积增长明显慢于B组,至第32天时,A组肿瘤体积明显小于B组,差异有统计学意义(P<0.05),见图3和表1。治疗至第32天时,CIK细胞抑瘤率为43.06%。

图3 两组肿瘤生长曲线

表1 两组治疗前后肿瘤体积比较
2.4免疫组织化学法检测肿瘤组织Ki-67蛋白表达结果 A组Ki-67蛋白阳性细胞相对较少,染色较浅,大多为棕黄色,B组Ki-67蛋白阳性细胞多,染色较深,大多为棕褐色,见图4。A组肿瘤组织Ki-67蛋白表达的吸光度值为0.68±0.11,低于B组的0.80±0.11,差异有统计学意义(P<0.05)。

注:A为A组;B为B组。
2.5TUNEL法检测肿瘤细胞凋亡结果 A组凋亡细胞明显增多,染色深,呈棕黄色,B组凋亡细胞数量较少,染色呈棕褐色,见图5。A组凋亡细胞的吸光度值为0.52±0.05,明显高于B组的0.40±0.05,差异有统计学意义(P<0.05)。
3 讨 论
生物免疫治疗是利用机体的免疫机制,通过主动或被动的方式增强机体的免疫功能,从而达到杀伤肿瘤的目的。CIK细胞是一类新型的免疫活性细胞,具有强大的抗瘤活性和限制性非特异性杀瘤特点。以CIK细胞为代表的生物免疫治疗正逐渐成为中晚期肿瘤治疗的重要手段之一[7-8]。为明确CIK细胞免疫治疗对肝癌的抑制作用,本研究进行了相关探讨。
首先,建立裸鼠人肝癌移植瘤模型是本研究的基础。用BALB/c裸鼠建立动物模型,背部皮下接种SMMC-7721人肝癌细胞,便于观察移植瘤生长且成瘤率较高,方便实验操作,同时SMMC-7721人肝癌细胞具有人源性,符合实验要求。本研究采用FRANCESSCHTTI等[9]推荐的方法,从健康人外周血中提取单个核细胞,成功诱导高比例CD3+CD56+表型的CIK细胞。通过尾静脉注射的方法将具有免疫活性的CIK细胞注入裸鼠体内,可较好的模拟机体内环境。从CIK细胞治疗的第4天开始,A组肿瘤体积增长较B组慢,治疗12 d后,B组肿瘤体积增长明显加快,且明显快于A组。治疗至32 d时,CIK细胞的抑瘤率高于40%,提示CIK细胞治疗对裸鼠移植瘤有效,疗效较KIM等[10]的研究结果稍差,其研究的抑瘤率达60%,这可能与动物模型的个体差异或诱导试剂的质量差异有关。类似结果在CIK细胞抑制其他肿瘤生长的研究中也有报道[11-12]。
CIK细胞保留了少数效应记忆T淋巴细胞亚群的特征,具有抗肿瘤细胞毒性。CIK细胞同时表达几种NK细胞表面标记物。由于存在功能性T淋巴细胞受体(TCR)和NK细胞分子,CIK细胞具有双重性质,其抗肿瘤活性可追溯到NK样结构[DNAX-辅助分子-1(DNAM-1)、NK细胞活化受体2D(NKG2D)、NK细胞p30相关蛋白(NKp30)和CD56],具体作用机制主要为以下几方面:一方面,体外高度扩增的CIK细胞中CD3+CD56+免疫活性细胞所占比例高,其通过释放颗粒酶、穿孔素等细胞毒性物质可以溶解肿瘤细胞,起到直接杀瘤作用。CIK细胞兼有细胞毒活性的T淋巴细胞抗原α/β受体(TCR-α/β),TCR-α/β在细胞外可有效刺激易感的肿瘤靶细胞,并与其相结合,释放有溶瘤作用的胞质颗粒。另一方面,CIK细胞表面可大量表达NKG2D,NKG2D可与多种肿瘤细胞表达的应急诱导蛋白[可溶性MHC-I类分子相关蛋白(MIC)-A/B]和总UL16结合蛋白(ULPB)等相互识别,通过与非限制性MHC配体(NKG2D配体)结合,发挥抗肿瘤作用[6,13]。最后,活化的CIK细胞亦可产生大量细胞因子(INF-γ、IL-6、肿瘤坏死因子α、粒细胞巨噬细胞刺激因子、IL-2),这些活化的细胞因子具有调节机体免疫系统功能或抑制肿瘤生长的作用[14]。
Ki-67是一种增殖细胞相关抗原,其功能与有丝分裂密切相关,在细胞周期G1、S、G2和M期出现,半衰期较短,可准确反映肿瘤细胞的增殖活性。本研究检测了两组肿瘤组织Ki-67蛋白的表达情况,结果发现,A组Ki-67蛋白表达的吸光度值显著低于B组(P<0.05),提示A组移植瘤中处于增殖状态的肿瘤细胞少,表明CIK细胞可显著抑制肿瘤细胞增殖。对移植瘤组织的原位凋亡检测发现,A组凋亡细胞吸光度值明显高于B组(P<0.05),提示CIK细胞可诱导肿瘤细胞凋亡。CIK细胞不但可以表达Fas,也可以表达Fas配体(FasL),其FasL与肿瘤细胞的Fas相结合,诱导肿瘤细胞凋亡;活化的CIK细胞还能促使肿瘤细胞凋亡基因(如Survivin、DAD1、Bcl-xL、Bcl-2基因)的表达上调,诱导肿瘤细胞的凋亡或坏死[13-15]。
综上所述,本研究在体外动物模型中证实了CIK细胞既可抑制肿瘤细胞增殖,又可诱导肿瘤细胞凋亡。CIK细胞免疫治疗将能以“优势互补”的方式参与到肝癌综合治疗中,有望成为中晚期肝癌治疗的有效方法之一。
