外泌体lncRNA在肝细胞癌中的作用*
2022-08-24综述师迎旭审校
郭 鑫,杜 华 综述,师迎旭,3△ 审校
1.内蒙古医科大学第一临床医学院,内蒙古呼和浩特 010050;2.内蒙古医科大学基础医学院,内蒙古呼和浩特 010050;3.内蒙古医科大学附属医院检验科,内蒙古呼和浩特 010050
肝细胞癌(HCC)是最常见的原发性肝癌,在中国,HCC发病率、病死率分别位于恶性肿瘤的第6位和第3位[1]。HCC发生的具体病因尚未明确,其主要危险因素包括乙型/丙型肝炎病毒感染、酗酒、非酒精性脂肪性肝炎等[2]。恶性肿瘤严重影响人类的健康,由于恶性肿瘤的发病机制复杂、进展迅速且不易早期诊断,因此,当前恶性肿瘤的早期诊断、精准诊疗成为研究热点。肿瘤的发生、发展依赖于肿瘤细胞和肿瘤微环境之间的相互作用,除了细胞间接触和释放可溶性因子的途径外,肿瘤细胞还可以通过外泌体与肿瘤微环境进行交流。研究发现,肿瘤源性外泌体携带的内容物DNA、微小RNA(miRNA)和长链非编码RNA(lncRNA)等分子反映了起源于肿瘤细胞的基因或信号变化[3]。lncRNA在各种恶性肿瘤中被解除调控,且与恶性肿瘤的进展密切相关。已有研究证实,lncRNA是HCC的原癌基因/抑癌基因[4]。HCC来源的外泌体lncRNA被发现在HCC增殖、转移、血管生成、诊断、治疗、预后中都发挥重要作用。外泌体lncRNA成为近年来的研究热点,有广泛的应用前景。本文综述了HCC分泌的外泌体lncRNA对肿瘤微环境及HCC细胞生物学特性的调节作用,以期为临床研究HCC的发病机制、诊治方法提供参考。
1 外泌体概述
外泌体是一种可以被大多数细胞分泌的微小膜泡,具备脂质双分子层结构,直径30~150 nm,属于细胞外囊泡(EVs)的亚群。外泌体经胞外刺激、微生物攻击或其他应激条件诱导产生[5]。目前普遍认为,外泌体的产生始于细胞膜内陷形成早期内体,随后早期内体膜向内出芽形成多囊泡体(MVB),即晚期内体。最终,在内体转运分选复合物(ESCRT)及特定蛋白质的调控下,MVB分泌到胞外形成外泌体(图1)。由细胞释放到胞外的外泌体存在于多种体液中,如血浆、血清、尿液和鼻分泌物等[6]。外泌体内包含蛋白质、DNA、信使RNA(mRNA)、miRNA、lncRNA等分子,可作为信号分子传递给受体细胞,参与细胞间通讯和微环境的调节[7]。因此,调控lncRNA的表达可能成为治疗肿瘤的一种新策略。同时,由于外泌体存在于相对独立的环境中,比组织或体液中自由存在的肿瘤生物标志物具有更高的稳定性,这一特点使外泌体有成为肿瘤生物标志物的潜能。
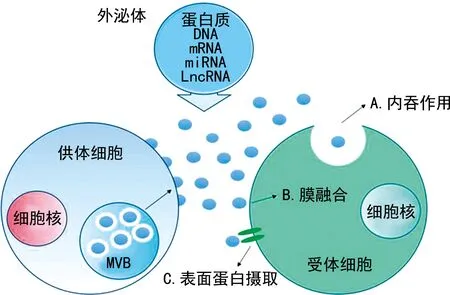
图1 外泌体形成和被靶细胞摄取
2 外泌体lncRNA在HCC中的作用
lncRNA是一类长度不小于200 nt的非编码RNA,肿瘤来源的外泌体lncRNA可作为肿瘤细胞间协调细胞功能的信号媒介。lncRNA在维持细胞生命活动中发挥重要作用。lncRNA不可编码蛋白质,但其在表观遗传、转录前、转录中、转录后的基因表达调控中发挥重要作用[8]。lncRNA主要通过以下3种方式来发挥调控作用:(1)lncRNA作为竞争性内源RNA(ceRNA)调节miRNA表达;(2)lncRNA与蛋白质相互作用;(3)lncRNA直接与细胞核DNA结合发挥作用。虽然关于lncRNA的研究较多,但目前对lncRNA的种类、数量和功能仍了解较少。lncRNA的失调在调控原癌基因和抑癌基因中起主要作用[9]。近年来,HCC细胞分泌的外泌体lncRNA异常表达也逐渐被发现,且其对HCC的发生、发展有极大影响[10-18],见表1。

表1 不同外泌体lncRNA对HCC发生、发展的影响
2.1外泌体lncRNA对HCC细胞增殖、转移的影响 HCC细胞因具有高增殖、转移能力而导致肿瘤相关死亡。尽管如此,由于缺乏对HCC细胞增殖、转移的完全了解,影响了HCC的治疗研究进展。lncRNA对肿瘤细胞的增殖、侵袭、迁移能力均有调节作用[19]。HUANG等[10]研究发现,HCC源性外泌体中lnc85特异性升高,对HCC细胞的增殖、迁移过程有重要调控作用,lnc85可靶向结合miR-324-5p(一种肿瘤抑制因子),导致miR-324-5p失调而促进HCC细胞增殖、转移。WANG等[12]发现,lncRNA SENP3-EIF4A1可通过外泌体从正常细胞传递至HCC细胞,降低HCC细胞的增殖和迁移能力,从而抑制HCC的体内外进展。CAO等[11]研究发现,lncRNA HULC在HCC组织、HCC患者血清中高表达,且lncRNA HULC在HCC源性外泌体中的表达与肿瘤TNM分期相关。lncRNA HULC作为海绵分子负向调控miR-372-3p介导的对Rab 11a的抑制作用,从而促进HCC发生、发展,这一发现为lncRNA HULC在HCC中的作用机制研究提供了新的依据。外泌体lncRNA SENP3-EIF4A1通过竞争性结合miR-9-5p,促进ZFP36表达,抑制HCC细胞的增殖、转移[12]。
此外,肿瘤的增殖、转移同时受肿瘤细胞和肿瘤微环境的双重调节[20]。研究证明,肿瘤细胞在肿瘤发生、发展过程中会释放外泌体[21]。肿瘤源性外泌体可以通过分泌活性分子(mRNA、miRNAs、lncRNA、蛋白质等)调节肿瘤微环境,进而影响肿瘤的发生、发展。外泌体的分泌是一个多分子调控的复杂过程,涉及MVB的运输、与质膜对接和融合[22]。lncRNA在HCC分泌外泌体的过程中起关键作用,YANG等[13]发现,lncRNA HOTAIR可以诱导MVB向质膜转运,通过调控RAB35的表达和定位来控制MVB与质膜的对接过程。此外,lncRNA HOTAIR还可以影响VAMP3和SNAP23的共定位和活性,促进MVB与质膜融合,达到促进HCC分泌外泌体的目的,这个发现证实了lncRNA具有促进肿瘤分泌外泌体的新功能,也为肿瘤lncRNA的研究提供了新思路。
2.2外泌体lncRNA对HCC免疫系统的影响 肝脏被称为“免疫特惠器官”,其内含有较多的白细胞,包括肝巨噬细胞、自然杀伤细胞等,所以肝细胞更易被诱导为免疫耐受状态(耐受原性)。lncRNA在天然免疫或获得性免疫中均发挥着重要作用,包括对免疫系统的激活和稳态的调节。正常情况下,机体的免疫系统可以识别并清除肿瘤细胞,但HCC源性外泌体lncRNA可介导机体产生免疫耐受。巨噬细胞是机体天然免疫中的关键角色,是肿瘤微环境的参与者。在受到肿瘤微环境刺激后,巨噬细胞可极化为M1促炎型和M2抗炎型两种表型,这两种表型可在不同的肿瘤微环境下动态地进行相互转换[23]。LI等[14]研究发现,HCC来源的外泌体中富含lncRNA TUC339,可介导HCC细胞与周围环境中巨噬细胞的信号传导。HCC源性外泌体lncRNA TUC339被肿瘤微环境中的巨噬细胞摄取后,可促进巨噬细胞向M2抗炎型转化,从而抑制促炎细胞因子[如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6、IL-12]产生,介导HCC细胞免疫逃避(抑制机体的免疫反应),此发现为肿瘤和免疫细胞之间的相互作用研究提供了新的思路,揭示了HCC治疗的新靶点。FAN等[15]研究表明,HCC细胞外泌体lncRNA PCED1B-AS1被受体HCC细胞摄取后,可以靶向miR-194-5p,促进PD-Ls的表达,继而抑制T淋巴细胞和巨噬细胞功能,诱导HCC免疫抑制。因此,lncRNA PCED1B-AS1是一种潜在的HCC治疗靶点。
2.3外泌体lncRNA对HCC血管生成的影响 肿瘤血管生成是指肿瘤组织形成新血管的过程。血管生成有利于肿瘤细胞获得充足的氧气和营养物质,是促进肿瘤发生、发展的关键。血管生成是一个极其复杂的过程,受肿瘤细胞或肿瘤微环境的诱导等因素调节,涉及肿瘤细胞、内皮细胞、肿瘤微环境之间的相互作用。由于肿瘤组织中未成熟的血管受到周围肿瘤细胞的压迫,导致生成的血管畸形、曲折。肿瘤血管往往表现为血流混乱,且血管内皮细胞之间连接松散,有高度的渗漏性和通透性,这一特性有助于肿瘤细胞进入血管,随血液远处转移。目前,抗HCC血管生成已经成为一种治疗策略,较多学者开始深入研究HCC的血管生成过程。lncRNA对肿瘤血管生成有促进和抑制的双重作用,外泌体lncRNA参与肿瘤细胞间、细胞间质间的物质运输和信号传导。HCC分泌的外泌体lncRNA参与HCC血管生成。LI等[16]研究发现,lncRNA SNHG16/miR-4500/GALNT1轴在体外、体内外泌体介导的肿瘤血管生成中发挥重要作用。
目前,关于HCC源性外泌体miRNA促进和抑制肿瘤血管生成的研究很多,但外泌体lncRNA对HCC血管生成的影响研究极少,其参与HCC发生、发展的具体机制也不明确,仍需大量研究来进一步验证。
2.4外泌体lncRNA对HCC治疗药物疗效的影响 HCC的治疗手段包括手术治疗、放疗、化疗、中医治疗等,这些方法可以有效控制原发灶,抑制肿瘤生长。化疗药物治疗是一种重要的HCC治疗手段。目前,有很多针对HCC的化疗药物,但耐药性是影响疗效的重要因素。索拉非尼和阿霉素是常规的HCC全身或局部化疗药物,HCC对其有很强的耐药性[24]。为了更好地治疗HCC,研究HCC先天或获得性耐药的具体机制是非常必要的。肿瘤耐药细胞分泌的外泌体可以通过传递lncRNA向敏感细胞传递耐药性[25]。TAKAHASHI等[17]研究发现,TGF-β可以降低HCC细胞对索拉非尼/阿霉素的敏感性,同时促进lncRNA-ROR在HCC细胞及其外泌体中富集。受体细胞摄取了富集lncRNA-ROR的外泌体后,减少了化疗诱导的细胞死亡。WANG等[18]发现,外泌体lncRNA H19通过海绵作用于miR-520a-3p,上调LIM激酶1,促进异丙酚治疗后的HCC细胞增殖、迁移和侵袭,抑制HCC细胞凋亡。这一结果提示,通过干预受体细胞与lncRNA的作用,可以改善HCC对化疗药物的耐药性,或许这将会是一种新的HCC治疗方法。
3 外泌体lncRNA用于HCC诊断
早期HCC可以采取手术治疗(如肝切除、肝移植),然而,大多数的HCC患者都是在不可手术的晚期才被确诊[26]。因此,虽然HCC的诊断和治疗技术已经较为成熟,但早期诊断方法仍存在不足,从而导致患者预后不良。对于HCC的早期诊断或动态监测,需要一种新型、高灵敏度、高特异度,且可区分HCC与非HCC的微创指标。血清甲胎蛋白(AFP)是实验室诊断HCC的常用标志物,但其存在特异度较低、误诊率较高的缺点[27]。穿刺活检是诊断HCC的“金标准”,但其属于有创检查,容易造成肿瘤细胞经穿刺孔扩散。最近的研究表明,HCC微环境中不同细胞群体间的外泌体内容物(mRNA、miRNA、lncRNA等)交换不仅在HCC的发生和维持中起着关键作用,而且可能是HCC敏感的非侵入性生物标志物和治疗靶点。外泌体lncRNA可以在体液中保持稳定状态,并存在代表不同肿瘤细胞特性的表达谱,研究这些lncRNA可能有利于HCC早期诊断。
LU等[28]研究发现,HCC外泌体分泌的lncRNA(lncRNA ENSG00000248932.1、ENST00000440688.1、ENST00000457302.2)比AFP具有更高的诊断灵敏度和特异度,这3项lncRNA指标可能是预测慢性肝炎患者或健康人HCC发生风险的潜在生物标志物,也可用于HCC转移的动态监测。XU等[29]证明,联合检测血清外泌体lncRNA ENSG00000258332.1、LINC00635和AFP诊断HCC的曲线下面积为0.894,提示上述指标联合检测可能是一种可行的HCC诊断方法。除此之外,lncRNA ENSG00000258332.1和LINC00635高表达与HCC淋巴结转移、TNM分期有关,且可预测HCC患者的存活期,而且在患者接受手术治疗后上述两种lncRNA水平均显著降低,提示lncRNA有助于HCC患者的临床分期和预后评估。经过多因素分析,LEE等[30]发现,外泌体lncRNA-ATB是HCC进展的独立预测因子,外泌体lncRNA-ATB水平高的患者存活率明显降低,提示lncRNA-ATB可以作为HCC患者的预后标志物。HUANG等[10]发现,血清外泌体lnc85在AFP阳性和AFP阴性的HCC患者中均有较高的表达水平,并且可以很好地区分AFP阴性的HCC患者、健康人及肝硬化患者,此发现提示lnc85有作为HCC生物标志物的潜力。
4 总结与展望
综上所述,外泌体与HCC关系密切,作为与周围基质交流的桥梁,外泌体可以调节肿瘤微环境和细胞间的通讯。HCC外泌体lncRNA在HCC的发生、发展、侵袭、转移中发挥着重要作用,也可用于HCC的早期诊断、治疗及预后评估。但仍存在一些认知及技术方面的不足:(1)外泌体的分离、纯化技术不成熟,无法保证外泌体的纯度、活性;(2)外泌体由多种细胞分泌,如何确定其来源还有待研究;(3)外泌体作为靶向治疗药物载体的体外合成技术还有待提高;(4)外泌体lncRNA在多种肿瘤中发挥作用,但具体机制不明确;(5)外泌体lncRNA作为HCC诊断分子标志物的特异性还无法确定;(6)多个外泌体lncRNA对HCC有相同的作用靶点,完全解析其调控网络仍较困难。相信随着对外泌体lncRNA的深入研究,上述问题均可被逐一解决。研究HCC外泌体lncRNA的作用对HCC甚至其他肿瘤的诊疗均具有重要意义。
