锂硫电池正极材料研究进展
2022-08-23张文佳
焦 萌,张文佳
(1.中国电子科技集团有限公司第十八研究所,天津 300384;2.北京空间飞行器总体设计部,北京 100094)
随着能源危机、环境污染的日益严重,如太阳能、风能、地热能、潮汐能等清洁能源的高效利用日益受到人们的关注,从而对相应的储能系统提出了更高的要求。化学储能因其稳定性好、可移动的特点成为一种重要的储能手段。其中,以锂离子电池为代表的锂二次电池自1991 年实现商业应用以来,取得了长足的发展,已经在消费类电子产品、电动汽车等领域得到了广泛应用。但是,随着科技的发展需要更高能量密度、更低成本的二次电池,而基于锂离子脱出嵌入机制的锂离子电池受限于其较低的理论比容量,已不能满足这一需求,因此寻找具有更高比容量、更低成本的正极材料成为关键[1]。近年来,人们逐渐把研发重点转向锂硫电池,单质硫理论比容量和理论比能量分别高达1 675 mAh/g、2 600 Wh/kg,是下一代高能量密度二次电池的候选者之一[2]。同时硫的储量丰富、环境友好、价格低廉,具有很好的应用前景。
锂硫电池通常以单质硫或其复合材料或含硫化物为正极,金属锂或锂合金作为负极,化学反应中发生的是锂硫键的断裂和生成,其化学反应式为:S8+16 Li↔8 Li2S。按一个硫原子得失两个电子计算,理论比容量可以高达1 675 mAh/g,与金属锂负极配对时,可以达到2 600 Wh/kg 的超高理论比能量。采用单质硫作为锂电池正极材料还存在着一些缺点,主要有:(1)单质硫(5×10-30 S/cm)及其放电产物硫化锂(3.4×10-7 S/cm)电导率都很低,导致活性物质不能完全反应,降低了活性物质的利用率;(2)充放电过程中体积变化巨大(80%);(3)溶解在电解液中的长链多硫化锂会产生“穿梭效应”。
2000 年之后,以各种碳材料负载硫制备的纳米硫/碳复合材料的成功制备,使锂硫电池的综合性能取得了突破性的进展,同时,也再次聚焦了人们针对锂硫电池的研究。本文综述了近些年关于锂硫电池正极材料上取得的一些研究进展,同时,对锂硫电池的发展前景提出了展望。
1 锂硫电池工作机理
通常认为,锂硫电池反应过程如图1 所示,不同于锂离子电池反应的脱嵌锂机制,它是单质硫直接与金属锂发生化学反应,一个S 原子得失两个电子,而S 的相对原子质量只有32,因此具有很高的理论比容量。S 的充放电反应包含了多步的氧化还原反应,以及复杂的多硫化锂相转移的过程。放电过程中,首先S8分子发生开环反应,得到两个电子,并和两个锂离子结合生成长链的Li2S8,接着进一步被还原成长链的Li2S6、Li2S4。这部分长链多硫化锂可以溶解在锂硫电池用的醚类电解液中,属于液相反应,具有很快的动力学过程,表现出2.3 V 的高电位平台,其贡献的容量占比为1/4。Li2S4接着被还原成短链的Li2S2和Li2S。Li2S2和Li2S 不能溶解在电解液中,并且电子电导率和离子电导率都很低,因此这部分固相反应动力学过程很缓慢,表现为2.1 V 的低电位平台,其贡献的容量占比为3/4。充电过程正好是相反的过程。

图1 锂硫电池工作机理[3]
锂硫电池正极材料的研究主要集中在与硫复合的载体的研究,主要分为两类:第一类是碳材料(如:多孔碳材料、碳纳米管、石墨烯等)作为硫载体,用来制备碳硫复合材料;第二类是通过使用各种极性金属化合物来负载硫(包括氧化物、硫化物、氮化物、磷化物、碳化物、硒化物等),一般和碳材料复合使用。这两类材料都可以在某些方面抑制多硫离子的溶解、迁移和扩散,抑制Li2S2和Li2S 在材料外表面的沉积,提高了单质硫的利用率,改善锂硫电池的循环稳定性[4]。
2 碳/硫复合材料
早期锂硫电池正极材料的研究主要集中在使用不同的碳材料(如介孔碳、碳纳米管、石墨烯等)作为硫载体,制备碳/硫复合材料,用来改善硫的导电性,以缓解硫电极在充放电过程中产生的体积变化,取得了很好的效果。但是在解决“穿梭效应”问题时作用有限,因为碳材料对多硫化锂的吸附只是由范德华力引起的微弱物理吸附,因此在碳材料上引入极性的官能团或者掺杂N、S、B、O、P 等原子使得其变为极性状态,可以增强对多硫化锂的吸附。
2.1 多孔碳材料
硫的绝缘性和反应中间产物多硫化物的溶解阻碍了锂硫电池的商业应用。将活性物质硫嵌入碳材料的多孔结构中,可以使正极复合材料具有良好的导电性和有效地抑制多硫化物的“穿梭效应”,有助于锂硫电池电化学性能的提升。多孔碳材料的孔按孔径大小可以分为微孔(<2 nm),介孔(2~100 nm)和大孔(>100 nm)。微孔可以用来装载小分子硫,介孔可以缩短Li+离子的传输路径,大孔可以提供大的空隙用于容纳反应过程中的体积变化和达到高硫负载量。
(1)微孔碳材料
Gao 等[5]通过煅烧蔗糖和聚偏二氟乙烯得到具有高比表面积(800 m2/g)和大量微孔(<1.0 nm)的微孔碳球[图2(a)]。微孔使得硫以小分子S2-4的形式被限制在微孔中。在这样的微孔碳中,硫与孔壁之间的相互作用更强,因此具有很强的吸附作用,可以有效地抑制多硫化物在电解液中的溶解。所得的碳/硫复合材料的循环稳定性优异,在1C下可以稳定循环1 000 次,每次循环仅有0.03%的容量损失。但是受限于微孔的理论孔体积的限制,这类材料的含硫质量分数一般低于50%,能量密度较低。
(2)介孔碳材料
CMK-3 是典型的有序介孔碳,其由孔径为6.5 nm 的空心碳棒组成,碳棒之间还形成了3~4 nm 的介孔[1]。通过熔融扩散法合成的S/CMK-3 复合材料在168 mA/g 的电流密度下可逆比容量为1 320 mAh/g[图2(b)]。

图2 三种碳材料的示意图
(3)层级多孔碳材料
Huang 等[6]设计了一种介孔-微孔核壳碳(MMCS)作为硫的载体[图2(c)],它结合了介孔碳和微孔碳的优点,能够容纳大量的硫。而“壳”含有微孔碳和小分子硫作为物理屏障提高了硫/碳复合材料整体的循环稳定性,表明这样的结构设计可以阻碍多硫化物扩散到电解液中。
2.2 碳纳米管类材料
碳纳米管(CNT)是由石墨烯卷曲而成的一类一维(1D)碳材料,具有很大的长径比和优良的导电性,在锂硫电池中有很好的应用前景。与多孔碳材料相比,CNT 具有更好的长程导电能力,提供连续的电子和离子转移路径。此外,其独特1D 结构可以通过不同方法构建不同的自支撑结构,制成柔性的载体。
传统制备电极的工艺需要添加不导电的粘合剂,不仅降低了能量密度,也不利于离子/电子的传导。因此,具有连续结构的CNT 网络有利于减小电子/离子转移路径和接触电阻。而且,大的长径比有利于组装自支撑的硫/CNT 正极[8-9]。Sun 等[8]通过空气氧化碳纳米管制备了多孔碳纳米管(PCNT)(图3)。随后制备出柔性的PCNT 网络作为高硫负载的载体。PCNT 相比于CNT 其分散性、电导率、强度都有所提高。高度多孔的PCNT 结构使得其能够实现高硫负载。PCNT 的这些特征使得S@PCNT 柔性电极具有很好的电化学性能。Li 等[9]制备了一种三维碳纳米管(3D-CNT)泡沫(图3),利用熔融法通过毛细作用力将硫渗入高质量的CNT 内部(硫质量分数79%),从而实现高的单位面积硫负载量和高的面积比容量(19.1 mg/cm2,19.3 mAh/cm2)。
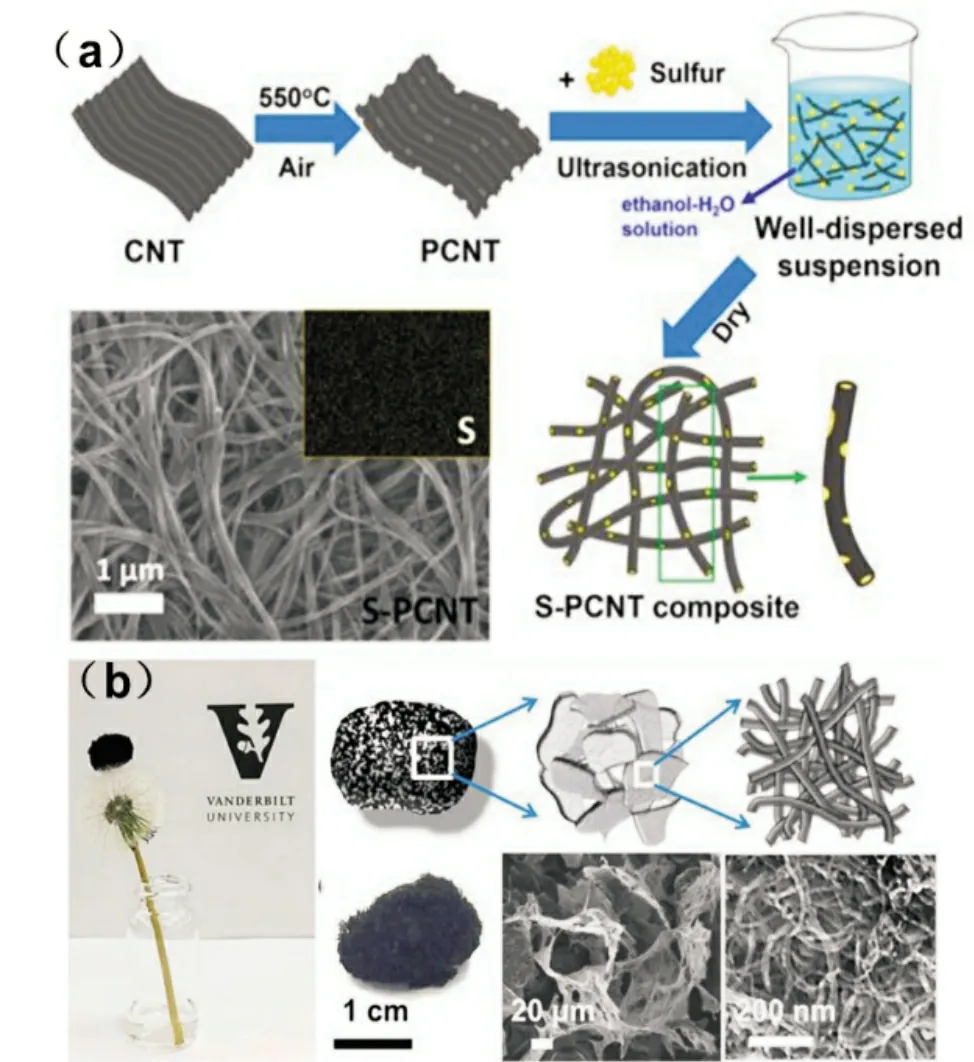
图3 (a)S-PCNT 复合材料的合成路线示意图和形貌表征[8],(b)3D-CNT泡沫的示意图和SEM照片[9]
2.3 石墨烯类材料
石墨烯具有优异的物理性能(导电性高、强度高、表面积大、密度低),从而被广泛应用于锂硫电池中。但是单纯的石墨烯材料对多硫化锂的作用仅仅是物理吸附,很难取得长循环稳定性。并且由于其分散性差,与硫复合的手段单一,难以对材料结构进行设计和优化。因此大多采用易于分散的氧化石墨烯作为原料,通过异质原子掺杂、负载官能团、结构设计等手段进行优化,以提高正极材料的电化学性能。
(1)掺杂石墨烯
目前大部分制备石墨烯的方法会引入很多缺陷,导致其难以达到理想的特性。为了提高石墨烯的质量和提高对多硫化锂的吸附作用,对存在缺陷的石墨烯材料进行异质原子的掺杂是一种常用的方法。N、S、B、O、P 等原子的掺杂使得石墨烯变为极性状态,从而加强对多硫化锂的吸附,缺陷石墨烯的导电性得到提高,有利于改善电化学性能。例如,Wang等[10]通过简单的热诱导膨胀方法制备了高度褶皱的N 掺杂石墨烯[图4(a)]。受益于其丰富的孔隙结构和N 官能团的化学作用力,电池具有1 227 mAh/g 的高比容量,以及经过300 次循环容量保持率为75%的长循环寿命。Zhang 等[11]使用N 掺杂石墨烯实现了2 000 次长循环寿命的锂硫电池。光谱分析和理论计算结果表明,其优良性能归因于经过N 掺杂之后,石墨烯恢复了C-C 晶格,同时含氮官能团与多硫化锂具有独特的结合能力。
(2)功能化石墨烯
在石墨烯上引入功能性的官能团制备出功能化的石墨烯,有利于锂硫电池电化学性能的提高。氧化石墨烯表面大量的含氧官能团导致其导电性很差。经过还原处理之后,去除了部分官能团,导电性有所提高,但是仍有一定的官能团残留。石墨烯上的含氧官能团可用于改善硫与石墨烯的相互作用,硫通过C-S 键的作用锚固在石墨烯网络上,从而提高了锂硫电池的循环性能。Zhang 等[12]制备的GO/S 复合材料的电化学性能表现优异,可逆比容量为1 000 mAh/g,在离子液体电解液中能达到2C的倍率性能。Cui 等[13]率先使用石墨烯包覆硫颗粒用作锂硫电池正极材料[图4(b)]。石墨烯包覆可以减少多硫化锂的流失和提高整体电子导电性,并且缓解了硫在充放电过程中的体积效应。石墨烯包覆硫复合材料与未进行包覆的样品相比,容量和循环性能都有所提高。其比容量达到750 mAh/g,在0.2C下循环100次后容量保持率为70%。
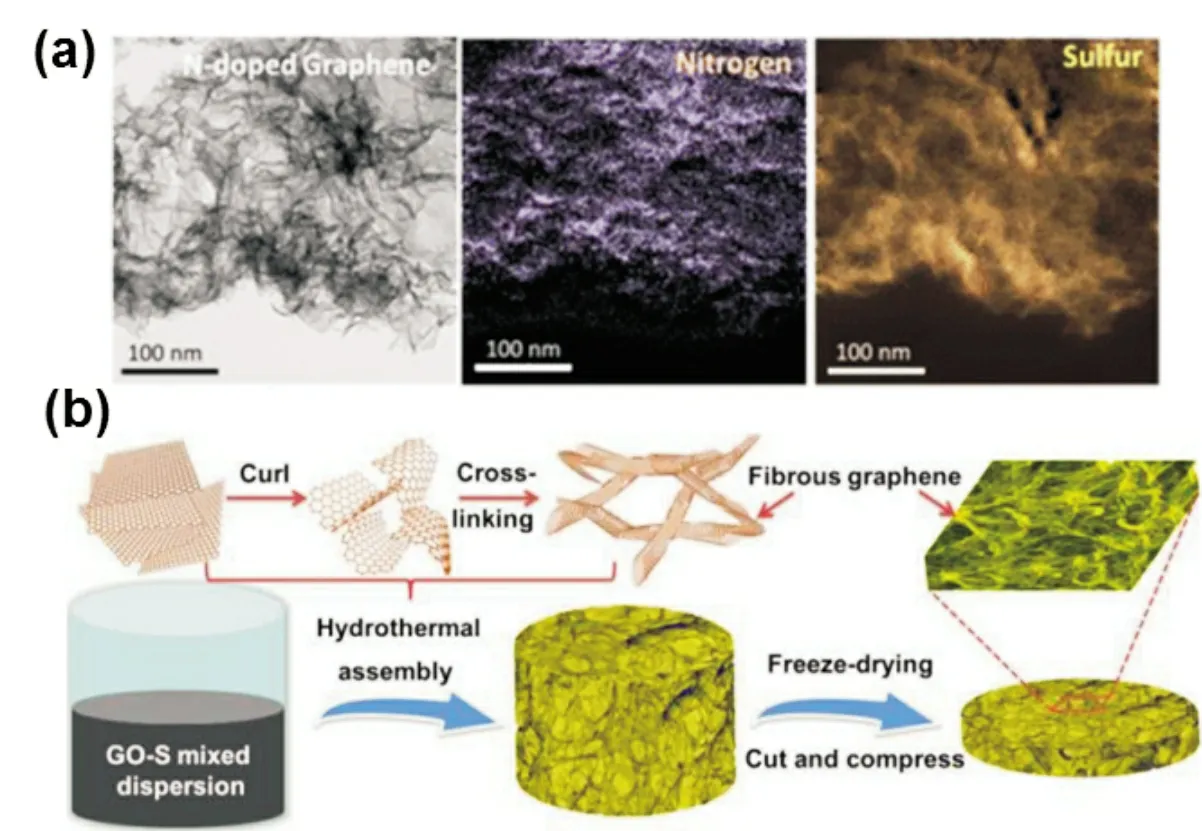
图4 (a)N掺杂褶皱石墨烯的元素分布图[10],(b)石墨烯气凝胶/硫复合材料制备流程图[14]
(3)结构优化的石墨烯
石墨烯具有导电率高、比表面积大等优点,但是巨大的比表面积使其易于团聚,影响其性能的发挥。为了改善这一缺点,可以制备三维石墨烯来负载硫,防止石墨烯的团聚,并提高硫的负载量。
图4(b)中,Zhou 等[14]使用水热法一步制得了石墨烯气凝胶和硫的复合材料。这种复合材料由纤维状石墨烯组成多孔网络结构,具有良好的电子传输网络,并且容易调节硫含量,可以直接切割制成电极用作锂硫电池正极,无需使用金属集流体、粘合剂和导电添加剂。其含氧基团(主要是羟基/环氧化物)与多硫化物表现出较强结合能力,抑制其溶解到电解液中。因此,G/S 复合材料具有容量高、倍率性能出色和循环寿命长的优点。Cao 等[15]通过在金属锌表面用同步组装的方法将氧化石墨烯和硫复合,制得了柔性还原氧化石墨烯/硫(RGO/S)自支撑膜。这种自支撑的RGO/S 薄膜可以折叠成任何形状。基于RGO/S薄膜制得的柔性Li-S 电池可在不同弯曲条件下发挥稳定的电化学性能。除了直接合成柔性石墨烯/硫正极外,还有另一种通过设计柔性石墨烯作为柔性的正极集流体的概念[16]。这种设计使得锂硫电池具有1 345 mAh/g的高放电比容量,库仑效率约为98%。
2.4 复合型碳材料
由于具有高电导率、理论比表面积高、机械柔韧性好等优点,石墨烯作为硫的载体以提高导电性受到越来越多的关注。然而,石墨烯由于其开放式的结构,不能将多硫化物有效地限制在基体材料中实现稳定的循环性能。并且由于静电吸引的作用,单层石墨烯容易团聚并叠加成多层石墨烯使其达不到理论比表面积。采用多孔碳材料和碳纳米管添加到石墨烯层间以防止它们自聚集,来实现复合材料大的表面积[17]。
Chen 等[18]设计并制备了以石墨烯为基底的层状多孔碳材料(L-GPC)负载硫作为Li-S 电池正极材料[图5(a)]。一层薄薄的多孔碳均匀地覆盖在石墨烯的两个表面,多孔碳材料本身可以提供更大表面积和孔体积,从而实现更高的硫负载量。多孔碳也可以吸附多硫化物和加速电子/离子转移以实现快速动力学过程,所制备的材料电化学性能和循环稳定性更好。此外,还有一些自支撑的复合碳材料,可以制备成不含粘合剂自支撑载体。Liu 等[19]制备了一种新型的同轴结构的石墨烯-硫-碳纳米纤维(G-S-CNF)自支撑硫正极。导电碳纳米纤维作为电极,具有很好的机械支撑作用。石墨烯有利于缓解体积变化并抑制多硫化物在电解液中的溶解。以GS-CNF 为正极的Li-S 电池稳定循环1 500 次,每次循环的衰减率为0.043%。
Zhang 等[20]通过双氢氧化物(LDH)模板制备了石墨烯/单壁碳纳米管(G/SWCNT)杂化材料,通过共价键将SWCNT 固定在石墨烯平面,它们之间的连接牢固,构建了高的导电通路[图5(b)]。因此,所获得的G/SWCNT-S 正极电化学性能表现优异,即使在5C的大电流下,100 次循环后仍具有高达650 mAh/g 的比容量。在后续的工作中Zhang 等[21]进一步利用双模板法制备了在石墨烯表面生长氮掺杂碳纳米管阵列的复合碳材料。三明治结构的复合材料提供了优异的电子和离子传输路径,氮掺杂使得复合结构具有更多的活性位点,同时提高了对多硫化锂的吸附能力和电化学性能。倍率性能优异,即使在5C的大电流下仍有770 mAh/g 的比容量。
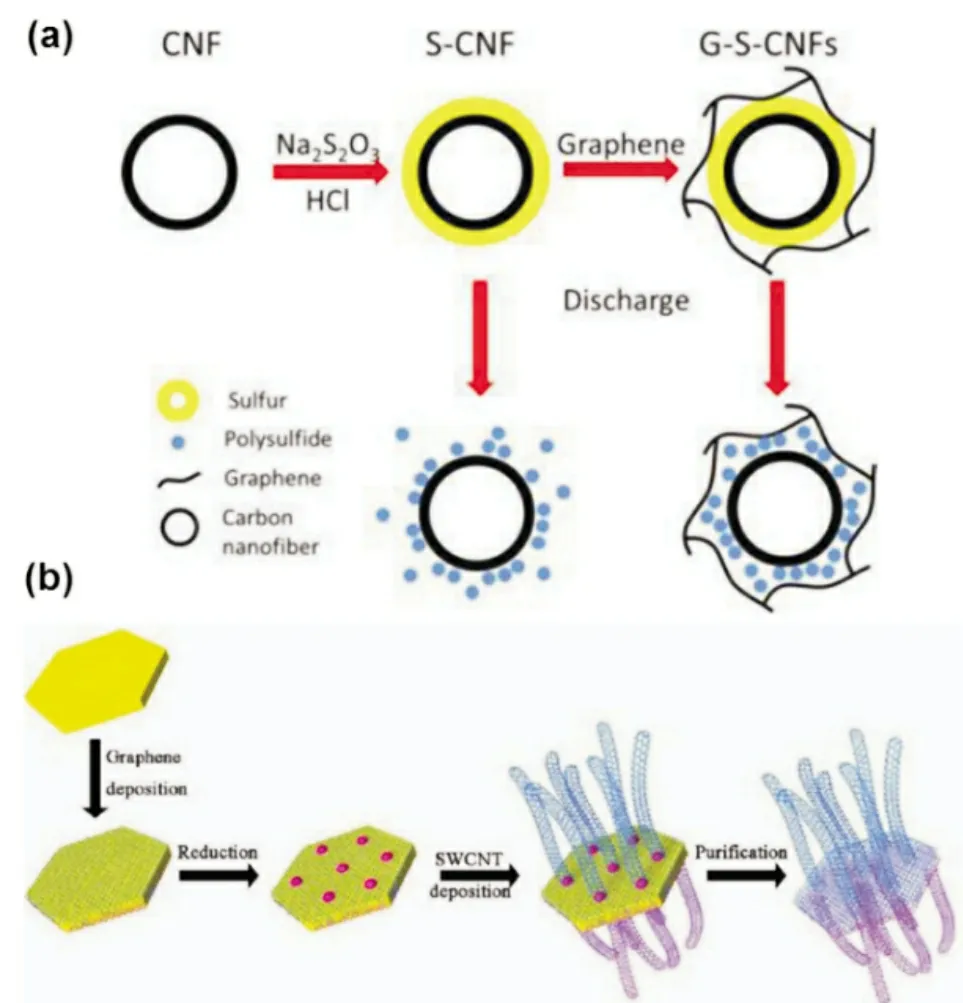
图5 (a)制备石墨烯/硫/碳纳米纤维多层同轴复合材料的流程图[19],(b)石墨烯/单壁碳纳米管杂化材料制备过程示意图[20]
3 硫/金属化合物复合材料
3.1 单一金属化合物
最新研究结果表明,纳米金属化合物(如氧化物、硫化物、氮化物等)具有极性表面和活性位点,对中间产物多硫离子有更强的化学吸附作用。
(1)金属氧化物
早期的锂硫电池研究中将金属氧化物作为添加剂来改善Li-S 电池的性能。Ahn 等[22]在锂硫电池中加入15%质量分数的纳米Mg0.6Ni0.4O(粒径≤50 nm,比表面积28 m2/g)作为添加剂,与不含添加剂的电池相比,其初始比容量增加高达60%。这是由于添加剂的存在提高了对LiPSs 的吸附能力[图6(a)]。尽管添加纳米Mg0.6Ni0.4O 提高了初始容量,但50 次循环后容量下降至约1 000 mAh/g,表现出相对较差的LiPSs 吸附能力。Cui 等[23]开发了一种具有预留内部空隙的S-TiO2的蛋黄-壳结构[图6(b)]。与没有预留空隙的S-TiO2材料相比,预留空隙的S-TiO2蛋黄壳设计表现出更好的循环稳定性,在1 000 次的长循环中每次容量衰减仅为0.033%。具有长寿命的原因是薄壳状的TiO2具有完整的外壳,具有封闭活性物质的优点,并且内腔的空隙提供了用来缓解循环过程中硫的巨大体积变化的空间。Nazar 等[24]使用GO 作为模板的方法一步制备出MnO2纳米片。由此获得S/MnO2纳米复合材料(含75%硫),在1/20C时初始比容量为1 300 mAh/g,1C下为950 mAh/g。使用XPS 研究多硫化物和MnO2纳米片的相互作用发现硫代硫酸盐([SSO3]2-)中S=O 的存在,由此证实了MnO2纳米片与多硫化物之间存在化学结合。
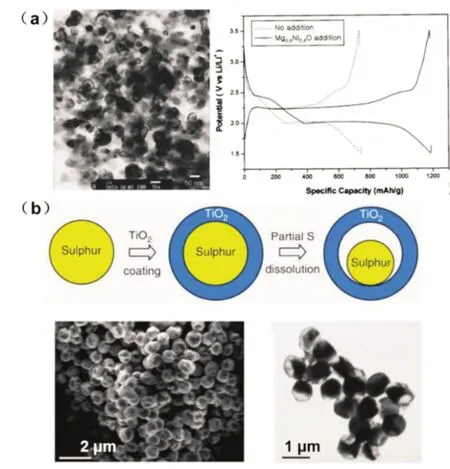
图6 (a)Mg0.6Ni0.4O的TEM 照片和添加Mg0.6Ni0.4O的锂硫电池的初始充放电行为[22],(b)S-TiO2核壳结构的合成示意图与形貌表征[23]
(2)金属硫化物
金属硫化物作为添加剂在锂硫电池中的应用研究逐步引起了人们的重视,硫化物相比于金属氧化物具有如下优点:(1)金属硫化物的导电率普遍高于金属氧化物;(2)金属硫化物的锂化电位较低,在锂硫电池1.5~3.0 V 的充放电区间可以稳定存在;(3)金属硫化物对多硫离子的吸附能力居中,能够在吸附能力和转化能力之间取得平衡。
Nazar 等[25]通过水热法合成了片状的Co9S8,Co9S8室温下的电导率达到了290 S/cm,直接用作硫的载体,得到了较好的电化学性能[图7(a)]。Ganguli 等[26]使用二维过渡金属化合物(TMD)(MoS2、WS2)通过电催化作用稳定多硫化物穿梭效应[图7(b)]。在0.5C下电池具有590 mAh/g 的比容量,实现了350 次的稳定循环。

图7 (a)合成的石墨烯状Co9S8的SEM 照片[25];(b)探索WS2纳米片在LiPSs转化反应中的优先催化位点[26]
(3)金属氮化物
Dong 等[27]合成了具有高导电性的多孔管状氮化钛(TiN)[图8(a)]。TiN 与多硫化锂之间的强相互作用降低了“穿梭效应”。循环伏安测试结果表明,TiN 在促进氧化还原反应过程中也起着重要的催化作用。当空心TiN 管用作硫的载体时,TiN/S 正极具有较高的比容量、较高的库仑效率和出色的循环性能。在5C下放电比容量可高达1 026 mAh/g,0.5C循环450 次后仍有840 mAh/g 的可逆比容量。在后续的工作中,Dong 等通过一种简单方便的方法合成了Co4N 纳米片组成的微球[28][图8(b)]。这种材料具有高的多硫化物锚固能力,并能催化硫的氧化还原过程。使用Co4N 微球用作硫的载体,实现了很好的电化学性能。在0.1C时Co4N@S 具有1 659 mAh/g的高放电比容量。而且,在5C下,循环300 次后仍有585 mAh/g 的放电比容量。

图8 TiN 和Co4N的SEM照片
3.2 金属化合物异质结构
金属氧化物具有较强的吸附性能,但其电子电导率通常较低,使得LiPSs 很难继续转化反应。金属硫化物、氮化物、碳化物等具有较强的捕获LiPSs 分子的能力,同时可以改善电化学反应的动力学。因此,这些金属化合物被认为是有效的电催化剂,可以加速多硫化物的氧化还原反应,使LiPSs 分解成低级多硫化物,获得更高的容量。但与金属氧化物相比,它们的吸附能力并不令人满意,这限制了Li2S 转化的效率。考虑到这些因素,通过将两种不同的功能材料组合构建异质结构以同时实现高吸收能力和电催化活性是一种有应用前景的方法。
Song 等[29]报道了一种VO2-VN 异质结构材料,其中VO2对多硫化锂具有超快的锚固作用,VN 具有良好的电子传导性[图9(a)],从而同时实现了对LiPSs 的有效锚固作用和转化作用,在2C下比容量为935 mAh/g,800 次循环中每次循环的衰减率仅为0.06%。Qiao 等[30]设计并制备了二维异质结构MoN-VN[图9(b)~(e)]作为硫载体限制LiPSs 溶解,并从原子尺度深入阐述了多硫化锂的吸附行为。图9(f)~(g)中的DFT计算结果表明掺杂V 改变了MoN 表面的电子结构,提高了对LiPSs 的吸附。结合NEXAFS 和原位同步加速器X 射线衍射(原位同步加速器XRD)[图9(h)]进一步证明与纯MoN 相比,MoN-VN 异质结构可以提高硫的利用效率,加速转换动力学,从而提高电化学性能。使用MoN-VN 异质结构改性硫正极可以实现2C下708 mAh/g 的高比容量和低的容量衰减率(500 次循环,每循环衰减0.068%)。
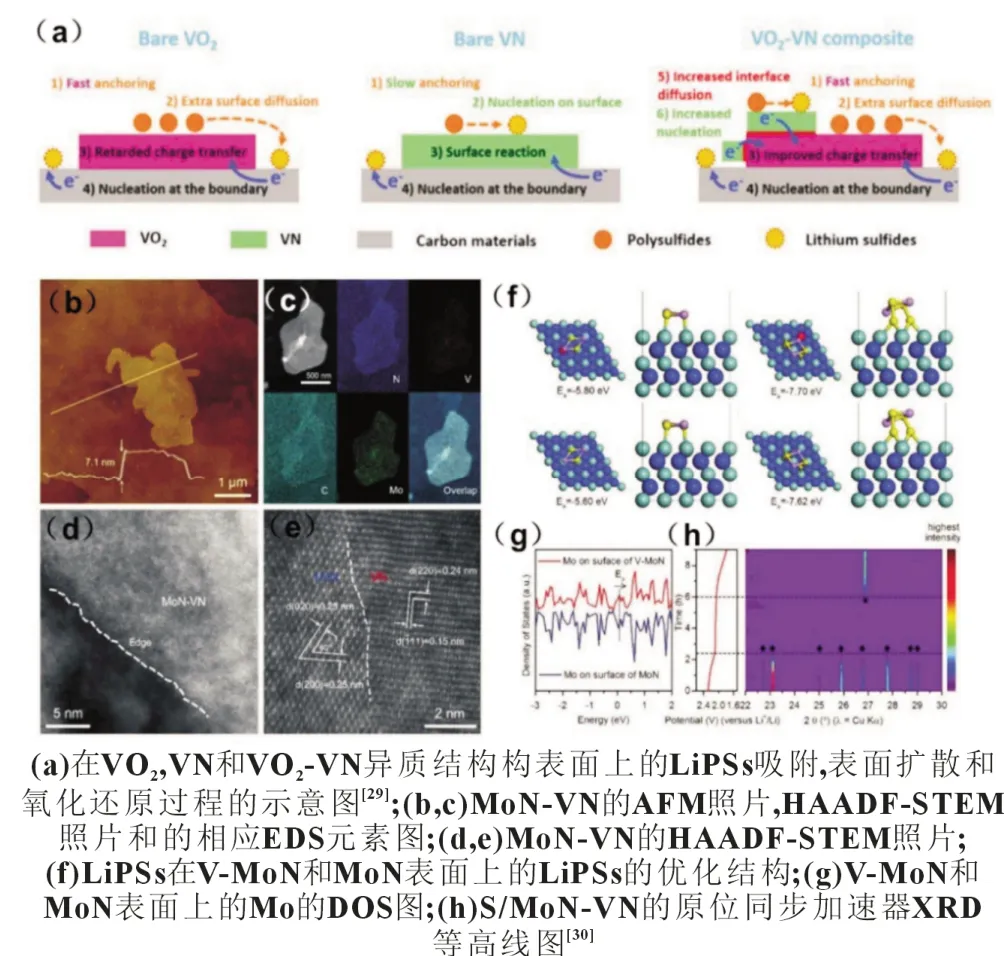
图9 异质结构吸附多硫化锂示意图
3.3 碳材料/金属化合物复合材料
由于金属化合物相对于碳材料密度更大,而且大部分导电性劣于碳材料,很难获得高负载量的硫正极。因此,将金属化合物负载在碳材料上是一种更好的选择。目前大部分对金属化合物的研究工作也是基于这种选择来展开的。
为了进一步通过物理阻挡的作用来锚固多硫化物,Lou等[31]开创性地设计和制作了一种一维复合纳米结构,即空心碳纳米纤维填充入MnO2纳米片作为硫的载体,为活性物质提供了一个高效载体和三维连通的导电网络,且对多硫化物同时具有物理限制和化学吸附的作用。Ye 等[32]制备了一种纳米级硫化镍(NiS)作为硫的载体[图10(a)]。在复合材料中,纳米NiS 对多硫化物吸附能力强,三维空心碳球对多硫化物起到物理吸附作用以及提供了三维的电子转移途径。此外,NiS 与C-HS 具有强的化学偶联作用,有利于促进快速的电荷转移和氧化还原动力学。使用复合材料作为载体的锂硫电池在0.5C循环300 次后,电池比容量为695 mAh/g,容量衰减低至每循环0.013%(2.3 mg/cm2)。
Sun 等[33]制备了氮掺杂碳纳米管负载无定型CoS3作为硫的载体[图10(b)]。CoS3催化剂催化Li2S2转化为Li2S,显著提高了硫的利用率。CoS3显示出与硫的强相互作用,因此能够锚固多硫化物并确保其可逆转化。另外,Li2S2在CoS3的表面上显示出较低的解离能,促进Li2S2向Li2S 的转化。含有CoS3催化剂的样品在高硫负载量下(3~10 mg/cm2)与不含CoS3的样品相比容量增加了20%。另外,CoS3催化剂的催化活性在反复循环期间仍然有效。这项工作提供了一种新的提高锂硫电池电化学性能的途径。硫钴矿CoS2已被证明具有高催化活性,并且导电性高,在300 K 时电子电导率达到6.7×103S/cm。Zhang 等[34]使用CoS2作为催化剂,通过加速多硫化物的氧化还原反应来提升锂硫电池的反应动力学。他们将CoS2和石墨烯材料混合在一起制备了石墨烯/CoS2(15%或30%)复合载体。直径约1 μm 的CoS2颗粒附着在高度褶皱的石墨烯基底上,实现了从导电骨架到极性CoS2表面的电子导通路径。G/CoS2(30%)样品的首次放电比容量为1 368 mAh/g,G/CoS2(15%)的首次放电比容量为1 174 mAh/g,预示着极性CoS2的加入虽然提高了整体材料对多硫化锂的吸附和转化能力,但是并不是含量越高越好,低比表面积的CoS2会降低复合载体所能承受的硫负载量,选择一个合适的比例较为关键。Sun 等[35]报道了高导电性的多孔氮化钒纳米带/石墨烯复合材料用作硫正极的载体,复合正极显示出良好的倍率性能和循环稳定性。在0.2 C 时,初始比容量达到1 471 mAh/g,100 次循环后比容量为1 252 mAh/g,容量损失仅为15%。

图10 (a)NiS@C-HS的制造过程的示意图以及对应的TEM 照片[32],(b)CP@NCNT@CoS3的制备示意图和CP@NCNT@CoS3和CP@NCNT的TEM照片[33]
4 硫化锂正极材料
硫化锂是硫正极的放电状态,具有166 mAh/g 的高理论比容量[36]。相比于硫正极材料具有一些优势:(1)硫化锂是富锂态的,可以使用硅、锡这些不含锂的负极材料,避免了使用安全性较差的金属锂,提高了电池的安全性;(2)与现有的锂离子电池生产体系相适应,生产工艺和设备可以直接应用。但是其也存在一些问题,比如硫化锂极易和水发生反应,在空气中就可以发生,生成剧毒的硫化氢气体。也因为如此,硫化锂的制备和保存比较困难,造成了其价格昂贵。因为其在第一次充电激活之后就变成硫,所以它所存在的问题和硫正极类似。
由于硫化锂的电子电导率和锂离子电导率都很低,因此硫化锂首次激活过程的活化能垒很高,需要施加很高的电压才能够激活。Cui 等[37]详细研究了硫化锂激活的机理。图11(a)为硫化锂首次充电活化过程的示意图,达到较高的电位后,多硫化锂开始在硫化锂表面成核。多硫化锂本身具有快速的反应动力学,其与硫化锂之间存在歧化反应,因此多硫化锂的出现起到了类似催化剂的效果,使得后续的反应壁垒大大降低。硫化锂材料只需在第一次充电过程中需要激活,在后续的循环中,由于锂硫电池电解液中不可避免的有溶于电解液的多硫化锂的存在,因此后续的反应和以硫作为正极的材料相同。硫化锂的激活电压经证明与硫化锂的颗粒大小和充电电流大小相关,硫化锂颗粒越小、充电电流越小,其所需要达到的激活电压就越小。
为了提高Li2S 的电化学活性,与碳材料复合是必要的制备方法。然而Li2S@C 复合材料的合成方法也阻碍了它们的实际应用。获得Li2S@C 复合材料的主要途径可分为两类:商业Li2S 粉末与碳材料的直接混合及在碳质材料上化学合成Li2S。
(1)直接使用商业化的硫化锂材料。大多数Li2S@C 复合材料是通过商业Li2S 粉末和碳材料的高能球磨制备的[36],它只是将Li2S 粉末与碳机械混合,难以在Li2S 颗粒和碳材料之间形成有效的界面结合。此外,不能有效地控制Li2S 的粒径。图11(b)中,Zhang 等[36]报道了将市售的微米级Li2S 粉末与碳添加剂通过高能球磨工艺制备出了Li2S/C 的纳米结构。通过循环伏安法和电化学阻抗谱证实这种方法提高了Li2S/C 电极的活性物质利用率和可逆性。为了提高循环稳定性,进一步在Li2S/C 电极中添加多壁碳纳米管。在高Li2S 质量分数(67.5%)下仍具有高的比容量1 144 mAh/g(理论值的98%),但是由于没有对多硫化物的有效吸附,所以其容量衰减很快。Li2S/C 复合材料也可以通过基于溶液的通用方法从Li2S 粉末和有机碳源(如PVP[38])中获得[39-41]。在上述方法中,使用市售的Li2S 粉末作为原料,由于其高成本,在实际应用中不具有吸引力。
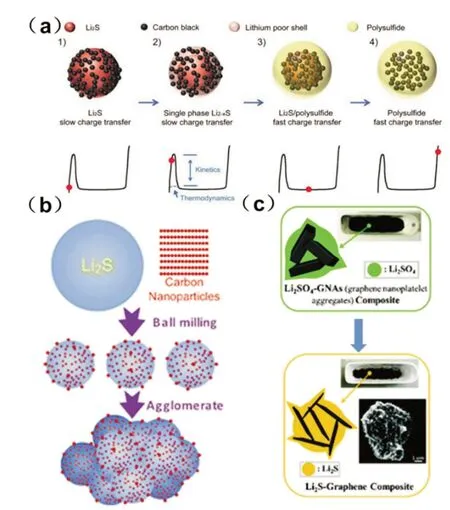
图11 (a)Li2S 首次充电活化过程的示意图[37],(b)球磨法制备Li2S/C的合成路线[36],(c)一步碳热还原法制备Li2SO4制备Li2S/石墨烯复合材料的合成路线[50]
(2)化学合成制备硫化锂。Yang 等[42]通过用正丁基锂与硫的化学反应制备Li2S/CMK-3 复合材料,开发出纳米结构的Li2S/C 复合材料。Nan 等[43]通过硫和三乙基硼氢化物(LiEt3BH)的化学反应制备了碳包覆Li2S 核-壳结构。然而,使用不安全的化学品(如LiEt3BH 或锂粉)导致制备过程变得危险、复杂、成本高。近年来,通过碳还原Li2SO4制备Li2S 的Leblanc 合成路线引起了很多关注,具有原料便宜、可同时实现紧密的碳包覆等优点,被认为是用于原位制备Li2S@C 复合材料的可靠方法。基于这种合成路线已经有一些工作被报道[44-49]。一些研究使用球磨来混合Li2SO4和碳材料[44-46],另外一些报道在溶液中制备Li2SO4@碳源前驱体,然后通过碳热还原反应得到Li2S@C 复合材料[47,49]。图11(c)中,Li 等[50]报道了以硫酸锂和石墨烯通过一步加热碳热还原法制备出了Li2S/G 复合材料。该方法可以将Li2S 原位固定在石墨烯上,通过紧密的接触提高了复合材料的导电性。用作锂硫电池正极材料,与商用Li2S 和石墨烯的混合物相比,加速了硫化锂的反应动力学,提高了容量、循环性能和倍率性能。
总结发现,通过溶液法包覆碳源结合原位反应制备得到的Li2S/C 复合材料具有更好的电化学性能。
5 高能量密度锂硫电池展望
对于Li-S 电池,基础研究和实际应用之间的差距在于材料研究和器件设计之间的差异。Li-S 电池是一种集成器件,不仅涉及材料,还涉及电极结构和电池工程,能量密度是其最重要的参数之一。对于材料研究,注意力主要集中在硫的利用(基于硫质量的比容量)和活性材料的循环稳定性。对于电极结构和电池工程,设计参数,包括硫含量、面积硫负载和活性成分与非活性成分的比例,在确定有效能量密度中起关键作用,但在材料研究中经常被忽略,导致难以构建高能量密度的Li-S 电池。因此,应考虑上述设计参数,将注意力从材料扩展到整个电池。为了获得高能量密度,除了高硫利用率和高输出电压外,正极中的硫含量和单位面积硫负载量应尽可能高,并且电池中非活性组分的含量(例如集流体、电解质)尽可能低。
近年来,关于Li-S 电池的研究取得了很大的进展。早期的研究工作致力于改善硫的利用率而不考虑正极中的硫含量;近来,高硫含量受到越来越多的关注。尽管如此,如何实现高硫含量和高单位面积硫负载量,同时取得较高的硫利用率,从而实现锂硫电池整体的高能量密度仍然有待进一步研究。为了达到这个目标,需要从以下参数出发去设计、构建高能量密度锂硫电池:
(1)高硫含量(≥70%,质量分数),基于整个正极计算的高比容量(≥800 mAh/g);
(2)高单位面积硫负载量(≥5 mg/cm2)和高面积比容量(≥6 mAh/cm2);
(3)低的电解液/硫比(≤4 μL/mg);
(4)易于制造,使用低成本材料。
