肝细胞癌合并胆管癌栓二例并文献复习
2022-08-23雷森黎昕龙官保胡走肖王凡张海宏吴宇蔡常春
雷森,黎昕,龙官保,胡走肖,王凡,张海宏,吴宇,蔡常春
华中科技大学同济医学院附属武汉中心医院肝胆胰外科,湖北 武汉 430014
肝细胞癌(hepatocellular carcinoma, HCC)是恶性肿瘤中第三大致死原因,在过去的几十年里,其发病率持续上升[1-2]。HCC侵犯至胆管形成胆管癌栓临床上较少见,仅占HCC的0.53%~12.9%[3-6]。由于类似的临床表现和影像学特征,易被误诊为胆管癌、胆道结石、胆管炎等,导致临床治疗产生延误,失去最佳治疗时机。目前关于HCC合并胆管癌栓的诊治报道较少,本文报道2例临床上罕见的HCC合并胆管癌栓病例,1例为肝内肿瘤原发灶较小且甲胎蛋白(AFP)阴性,另1例为肝癌术后复发合并胆管癌栓,结合这2例病例资料对近年来HCC合并胆管癌栓的相关文献进行回顾。
病 例 资 料
例1:男性,64岁,因“上腹部疼痛1 d”于2021年7月9日入院,1 d前因进食油腻食物后出现上腹部胀痛不适,伴皮肤发黄。既往乙型肝炎病史30年。体检:皮肤巩膜明显黄染,右上腹压痛无反跳痛。完善相关实验室检查,结果见表1。B超:肝形态不规整,肝内外胆管扩张,胆囊壁毛糙。上腹部增强CT:汇管区-胆总管上段占位(图1);肝门区、肝内胆管轻度扩张;肝硬化;门静脉期肝内明显强化灶;胆囊炎。MRI+磁共振胰胆管成像(MRCP):汇管区胆管壁增厚,管腔狭窄伴弥散受限(图2);肝脏信号异常,考虑铁过载;肝硬化;胆囊炎;左右肝管及左叶部分胆管扩张。初步诊断:胆管占位性病变;胆囊结石伴急性胆囊炎;梗阻性黄疸;乙型肝炎小三阳(HBsAg、HbeAb、HbcAb阳性)。行抗感染、护肝及退黄等治疗,拟行经内镜逆行胆胰管成像(ERCP)明确诊断,病人及家属拒绝,经上述治疗后黄疸指标及CA19-9降至正常,病人于2021年7月20日要求出院。
为进一步明确诊断,病人于2021年8月6日再次入院,完善相关实验室检查,结果见表1。B超:肝硬化,胆囊壁毛糙,肝内外胆管扩张,胆总管内异常回声。上腹部增强CT:肝内散在结节样小强化灶(图3);MRI+MRCP:汇管区-胆总管上段稍增粗伴肝内胆管扩张,肝门部胆管癌(Ⅱ型)可能;肝硬化;胆囊炎。汇管区-胆总管上段占位伴弥散受限(图4);左右肝管及左叶部分胆管扩张程度略减轻;肝硬化;肝脏信号异常,考虑铁过载;胆囊炎。正电子发射断层显像-CT(PET-CT):肝总管下段-胆总管起始部管壁增厚,早期相代谢轻度增高,延迟相代谢消退;肝内胆管轻度扩张,代谢不高;胆囊炎;全身其余部位未见恶性肿瘤征象。
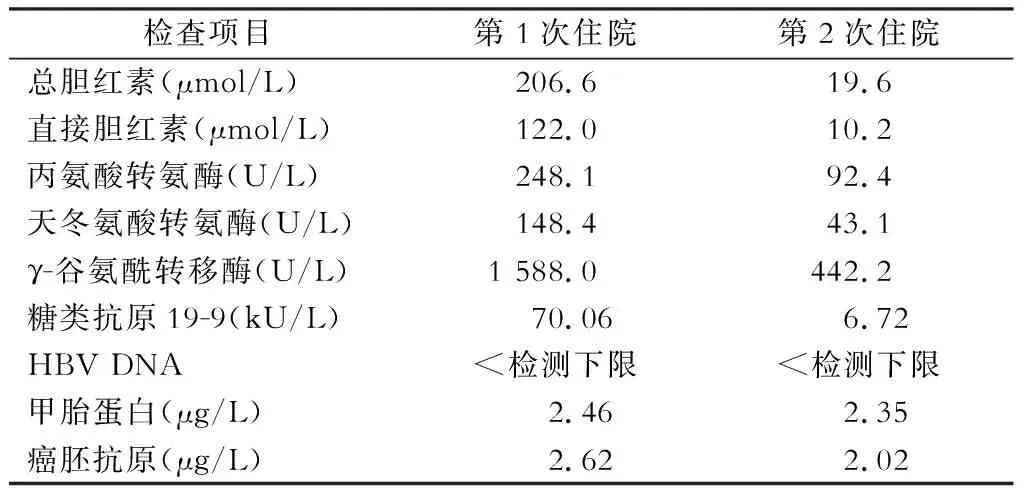
表1 病人第1次及第2次住院常见实验室检查结果
病人于2021年8月13日在全身麻醉下行剖腹探查术,最终行S5段肝肿瘤切除术+胆囊切除术+肝内病灶消融术+胆总管探查T管引流术。术中见肝脏呈肝硬化表现,未触及明显肿瘤,打开胆总管可见癌栓样肿物(图5),送快检报腺癌,肝脏来源可能性大,诊断为胆管癌栓。胆道镜探查确认胆管无残留及浸润后,置入T管。在肝表面行超声探查,可及S3(1.2 cm)、S5(0.6 cm)及S8(0.8 cm)段小占位,结合术前CT及超声相同征象,考虑为肝内多发相同性质肿瘤,切除S5段肿瘤,对S1、S8段肿瘤行射频消融。术后病检:(胆管内肿物)符合HCC(图6)。(S5段)高-中分化HCC;免疫组织化学:Hepatocyte、细胞角蛋白(CK)8/18(+),Glypican-3(散在+),CD10(散在+),癌胚抗原(丛管状+),CK7、Arginase-1(部分+),CK19(-),CD34示窦周毛细血管化,AFP(-),D2-40示脉管,Ki-67 LI约10%。术后恢复顺利出院,定期随访,至今未见明显复发。
例2:男性,93岁,以“剑突下疼痛3 d、加重1 d”于2021年9月1日入院,2014年诊断为HCC行肝癌切除术,术后行5次肝动脉栓塞化疗(TACE)。体检:皮肤、巩膜轻度黄染,无压痛和反跳痛。上腹部增强CT(图7):肝内肿瘤复发,肝右叶局限性胆管扩张;胆总管扩张,腔内密度稍高。实验室检查:总胆红素126.7 μmol/L,直接胆红素78.3 μmol/L,丙氨酸转氨酶156.3 U/L,天冬氨酸转氨酶173.4 U/L,γ-谷氨酰转移酶251.5 U/L,碱性磷酸酶184 U/L,大便潜血试验及AFP、癌胚抗原、糖类抗原(CA)19-9均为阴性。诊断:HCC伴胆管癌栓;梗阻性黄疸。入院后暂予护肝、退黄、解痉等治疗。MRI+MRCP(图8):肝多发占位;胆总管轻度增宽,下端局部增强病灶。经治疗后总胆红素逐渐下降,结合病史考虑胆管癌栓脱落,继续行护肝、退黄治疗,肝功能进一步恢复后行TACE及靶向免疫治疗,治疗后无明显不良反应,予以出院。
讨 论
HCC合并胆管癌栓在临床上并不常见,由Lin等[7]1975年首次报道,Lin等将伴有梗阻性黄疸的HCC归为“黄疸型肝癌”(icteric hepatoma)[8]。胆管癌栓多发生于胆总管中上段,肉眼下特征为灰白或棕绿色柱状或条索状物质,多数与胆管壁无紧密粘连,质软易碎[9]。根据所在位置可分为肉眼胆管癌栓(癌栓位于第一、第二级分支胆管或肝总管)和镜下胆管癌栓(癌栓位于三级或更远端分支胆管)[10],肉眼胆管癌栓由于常引起梗阻性黄疸而相关报道研究相对较多,镜下胆管癌栓常于术后病理发现,受关注较少。
胆管癌栓真正的形成机制尚不明确,先前研究表明可能为以下几种发生机制[11]:(1)肝癌细胞直接侵入肝内胆管;(2)肝癌细胞侵入静脉及淋巴管后逆行侵犯胆管壁;(3)门静脉癌栓侵犯邻近胆管;(4)肝癌细胞沿神经鞘的间隙侵入胆管壁;(5)肝癌细胞侵犯胆管的营养血管并穿破胆管上皮,进入胆管腔内。胆管癌栓是否侵犯胆管对癌栓扩散方式、手术切除范围以及肿瘤的复发转移均有重大意义。多数研究发现[10, 12-13],胆管癌栓一般不黏附在胆管壁上或仅以蒂黏附于胆管壁,可以轻松去除,因此胆总管切开取栓术+受累肝段肝切除术是一种合理的手术方式,但曾弘等[14]的研究发现,胆管癌栓极可能以Paget病样方式扩散(胆管癌栓通过胆管上皮上下扩散),Peng等[15]研究发现胆管癌栓可能源于Hering管中的肝干/祖细胞,并且可能首先形成一些原发病变在肝内胆管内,因此目前对于是否切除肝外胆管仍存在争议。
HCC合并胆管癌栓无特异性症状,一般以右上腹不适、腹痛、发热、黄疸等为首要表现,癌栓可坏死脱落使胆管再通而形成波动性黄疸,有时癌栓脱落会引发胰腺炎为首要表现[16-17]。临床上容易误诊为胆管癌、胆道结石、胆管炎等,特别是在肝内肿瘤较小或未见明显病灶、AFP阴性以及CA19-9异常升高的情况时,正如病例1,由于肝内未见明显病灶且AFP阴性,术前极易误诊为胆管癌。
术前诊断目前主要依赖于影像学检查:(1)超声能够发现肝内较大肿物,胆管癌栓表现为管腔内稍低回声或等回声的软组织影,梗阻平面以上胆管扩张,此外,彩色多普勒超声可提示癌栓内血供情况[12],内镜超声对于区分息肉型胆管癌也有一定价值[18];(2)CT是常用的诊断方式之一,平扫期肝内病灶和胆管癌栓的表现为低密度影,癌栓梗阻平面以上表现为胆管扩张,增强检查动脉期肝内病灶和胆管癌栓表现为高密度影,静脉期呈低密度影[19];(3)MRI及MRCP诊断准确率高,建议作为首选影像学诊断方法[20],可清晰地显示肝内病灶、胆管癌栓的大小形态以及肝内外胆管状态等,MRCP检查胆管内充盈缺损、胆管显像突然截断﹑梗阻平面以上胆管扩张等是胆管癌栓的典型表现;(4)ERCP可较为直观地显示胆管梗阻部位及狭窄程度,并可取活检进行病理检查,但属于有创检查,可能会引起胰腺炎、感染、消化道穿孔等并发症。对于胆管癌栓尚无特异性血清标志物,多数病人常出现血清总胆红素升高,可同时伴有碱性磷酸酶和γ-谷氨酰转移酶增高,但特异度不高。Tan等[21]报道L-瓜氨酸和D-天冬氨酸可能是胆管癌栓潜在的标志物。胆道镜检查对于胆管癌栓的鉴别诊断具有重要价值,Inoue等[22]报道1例采用胆道镜诊断胆管癌栓的病例,尤其是肝硬化病人,当不能排除胆管癌栓时,应考虑胆管镜检查,霉菌样组织碎片是脱落的胆管癌栓的典型特征。结合病例1,对于肝内未见明显肿瘤合并胆管癌栓的病人,术前诊断极为困难,具有肝硬化病史或乙型肝炎病史的病人,即使AFP阴性,结合影像学典型表现也应考虑胆管癌栓的潜在可能性,可行术中超声或胆道镜检查进一步明确诊断。
目前胆管癌栓的分型主要依据癌栓累及不同级别的胆管,国际上有Ueda分型[23]、Satoh分型[5]、日本肝癌研究小组分型[24]等,但没有循证依据表明这些分型对于治疗方式选择和改善预后有重要意义[25]。国内共识编写委员会推荐使用程树群团队提出的分型[20],该分型是目前唯一同时包含胆管癌栓范围和胆红素的临床分型,可在一定程度上指导治疗方式选择,提出将胆管癌栓分为肝内型和肝外型[26]:(1)肝内型(Ⅰ型),即癌栓位于肝内,其中Ⅰa型为胆管二级分支及以上癌栓,Ⅰb为胆管二级分支癌栓;(2)肝外型(Ⅱ型),即癌栓位于肝/胆总管内,其中Ⅱa型为总胆红素<300 μmol/L,Ⅱb型为总胆红素≥300 μmol/L。
手术治疗为主的综合治疗是目前一线治疗方式,治疗原则是最大程度清除或控制肝癌及胆管癌栓,减少术后复发。主要手术方式有以下几种:(1)肝癌切除+胆总管切开取癌栓术+T管引流术,适用于肝癌可切除且肝外胆管增粗并能触及癌栓者;(2)肝癌切除+肝外胆管切除术+胆-肠吻合术,适用于术中快速病理证实胆管癌栓侵犯胆管壁或与胆管壁粘连致密,不易分离者;(3)胆总管切开取癌栓+T管引流术,适用于HCC体积过小而不能在术前、术中发现,或HCC邻近重要血管难以切除以及肝功能储备差等情况;(4)肝移植术,目前缺少相关治疗的大宗报道,主要问题为术后肿瘤高复发率;(5)减黄手术,适用于Ⅱb型转换为Ⅱa型进行手术者,合并梗阻性黄疸时间超过4周或急性胆管炎或合并营养不良的高龄病人[20];(6)射频消融术,赵向前等[27]回顾14例病例发现,对于不能手术切除的肝癌合并胆管癌栓病人,射频消融安全有效,能明显减少取癌栓过程中出血。Cui等[28]发现经皮胆管内射频消融术和胆道金属支架置入术在技术上可能是安全可行的选择。此外,术后联合TACE、放射治疗、抗病毒治疗以及靶向免疫治疗,可在一定程度上降低复发率和改善病人生存[20]。
目前,合并胆管癌栓对HCC病人远期生存是否产生影响,以及胆管癌栓是否作为HCC的独立危险因素,仍存在争议。Navadgi等[29]的Meta分析显示,HCC合并胆管癌栓病人与不伴胆管癌栓的HCC病人相比,两者的术后1年和3年生存率的差异无统计学意义,但前者的5年生存率较低。一项日韩多中心研究表明[30],胆管癌栓对生存影响并没有血管侵犯那么显著,预后主要受肿瘤分期及肝功能影响,积极手术对HCC合并胆管癌栓病人远期生存有较大改善。但Orimo等[10]、Yang等[31]、Pang等[32]研究表明HCC合并胆管癌栓病人生存率明显低于不伴胆管癌栓的HCC病人。Lu等[33]研究建议巴塞罗那临床肝癌分期系统(BCLC)增加胆管癌栓以更好地评估HCC病人预后。Yang等[34]研究表明肝切除术后合并胆管癌栓HCC病人的1、2、3年总生存率及无病生存率显著低于合并门静脉癌栓的HCC病人。由于此病发病率较低,往往大多数研究纳入病例数较少,组间病例存在较大的异质性,且大多数研究基于回顾性研究,因此仍需进一步的大样本高质量研究论证。
HCC术后肿瘤复发率很高,结合病例2,对于术后复发的病人,尤其是合并有黄疸者应高度重视是否有胆管癌栓发生。部分病例肝内原发灶不易发现,虽同时合并有胆石症,临床上仍需警惕胆管癌栓的可能。本组2例病人经保守治疗之后均不再腹痛、黄疸消退,例1病人治疗后CA19-9降至正常,临床表现上极似胆石症。总之,尽管目前对于HCC合并胆管癌栓的诊治有了一定的经验与共识,但胆管癌栓的形成机制尚不明确、术前误诊率较高、现有临床分型还不完善、国内专家共识循证等级还较低,这些仍需更多学者努力。
利益冲突所有作者均声明不存在利益冲突
(本文图1~图8见封四)
