特应性皮炎患儿食物致敏危险因素分析:一项单中心横断面研究
2022-08-23王丹吴雪歌阎诗周甜甜黄亚娇李洁罗晓燕
王丹 吴雪歌 阎诗 周甜甜 黄亚娇 李洁 罗晓燕
(重庆医科大学附属儿童医院皮肤科/国家儿童健康与疾病临床医学研究中心/儿童发育疾病研究教育部重点实验室/儿童感染免疫重庆市重点实验室,重庆 401122)
特应性皮炎(atopic dermatitis,AD)是儿童期常见的慢性、复发性和瘙痒性皮肤病,可严重损害患儿及其家庭生活质量[1]。亚洲儿童AD患病率可达0.96%~22.6%[2]。AD与食物过敏原密切相关,AD患者食物致敏率可达60%[3],经口服食物激发(oral food challenge)确诊的食物过敏(food allergy,FA)率达30%[4]。AD患儿常见食物过敏原为鸡蛋、牛奶、小麦和大豆等[5]。环境中食物过敏原与AD受损皮肤接触后,刺激表皮抗原呈递细胞产生特异性IgE抗体,诱导食物致敏发生,并可能进展为FA[6]。食物致敏可促进AD特应性进程。一项加拿大前瞻队列研究显示,1岁时合并食物致敏的AD患儿3岁时患支气管哮喘和过敏性鼻炎(allergic rhinitis,AR)风险显著增加[7]。国外研究报道早发严重AD是食物致敏的危险因素[8],合并FA的AD患儿生活质量更差[9]。AD常见的客观次要体征也与食物过敏原存在关联,掌纹症在鸡蛋致敏或花生过敏的患儿中更常见[10-11]。然而,关于AD与食物致敏的研究仍有限,尤其是在婴幼儿AD患者中。本研究旨在探讨3~36月龄AD患儿食物致敏的危险因素,以及食物致敏对生活质量和AD客观次要体征的影响。
1 资料与方法
1.1 研究对象
回顾性收集2020年1月至2021年10月在重庆医科大学附属儿童医院皮肤科就诊的241例3~36月龄、确诊为AD患儿的资料。AD符合Hanifin-Rajka诊断标准[12]。
该研究已在中国临床试验注册中心(http://www.chictr.org.cn/) 注 册,注 册 号 为ChiCTR2000031816,并得到所有患儿父母的知情同意。
1.2 资料收集
通过临床病例报告表收集数据,使用Gooclin数据库记录,收集患儿年龄、性别、身高、体重、生活区域(市中心、城郊/乡镇/村落)、出生方式、出生体重、出生季节、喂养方式、AD首发月龄、病情严重度、客观次要体征、宠物喂养史、二手烟接触史、父母文化水平、父母过敏性疾病史(支气管哮喘、AR、AD)、食物皮肤点刺试验(skin prick test,SPT)或食物特异性IgE(specific IgE,sIgE)、血清总IgE和嗜酸性粒细胞计数结果。
1.3 食物致敏定义及检测方法
241例患儿中,202例(83.8%)进行了SPT检查,39例(16.2%)进行了sIgE检测。根据SPT或sIgE结果将AD患儿分为无食物致敏组和食物致敏组进行比较。食物致敏定义为任一食物SPT平均风团直径≥3 mm或任一食物sIgE水平≥0.35 KU/L[13]。多种食物致敏定义为2种或2种以上食物致敏。
SPT试剂购自北京新华联协和药业有限责任公司(中国),按照试剂盒说明书操作。使用组胺(1 mg/mL)和无菌0.9%氯化钠溶液分别作为阳性和阴性对照。检测的食物包括鸡蛋、牛奶、花生、大豆、牛肉、羊肉、鲫鱼、海虾、河蟹、小麦、芒果等11种。
使用欧蒙印迹法[EUROLINE Atopy China(IgE)]检测患儿血清食物sIgE水平,测定食物包括鸡蛋、牛奶、花生、大豆、牛肉、羊肉、海鱼、虾、蟹等9种。
1.4 AD严重度及生活质量评估
使用特应性皮炎积分指数(Scoring Atopic Dermatitis Index,SCORAD)[14]评估AD严重度,总分0~103分:<25分为轻度AD,25~50分为中度AD,>50分为重度AD。使用源自患者的湿疹评价量表(Patient-Oriented Eczema Measure,POEM)[15]从患儿家长角度评估AD严重度,分值越高AD越严重。使用婴儿皮肤病生活质量指数(Infant's Dermatology Quality of Life Index,IDQoL)[16]进行生活质量评估,总分0~30分,得分越高生活质量越低。
1.5 体格检查
由接受过统一培训的儿童皮肤科医师根据Hanifin-Rajka诊断标准[12]中的客观次要体征对患儿进行体格检查并记录,比较11项次要体征在食物致敏与无食物致敏患儿中的差异。11项次要体征为:干皮症、鱼鳞病、掌纹症、毛周角化症、非特异性手足皮炎、乳头湿疹、口角唇炎、眶周黑晕、面部皮炎、白色糠疹和颈前皱褶。
1.6 统计学分析
采用SPSS 26.0统计软件进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用两样本t检验;不符合正态分布的计量资料以中位数(四分位数间距)[P50(P25,P75)]表示,组间比较采用Wilcoxon秩和检验。计数资料以例数和百分率(%)表示,组间比较采用χ2检验或校正χ2检验。采用多因素logistic回归分析确定食物致敏的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
共纳入241例AD患儿,中位年龄为9.0个月,男性144例(59.8%),女性97例(40.2%)。进行SPT的202例患儿中,101例(50.0%)存在食物致敏。进行sIgE检查的39例患儿中,26例(66.7%)存在食物致敏。合计127例(52.7%)患儿对至少1种食物致敏,51例(21.2%)对多种食物致敏,114例(47.3%)无食物致敏。多种食物致敏最常见组合是鸡蛋+牛奶(n=24)和鸡蛋+花生(n=14)。位居前3位的食物致敏原为:鸡蛋(116例,48.1%)、牛奶(30例,12.4%)、花生(16例,6.6%),见图1。

图1 特应性皮炎患儿不同种类食物致敏频率
食物致敏组与无食物致敏组出生季节的比较差异有统计学意义(P=0.028)。食物致敏组总IgE水平>150 IU/mL患儿比例显著高于无食物致敏组(P=0.031)。见表1。
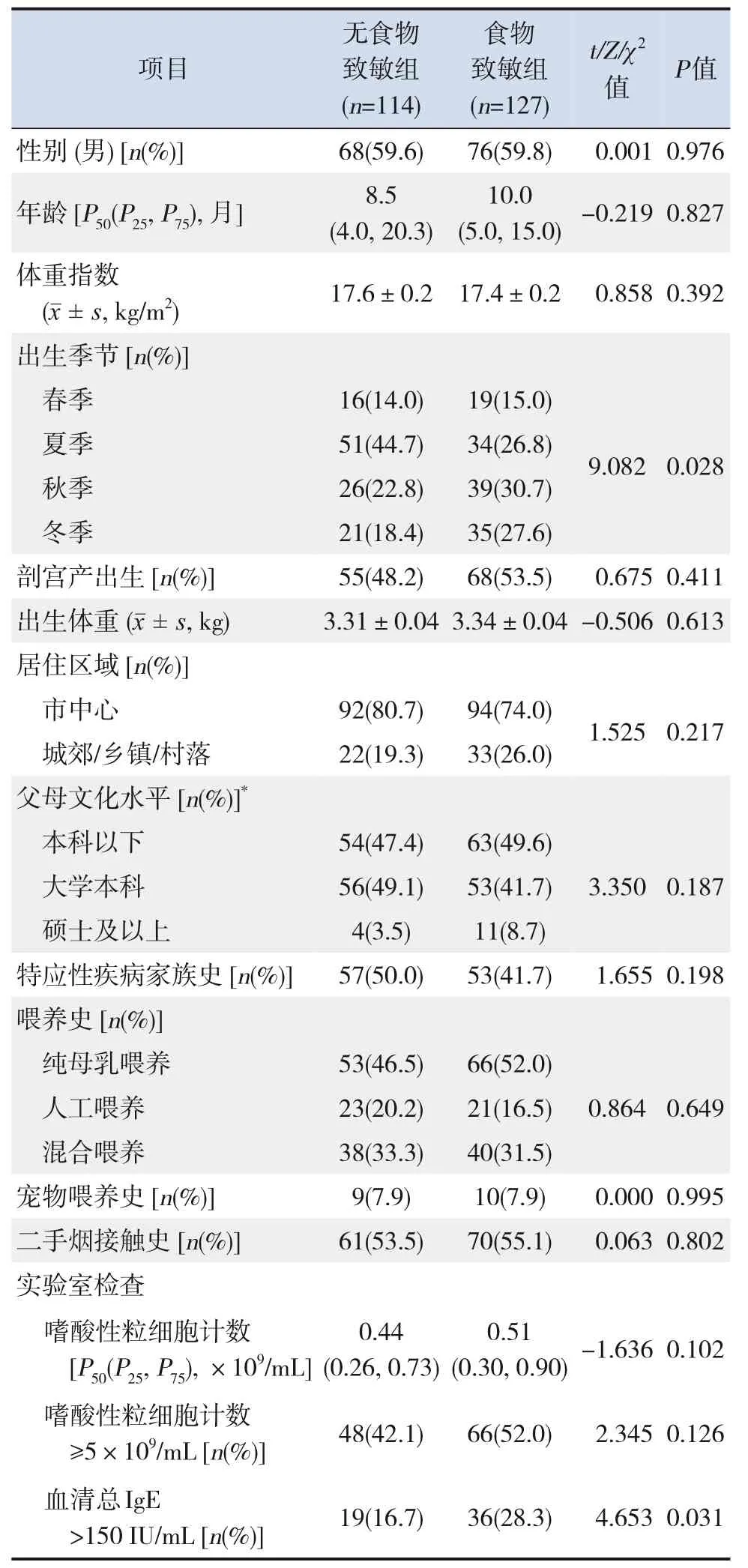
表1 食物致敏组与无食物致敏组人口学特征及实验室检查结果的比较
2.2 食物致敏与AD发病年龄及严重度的关联
食物致敏组AD发病年龄分布与无食物致敏组比较差异有统计学意义(P=0.030)。两组严重程度的比较差异有统计学意义(P=0.009)。两组间AD曾完全缓解率差异无统计学意义(P=0.476),但在完全缓解的患儿中,食物致敏组AD最长完全缓解时间短于非食物致敏组(P=0.022)。见表2。
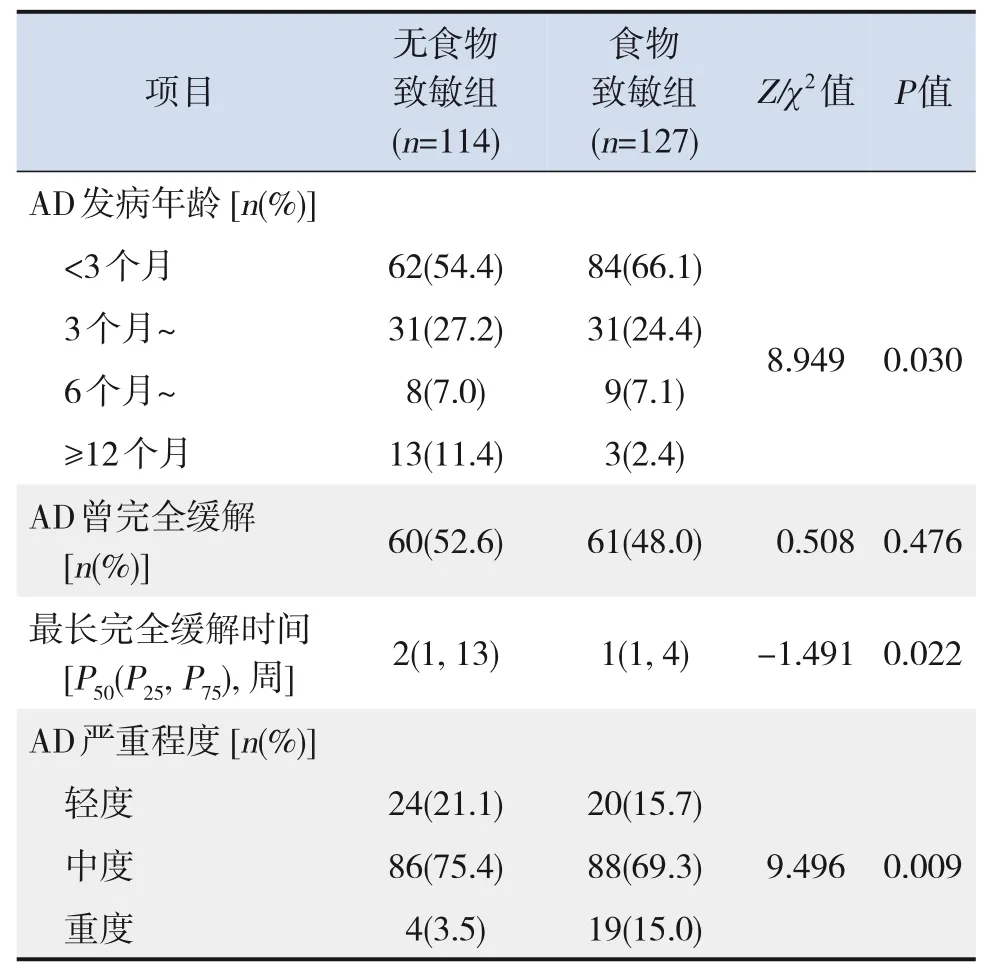
表2 食物致敏组与无食物致敏组AD发病年龄及严重度的比较
2.3 食物致敏与生活质量的关联
食物致敏组POEM评分总分和IDQoL总分均显著高于无食物致敏组(P<0.05)。在IDQoL评估中,两组平均每晚被影响睡眠时间及湿疹影响三餐程度的比较差异有统计学意义(P<0.05)。见表3。

表3 食物致敏组与无食物致敏组POEM及IDQoL评分比较
100例(41.5%)患儿父母通过食物回避试图改善AD,以鸡蛋(73.0%)为主,其次为牛奶(33.0%)。依据过敏原结果进行食物回避58例(58.0%),依据经验回避42例(42.0%)。根据食物过敏原结果采取食物回避的父母报告患儿AD改善率为57%(33/58),依据经验回避为33%(14/42),两者差异有统计学意义(χ2=5.430,P=0.020)。
2.4 食物致敏与AD次要体征的关联
食物致敏组与无食物致敏组11个客观次要体征的比较显示,食物致敏组非特异性手足皮炎及掌纹症的发生率显著高于无食物致敏组(P<0.05),见表4。

表4 食物致敏组与无食物致敏组客观次要体征的比较[n(%)]
2.5 单种食物致敏与多种食物致敏患儿喂养及病情严重程度的比较
多种食物致敏患儿与单种食物致敏患儿相比,纯母乳喂养比例更高,血清总IgE>150 IU/mL患儿比例更高,SCORAD和POEM总分更高,差异均有统计学意义(P<0.05),见表5。

表5 单种食物致敏与多种食物致敏患儿喂养及病情严重程度的比较
2.6 AD患儿食物致敏危险因素的多因素logistic分析
将表1和表2资料比较中显示对食物致敏有影响的因素纳入多因素logistic回归分析,结果显示秋季/冬季出生、AD发病年龄<12个月、重度AD和血清总IgE水平>150 IU/mL与食物致敏显著相关(P<0.05),见表6。

表6 AD患儿食物致敏危险因素的多因素logistic分析
3 讨论
本研究显示:3~36月龄AD患儿食物致敏率为52.7%;食物致敏与出生季节、AD发病年龄及严重程度、血清总IgE水平显著相关;食物致敏的AD患儿生活质量更差,且更容易出现非特异性手足皮炎及掌纹症。据我们所知,本研究是国内进行的首个AD与食物致敏相关性分析的研究。
本研究多因素logistic回归分析显示,秋季和冬季出生的AD患儿食物致敏风险显著增加。国外研究报道出生季节与食物致敏有关[17]。出生季节可能通过多种机制影响食物致敏及FA的发展,包括过敏原暴露和出生第1年的维生素D水平等[17],秋冬季节出生的患儿接受日照较少,体内维生素D水平较低。既往出生队列研究显示,生命早期持续低维生素D水平可增加食物致敏风险(OR=2.03,95%CI:1.02~4.04)[18]。体内低维生素D水平与严重AD有关[19]。维生素D缺乏可能通过破坏上皮屏障完整性和促进免疫失衡加重AD[20],增加食物抗原经皮致敏风险。
食物致敏与AD发病年龄及严重程度有关,AD发病年龄越早,病情越严重,食物致敏发生率越高[8]。本研究发现重度AD及AD发病年龄<12个月的患儿食物致敏风险增加,多种食物致敏患儿与单一食物致敏患儿相比AD更严重。泰国一项包含119名AD患儿的研究发现重度AD是食物致敏危险因素,而早发AD则与食物致敏无关[3]。与既往研究[21]一致,本研究中总IgE水平>150 IU/mL的患儿食物致敏风险增加,多种食物致敏患儿血清IgE>150 IU/mL的比例显著高于单一食物致敏患儿。血清IgE水平与AD严重程度有关[22],AD中Th2介导的皮肤炎症引起血清IgE升高[6]。早发重度AD及IgE水平异常患儿食物致敏风险增加,与患儿更严重的皮肤屏障功能障碍和Th2型免疫炎症激活有关[6]。皮肤屏障完整性受到遗传及环境因素影响,聚丝蛋白(filaggrin)基因的功能缺失突变在AD及食物致敏发生机制中起到重要作用,并可能与AD早发及严重程度有关[23]。另外Th2型免疫激活会下调编码皮肤屏障蛋白相关基因,如filaggrin、loricrin和involucrin等表达,加重皮肤屏障破坏,利于食物过敏原穿透皮肤,引发致敏[24]。
AD严重影响患儿及其家庭生活质量[1]。本研究显示食物致敏患儿生活质量更差。食物致敏患儿睡眠及三餐被影响程度更高。患儿父母担心食物加重或诱发AD,辅食喂养更小心、更单一[25]。本研究中多种食物致敏患儿纯母乳喂养比例更高,可能与母乳喂养可预防食物致敏的观念有关[26],不代表母乳喂养会增加多重食物致敏风险,因为本研究为横断面研究,不代表因果关系。本研究中100名(41.5%)患儿父母通过食物回避试图改善AD,鸡蛋是最常见的食物,仅47%的家长认为回避饮食后AD缓解,根据过敏原结果进行食物回避的患儿AD改善率更高。既往研究发现12%~30%的AD患儿食物过敏表现为进食致敏食物6~48 h后AD复发或加重[4]。SPT和sIgE检查可识别食物致敏,但FA的诊断需有相应临床表现,不是所有食物致敏患儿都会出现FA,双盲安慰剂对照食物激发 试 验 (double-blind,placebo-controlled food challenge)是诊断FA的金标准[5]。如果本研究能通过食物激发确认患儿进食致敏食物后AD复发或加重,将更能说明依据食物过敏原检查进行食物回避改善AD的合理性。
本研究显示,食物致敏AD患儿掌纹症及非特异性手足皮炎的发生率更高。掌纹症是皮肤屏障异常及filaggrin基因突变的典型临床特征[27],可定义为“掌面存在5条以上长于1 cm的较深掌纹,特别是在鱼际隆起区域”。掌纹症可提示AD患儿存在潜在filaggrin基因突变[10],并和花生过敏、鸡蛋过敏有关[10-11]。食物致敏AD患儿非特异性手足皮炎发生率更高,可能与食物致敏患儿AD病情更严重有关。
本研究存在一些局限。首先,该研究为横断面研究,只反映AD患儿某些特征与食物致敏的关联,无法推断因果关系。其次,研究中食物致敏检测方法未统一,83.8%患儿进行SPT,16.2%患儿进行sIgE检测,这两种方法在结果一致性方面存在争议[28],结果会有一定误差。此外,我们研究了食物致敏的危险因素,而致敏不等同于过敏,FA诊断需结合临床症状,若能通过经口服食物激发确认患儿FA患病情况,本研究将更有意义。
综上,本研究显示,食物致敏在AD婴幼儿中十分常见,秋冬季出生、早发AD、重度AD及IgE>150 IU/mL的患儿更易发生食物致敏。食物致敏会损害生活质量,食物致敏患儿更容易出现非特异性手足皮炎及掌纹症。未来还需进一步研究上述因素在食物致敏中的作用机制,为AD患儿预防食物致敏及后续FA等提供依据。
