甲酸和木醋液对苜蓿青贮细菌群落结构的影响
2022-03-07王丽学陈龙宾余新越刘景喜霍文娟
王丽学,韩 静,陈龙宾,余新越,刘景喜,马 毅,霍文娟
(1天津市农业科学院信息研究所,天津 300192;2天津市农业动物繁育与健康养殖重点实验室,天津 300384;3天津市农业科学院畜牧兽医研究所,天津 300381;4天津师范大学地理与环境科学学院,天津 300387;5天津市农业科学院农产品保鲜与加工技术研究所,天津 300381)
0 引言
苜蓿(Medicago sativa)是豆科苜蓿属多年生草本植物,其蛋白含量高,被誉为“牧草之王”[1],但其水溶性碳水化合物含量低、缓冲能值高且自身附着乳酸菌少,导致苜蓿青贮过程中pH降低困难,易发生有害菌发酵,故优质苜蓿青贮需要外源添加剂[2]。青贮过程是一个复杂微生物菌群(如乳酸菌、酵母菌、霉菌等)的活动过程[3],菌群特征直接影响牧草青贮品质[4],甚至进一步影响反刍动物瘤胃微生物群系[5-6]。
研究表明,青贮微生物群落因青贮物料自身特征[7-8]、外源添加物质[9-10]或添加剂[11-12]、青贮方式[13]及青贮物料生长的土壤环境[14]等多种因素的影响而存在差异。青贮细菌群落结构研究不但可以解释青贮品质的变化,同时还有助于菌株筛选进而用于青贮添加剂开发,尤其对于苜蓿类较难青贮的牧草而言意义重大。目前,有关苜蓿青贮细菌群落结构的研究,多集中于乳酸菌剂[15-16]、纤维素酶[6,15]、糖[12]等发酵促进剂的影响,及与其他牧草混合青贮的效应[10]等方面,而有关抑制型青贮添加剂对苜蓿青贮细菌群落组成的影响报道较少。
抑制型青贮添加剂如甲酸、乙酸等可通过抑制不良微生物发酵实现青贮物料的有效保存[17-18],其中甲酸可在短时间内降低苜蓿青贮pH,提高青贮品质[19]。木醋液是植物性原料炭化或干馏过程中产生的气体混合物经冷凝、回收、分离后获得的有机产品,属于植物酸类混合物,安全、无污染、无残留,可用作饲料添加剂、有机肥发酵剂等[20],课题组前期研究表明木醋液作为青贮添加剂可提高苜蓿青贮发酵品质,其乳酸含量显著高于对照和甲酸处理[21]。本研究以甲酸和木醋液作为青贮添加剂制作苜蓿青贮,运用高通量测序技术分析了细菌群落组成,并结合苜蓿青贮主要营养和发酵品质探讨二者的作用机理,旨在为其在苜蓿青贮中的应用提供参考。
1 材料与方法
1.1 试验材料
试验用苜蓿为丹农种子公司提供的北极熊品种,种植于天津市农业科学院资源与环境研究所的“滨海盐碱地绿化土壤改良科研试验基地”。试验用精制木醋液(pH 2.7)和甲酸(分析纯)均为市售。
1.2 试验设计
试验于2016年10月开展,设2个添加剂处理,分别为木醋液(B组)和甲酸(C组),以等量蒸馏水替代添加剂处理为对照(A组)。苜蓿刈割后晾晒24 h,其干物质含量为(23.02±0.70)%,切割至2~5 cm小段,分别按6 mL/kg的剂量将添加物均匀喷洒在切割好的苜蓿上混匀,装入特制聚乙烯塑料袋(25 cm×35 cm),每袋300 g,每个处理3个重复,用真空封口机进行抽真空后封口。室温条件发酵45 d后,在每个样品的非表层部分用经高温灭菌的镊子按照五点采样法采集苜蓿青贮样品20 g左右,先液氮速冻,再存于-80℃冰箱中,用于细菌群落结构测定与分析。
1.3 细菌群落结构测定与分析
苜蓿青贮样品细菌群落结构测定由上海派森诺生物科技股份有限公司完成。采用Illumina MiSeq平台,选用长度约为280 bp的细菌16S rRNA基因高度可变的V3-V4区进行测序,其PCR扩增引物为338F(5'-3')ACTCCTACGGGAGGCAGCA,806R(5'-3')GGACTACHVGGGTWTCTAAT。PCR反应体系(25 μL):Q5高保真DNA聚合酶0.25 μL,5×反应缓冲液5 μL,5×高GC缓冲液5 μL,10 mMdNTP0.5 μL,模板 DNA 1 μL,10 μM 正、反向引物各 1 μL,ddH2O 11.25 μL。PCR程序:98℃30 s;98℃15 s,50℃30 s,25~27个循环;72℃ 30 s,72℃ 5 min,于4℃保存。扩增结果通过2%琼脂糖凝胶电泳切取目的片段并用Axygen凝胶回收试剂盒回收。利用Quant-iT PicoGreen dsDNA Assay Kit对PCR产物在Microplate reader(BioTek,FLx800)上进行定量,然后按照每个样品所需数据量进行混样。利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit构建文库。在Agilent Bioanalyzer机器上用Agilent High Sensitivity DNA Kit对文库做2100质检,利用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor上对文库进行定量,合格的文库在MiSeq机器上利用MiSeq Reagent Kit V3(600cycles)进行2×300 bp的双端测序。
运用R软件对测序数据进行分析。首先对所获序列预处理,评估有效序列质量,获得可用于后续分析的高质量序列;然后对高质量序列按照97%的序列相似度划分可操作分类单元(Operational Taxonomic Unit,OTU);再将丰度值高于0.001%的OTU代表序列与细菌16S rRNA基因数据库的模板序列进行比对,即可获取每个OTU所对应的分类学信息。采用IBM SPSS Statistics 20.0对苜蓿青贮细菌分类学信息进行单因素方差分析(ANOVA)及主成分分析(Principal Component Analysis,PCA),并运用Duncan法进行多重比较,通过SigmaPlot12.0软件作图,文中数据均以“均值±标准差”表示。
1.3.1 细菌群落组成 对不同处理在门、纲、目、科、属、种水平的OTU序列和菌群数量信息进行单因素方差分析,着重分析不同处理在门、属水平的细菌群落组成差异,并根据组间差异获得如耐酸乳酸菌等重要物种信息。
1.3.2 细菌群落多样性 选择Chao1、ACE、Shannon和Simpson 4个指数进行分析。Chao1丰富度指数通过计算群落中只检测到1次和2次的OTU数(即“Singleton”和“Doubleton”),估计群落中实际存在的物种数;ACE丰富度指数默认将序列量10以下的OTU都计算在内,估计群落中实际存在的物种数;Shannon和Simpson多样性指数综合考虑了群落的丰富度和均匀度,前者对丰富度和稀有OTU更敏感,而后者对均匀度和优势OTU更敏感。
1.3.3 细菌群落结构及多样性与营养和发酵品质的关系 通过PCA分析苜蓿青贮细菌群落结构及多样性指标与其营养和发酵品质的关系,进一步探讨甲酸和木醋液对苜蓿青贮品质影响的作用机理。
2 结果
2.1 苜蓿青贮细菌群落组成分析
高通量测序结果显示,9个苜蓿青贮样品获得有效序列41461~55384个(合计429886个),其中高质量序列39105~48470个(合计395074个),占有效序列的87.52%~96.43%(平均91.90%),物种累计曲线最终趋于平缓,说明样本量足以反映群落的丰富度,且所有的OTU均可归属至已知分类单元(门、纲、目、科、属)。根据OTU及细菌类群分类地位鉴定结果(图1),门、纲、目、科、属、种水平的OTU数量及细菌类群数均表现为A组<B组<C组,其中在纲、目水平A组与C组差异显著,而在科、属、种水平A、B组与C组差异均显著。
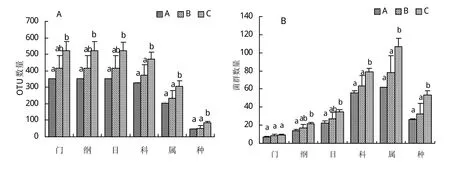
图1 苜蓿青贮样品细菌序列(OTU)划分及细菌类群分类地位统计
2.1.1 门水平细菌组间差异 由苜蓿青贮在门水平的组间差异(表1)可知,厚壁菌门(Firmicates)丰度表现为B组>A组>C组,组间差异均显著;变形菌门(Proteobacteria)丰度表现为A组>B组>C组,组间差异均显著;蓝细菌门(Cyanobacteria)丰度均表现为C组显著高于A、B组;放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、梭杆菌门(Fusobacteria)和浮霉菌门(Planctomycetes)丰度较低,均以C组最高。由此可见,对照组以变形菌门为优势,丰度为57.726%,然后是厚壁菌门(40.345%);木醋液组则以厚壁菌门为优势,丰度为55.687%,然后是变形菌门(37.050%);而甲酸组以蓝细菌门为优势,丰度为61.775%,然后依次是变形菌门(21.771%)和厚壁菌门(12.996%)。
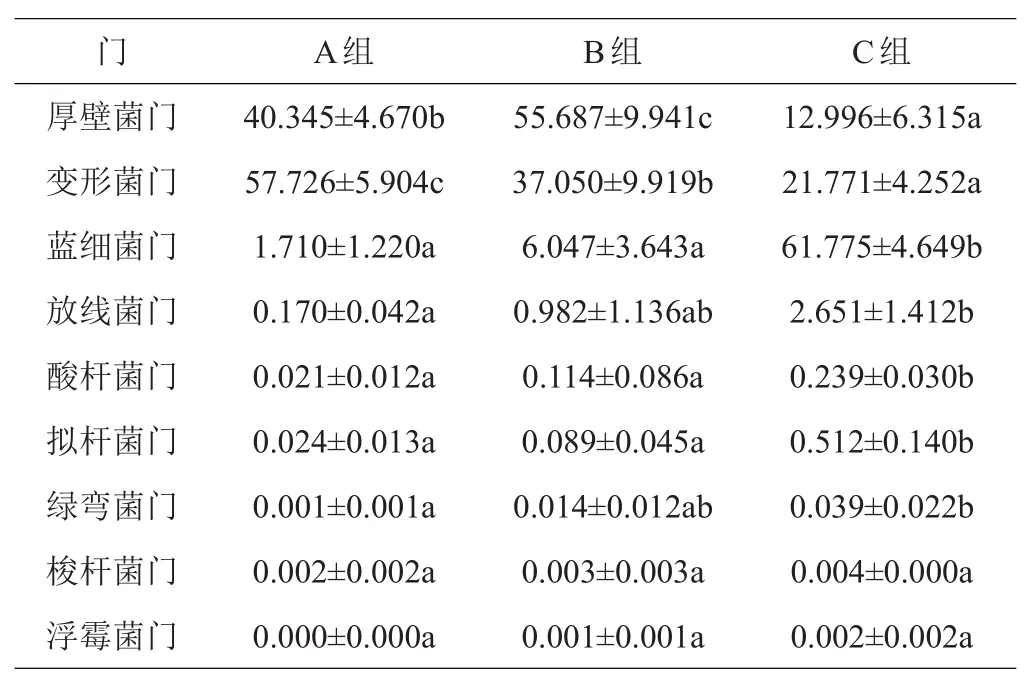
表1 苜蓿青贮细菌群落门水平丰度的组间差异 %
2.1.2 属水平细菌组间差异 对苜蓿青贮丰度大于1%的属进行统计分析,结果(表2)可知,厚壁菌门、变形菌门、蓝细菌门和放线菌门分别有9,8,1,1个属的丰度大于1%。厚壁菌门中,肠球菌属(Enterococcus)丰度最高,表现为B组>A组>C组,组间差异均显著;芽孢杆菌属(Bacillus)和乳球菌属(Lactococcus)均表现为C组>B组>A组,其中芽孢杆菌属C组与A、B组差异显著,而乳球菌属B、C组与A组差异显著;乳杆菌目(Lactobacillales)未知科属、乳杆菌科(Lactobacillaceae)未知属、乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、明串珠菌科(Leuconostocaceae)未知属及明串珠菌属(Leuconostoc)的丰度组间差异均不显著。变形菌门中,肠杆菌科(Enterobacteriaceae)未知属丰度最高,表现为A组>B组>C组,组间差异均显著;羽扇豆属(Lupinus)和鞘脂单胞菌属(Sphingomonas)的丰度均表现为A组<B组<C组,A、B组与C组差异显著;特拉布斯氏菌属(Trabulsiella)丰度表现为A组>B组>C组,其中A、C组间差异显著;甲基杆菌属(Methylobacterium)、农杆菌属(Agrobacterium)、肠杆菌属(Enterobacter)、黄单胞菌科(Xanthomonadaceae)未知属的丰度组间差异均不显著。蓝细菌门的链型植物目(Streptophyta)未知科属及放线菌门微杆菌科(Microbacteriaceae)未知属的丰度均表现为C组>B组>A组,C组与A、B组差异显著。由此可见,对照组苜蓿青贮的优势菌群为变形菌门肠杆菌科未知属,其丰度为48.302%,然后是厚壁菌门肠球菌属(35.041%);木醋液组的优势菌群为厚壁菌门肠球菌属,其丰度为45.026%,然后是变形菌门肠杆菌科未知属(30.798%);甲酸组的优势菌群为蓝细菌门链型植物目未知科属,其丰度为61.747%,其他类群的丰度均低于10%。

表2 苜蓿青贮细菌群落门水平丰度的组间差异 %
2.2 苜蓿青贮细菌群落多样性分析
苜蓿青贮的细菌群落多样性分析结果(图2)表明,Chao1、ACE指数显示出与OTU及菌群数量相似的趋势,均表现为A组


图2 紫花苜蓿青贮样品细菌多样性指数
2.3 苜蓿青贮细菌群落结构与其营养和发酵品质的关系
以苜蓿青贮中出现的丰度较高菌门和多样性指数及苜蓿青贮主要营养和发酵品质指标[21]进行PCA分析,前3个主成分累计可解释苜蓿青贮样品88.786%的信息,以PC1和PC2作图(图3)。由图3可以看出,苜蓿青贮相关指标大致可以分为4组,I组为营养指标NFC含量与细菌群落蓝细菌门丰度及Chao1和ACE指数,与PC1负相关;II组为营养指标NDF、ADF和发酵指标pH、乳酸、乙酸、氨态氮含量及细菌群落厚壁菌门、变形菌门丰度,与PC1正相关;III组为细菌群落Shannon和Simpson指数,与PC2正相关;IV组为营养指标粗蛋白含量,与PC2负相关。从样品整体分布上看,受PC1影响,C组位于2、3象限,而A、B组位于1、4象限;受PC2影响,B组更偏向于第1象限,而A组更偏向于第4象限、C组更偏向于第3象限。
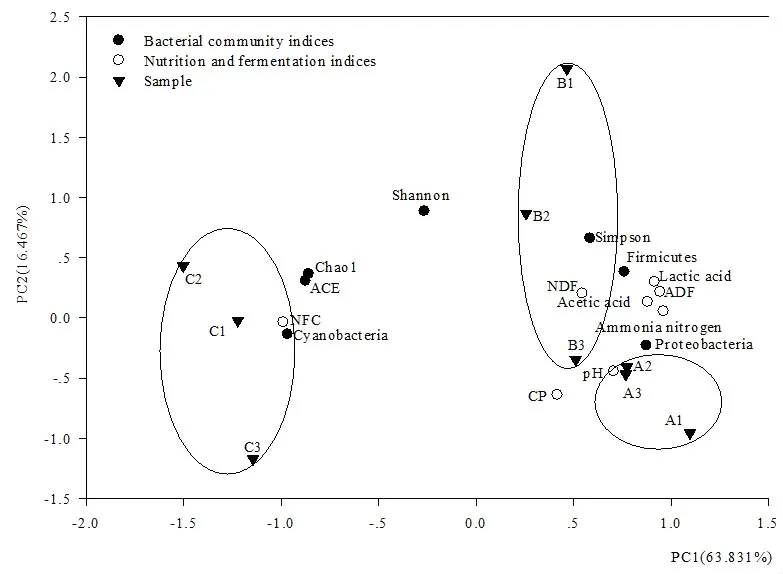
图3 苜蓿青贮细菌群落结构与其营养和发酵品质的主成分分析图
3 结论
与对照相比,木醋液提高了优势菌群厚壁菌门(Firmicutes)肠球菌属(Enterococcus)乳酸菌的丰度同时降低变形菌门(Proteobacteria)肠杆菌科(Enterobacteriaceae)丰度,有助于促进乳酸菌发酵;甲酸则显著降低了优势菌群厚壁菌门(Firmicutes)肠球菌属(Enterococcus)乳酸菌和变形菌门(Proteobacteria)肠杆菌科(Enterobacteriaceae)的丰度,即菌群繁殖被普遍抑制。这种细菌群落结构的变化可较好地解释木醋液和甲酸对苜蓿青贮营养和发酵品质的影响。
4 讨论
青贮饲料中参与乳酸发酵的细菌群落大多数属于厚壁菌门[16],其与变形菌门和蓝细菌门共同构成了鲜苜蓿的主要附生细菌群落,但因气候、地理位置等因素导致其丰度存在差异[8,15],自然发酵过程中,厚壁菌门逐渐占优势[3,16]。本研究中对照组自然发酵后以变形菌门为优势,而木醋液组则以厚壁菌门为优势,说明木醋液的添加有助于促进苜蓿良性发酵;甲酸组以蓝细菌门为优势,应该是苜蓿青贮发酵进程受到抑制,有研究表明甲酸处理下苜蓿青贮在5天内快速下降至最低而乳酸发酵在0.5天后减缓[22],故推测蓝细菌门(经后续鉴定主要由链型植物目(Streptophyta)未知科属组成的均一性群落)为苜蓿青贮样品菌群提取过程中的植物组织部分,具体尚有待于进一步验证。
乳酸菌是青贮发酵成功的关键微生物[23],分属于细菌界5个门的43个属[24],本研究中丰度>1%的厚壁菌门中的9个属均为乳酸菌。在未添加外源菌剂的情况下,青贮发酵后的细菌群落组成主要受附生菌群组成及特性影响[8,12],Ni等[25]研究报道肠球菌科、动球菌科(Planococcaceae)和肠杆菌科是鲜苜蓿的主要附生菌群,青贮后肠球菌科丰度增加至近50%而肠杆菌科保持在16%左右。本研究中对照组和木醋液组的肠球菌属和肠杆菌科未知属的丰度均较高,这与Ni等[25]的结果类似,故推断二者应该是本研究所用苜蓿的主要附生菌群。肠球菌属乳酸菌是近年应用较多的微生物菌种之一[26],肠杆菌可通过脱氨反应生成氨,减缓pH的降低[11],同时可与乳酸菌竞争可利用的水溶性碳水化合物[7],故良性发酵一般表现为乳酸菌丰度增加而肠杆菌丰度降低[10]。本研究中,与对照组相比,木醋液的添加显著降低了肠杆菌科的丰度,说明其为酸性抑制剂表现出了对有害菌群的抑制作用,但同时也显著提高了乳酸菌尤其是肠球菌属和乳球菌属的丰度,即说明木醋液对乳酸菌发酵没有抑制作用反而表现为促进,这与Ogunade等[16]报道丙酸处理并没有影响优势乳酸菌属丰度的结果类似,可能是因为木醋液的添加为苜蓿青贮中的乳酸菌提供了更适宜的发酵环境。但甲酸处理显著抑制了大多数细菌包括有害菌和乳酸菌的发酵,作为其优势菌群的蓝细菌门链型植物目未知科属经推测应该为苜蓿青贮菌群提取过程中的植物组织部分,甲酸组中也有芽孢杆菌属、乳球菌属、鞘脂单胞菌属、羽扇豆属(推测应该是植物组织部分)和微杆菌科未知属的丰度较对照组显著提高,说明这些菌属应该属于耐酸性较强的菌群,后续可对其进行进一步的鉴定和筛选,用于苜蓿青贮添加菌剂的开发。
主成分分析结果表明,厚壁菌门和变形菌门丰度越高,蓝细菌门丰度越低,苜蓿青贮中的乳酸、乙酸、氨态氮、NDF和ADF含量及pH越高,而NFC含量越低,这与Zheng等[12]报道的水溶性碳水化合物(属于NFC)含量低的青贮材料乙酸产量高且pH降低缓慢,及Ogunade等[16]报道的乳酸浓度与乳酸菌(本文中厚壁菌门中>1%的菌属均为乳酸菌)的丰度正相关类似。其中,甲酸组NFC含量较高、乳酸和乙酸含量较低且氨态氮含量为0[21],这进一步说明了甲酸抑制了苜蓿青贮发酵进程,减少了青贮底物的消耗,同时也降低了发酵产物,也进一步印证了蓝细菌门链型植物目未知科属属于苜蓿植物组织部分的推断。在厌氧环境中,厚壁菌门和变形菌门细菌能够有效降解纤维类物质,为微生物活动提供更多能量物质[27],故本研究中苜蓿青贮NDF和ADF含量均表现为木醋液组略低于对照组,在甲酸组变形菌门和厚壁菌门虽然丰度低但其NDF和ADF含量却显著低于对照组和木醋液组,这应该是由于甲酸对苜蓿酸化降解纤维类物质的影响[3]效果大于微生物群系作用的缘故;厚壁菌门多为乳酸菌,产乳酸有助于降低青贮pH,而变形菌门尤其是肠杆菌可通过脱氨反应生成氨,减缓青贮pH的降低[11],王雅雅等[28]报道变形菌门与pH正相关,本研究结果与之相同。
