类鼻疽伯克霍尔德菌ΔrelA 缺失株的构建及其生物学特性比较
2022-08-20吴兴勇李雪苗刘成利王彦双厉安洋夏乾峰
吴兴勇,李雪苗,刘成利,田 申,王彦双,厉安洋,朱 侨,夏乾峰
(1.海南医学院热带医学院,海南海口 571199;2.海南医学院热带转化医学教育部重点实验室,海南海口 571199)
广泛分布于热带和亚热带地区的类鼻疽伯克霍尔德菌(Burkholderia pseudomallei,B. pseudomallei)是类鼻疽的病原体,海南是我国类鼻疽高发地区[1,2]。B. pseudomallei毒力强,致病机制不清楚[3],从分子层面研究其致病机制十分重要。目前B.pseudomallei的基因编辑技术还不够完善,原核生物同源重组基因敲除技术是研究细菌基因功能的重要手段,以此为基础研发高效的基因敲除工具可为提升B.pseudomallei分子研究水平打下基础。
(p)ppGpp 是细菌应对外界各种不良环境压力的严谨反应机制,这种强烈的反应是由四磷酸鸟苷(ppGpp)和五磷酸鸟苷(pppGpp)介导营养匮乏胁迫条件下的应激信号系统,这种机制也可能促进抗生素耐受性[4,5]。(p)ppGpp 是由GDP 或GTP 通过relA和spoT两种酶合成,relA起主要合成作用,spoT是一种双功能酶,同时具有合成酶和水解酶的活性[6]。(p)ppGpp 影响细菌的生长、适应、运动、耐受性、毒力以及生物膜的形成和发育[7]。本研究通过构建HNBP001 的ΔrelA缺失菌株来探寻B. pseudomallei更有效且应用门槛低的基因敲除方法,并探究其对B. pseudomallei生长、泳动、生物被膜的影响。
1 材料与方法
1.1 菌株培养和重组质粒构建
类鼻疽伯克霍尔德菌HNBP001 由本课题组提供且基因组序列已上传至NCBI[8]。DH5α 感受态细胞和S17-1 感受态细胞均购自北京庄盟国际生物有限公司。除基因敲除转化子筛选用含15%蔗糖(不含NaCl)平板且在室温进行培养外,其余均于LB 培养基中37 ℃条件下进行培养,根据需要添加琼脂和相应浓度的抗生素。TPR-pK18mobSacB 重组质粒改造由本实验室刘成利老师构建并惠赠。
1.2 主要试剂和仪器
基因组提取试剂盒,天根;PCR 产物纯化试剂盒和质粒提取试剂,OMEGA;PrimeSTAR Max DNA Polymerase ,TaKaRa。限制性内切酶(BglⅡ、BamHⅠ、XbalⅠ、HindⅢ)和T4 DNA 连接酶,NEB。 YEAST,OXOID;TRYPTONE,OXOID;蔗糖,西陇科学;氯化钠,西陇科学;50×TAE Buffer,生工;细菌培养皿,biosharp;96 孔板,CELL TER;多功能酶标仪,Biotek;凝胶成像分析系统,君意;A2 生物安全柜,海尔;PCR 扩增仪,eppendorf。
1.3 引物
根据与NCBI 上的B. pseudomalleiK96243 基因组的序列比对分析确定HNBP001 的relA基因,NCBI 基因坐标位于1 号染色体上的2140463-2142700 (B. pseudomalleiK96243, 2317104-2319341)位置。 并根据GenBank 中HNBP001(GenBank:CP038806.1)的relA基因序列设计引物。引物ΔrelA-LF/ΔrelA-LR 与ΔrelA-RF/ΔrelARR,分别用于扩增relA基因的上下游同源臂;引物ΔrelA-VF/ΔrelA-VR 用于验证relA的基因缺失株。引物TPR-F/ TPR-R 用于扩增TPR 抗性片段。引物序列见表1 所示,均由生工生物工程(上海)股份有限公司合成。

表1 引物序列及酶切位点(酶切位点由下划线表示)Tab 1 Primer sequence and restriction site(restriction site indicated by underscore)
1.4 pK18mobSacB 质粒改造
以课题组田申老师惠赠的质粒为模板,根据制造商提供的序列,设计含BglⅡ酶切位点的一对引物TPR-F/TPR-R,使用TaKaRa 高保真酶扩增其含启动子的TPR 抗性片段。将扩增的基因产物进行纯化后分别使用限制性内切酶BglⅡ对TPR 抗性片段及pK18mobSacB 质粒分别进行单酶切,酶切产物纯化后经T4 DNA 连接酶进行连接。连接后转化DH5α 感受态细胞扩增质粒,TPR 抗性进行对应抗生素筛选后提取质粒,酶切进行验证,将改造质粒命名为TPR-pK18mobSacB。PCR 扩增条件:98 ℃变性10 s、59 ℃退火5 s、72 ℃延伸10 s,30 个循环。
1.5 缺失株构建
敲除载体的构建同pK18mobSacB 质粒改造方法,以HNBP001 的基因组为模板,引物ΔrelA-LF/ΔrelA-LR 和ΔrelA-RF/ΔrelA-RR 分别扩增待敲除目的基因relA的上下游同源臂(L,R),经酶切酶连将其连接至TPR-pK18mobSacB 上。将连接产物转化DH5α 感受态细胞,经含甲氧苄啶的培养基进行筛选,挑取单克隆于含有甲氧苄啶的液体培养基进行扩增,使用质粒小提试剂盒提取质粒后进行酶切验证,将酶切验证正确的质粒送至生工生物工程(上海)股份有限公司进行测序。取测序正确的质粒转化S17-1 感受态细胞,S17-1 感受态细胞具有天然的壮观霉素、链霉素和甲氧苄啶抗性,必须使用卡那霉素进行转化子的筛选。挑取含卡那霉素抗性的单菌落以及用无抗LB 培养的HNBP001 新鲜单菌落分别用LB 液体培养基进行培养。
一般在生长14~16 h 后,菌液达到转化所需的浓度。利用两个灭菌的1.5 mL 离心管各收集1 mL菌液,5 400 g 离心5 min,利用500 mL 的LB 清洗菌体,并最终使用500 mL 的LB 对菌体重悬,各取100 μL 混合于一个新的1.5 mL 离心管中。取20 μL 混合的菌液滴加在灭过菌的滤膜上,37℃培养箱,正置培养4~5 h。在滤纸上菌液处滴加20 μL LB 培养基,对菌体进行重悬,全量吸取后与180 μL LB 充分混匀。取100 μL 菌液涂布含甲氧苄啶和庆大霉素(B. pseudomallei菌株具有天然庆大霉素抗性)双抗板涂布培养进行筛选。对于接合成功的菌落进行第二轮筛选在含15% 蔗糖(不含NaCl)平板中进行,以促进载体的丢失。使用各自的验证引物,通过PCR 验证来确定缺失株的获得。PCR 扩增条件:98 ℃变性10 s、68 ℃退火5 s、72 ℃延伸10 s,30 个循环。
1.6 生长曲线测定
挑取新鲜LB 培养基中生长的HNBP001 及其ΔrelA缺失株单菌落,在LB 液体培养基中培养至对数期。菌液均用LB 液体培养基稀释至OD600=0.05,取稀释好的200 μL 菌液至96 孔板,每个样本3个复孔,在多功能酶标仪(Biotek)中37 ℃180 r/min轨道振荡培养48 h,连续动态每间隔2 h 自动测定1次OD600nm 的吸光度。
1.7 生物被膜测定
同生长曲线测定方法将菌液均一化至OD600=0.1。结晶紫染色法参考文献的方法[9]:取稀释好的200 μL 菌液至96 孔板,3 个复孔培养48 h 后小心去除上清液,然后96 孔板用200 μL 1×PBS 洗涤3 次,晾干后200 μL 1%结晶紫染色30 min;再用200 μL 1×PBS 洗涤2 次,晾干后用200 μL 30%乙酸孵育20 min,OD600测吸光度。玻璃试管观察法:分别取稀释好的2 mL 菌液于玻璃试管中,培养48 h 后观察。
1.8 泳动性测定
同生长曲线测定方法将菌液均一化至OD600=0.1,分别吸取2 μL 菌液至0.3%琼脂LB 培养基中正置培养,3 个重复,37 ℃培养24 h 后观察并测量细菌泳动圈的直径。
1.9 实验数据处理
使用GraphPad Prism 9.0 版本软件及配对t检验进行统计学分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 构建TPR-pK18mobSacB 载体质粒
为了提高HNBP001 菌株基因敲除效率,通过BglⅡ单酶切位点将甲氧苄啶抗性片段插入自杀性质粒pK18mobSacB,pK18mobSacB 质粒图谱如图1A 所示,改造后含TPR 抗性片段的TPRpK18mobSacB 质粒如图1B 所示。构建成功的TPR-pK18mobSacB 重组质粒使用BglⅡ限制性内切酶进行酶切验证,酶切条带大小结果正确,如图1C 所示,并进行测序,结果表明TPR-pK18mob-SacB 载体质粒构建成功。
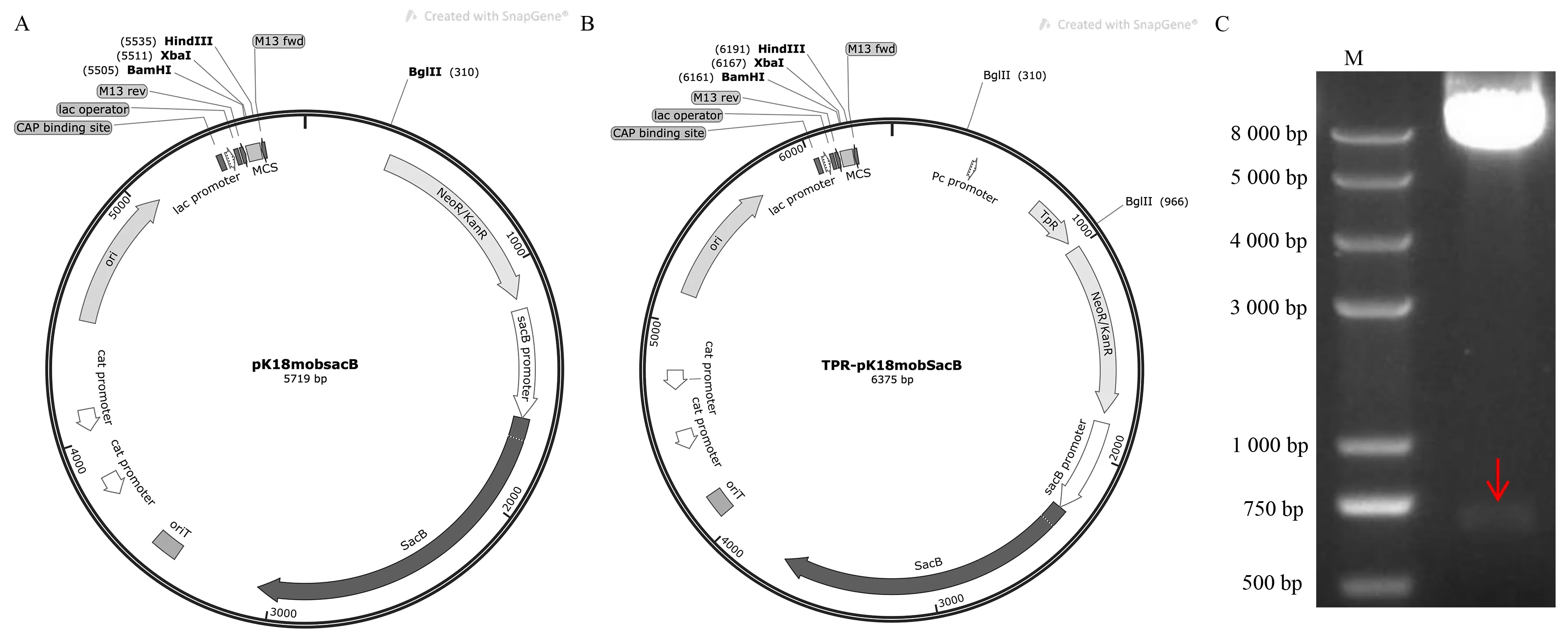
图1 质粒图谱及TPR-pK18mobSacB 酶切验证电泳图Fig 1 Plasmid profile and electrophoresis of TPR-pK18mobSacB digestion verification
2.2 构建ΔrelA 重组载体质粒
为了构建HNBP001 的ΔrelA缺失株,先PCR扩增relA基因上下游同源臂(L,R),再通过酶切酶连插入TPR-pK18mobSacB 载体质粒,使用TPR 抗性进行筛选,如图2A 所示。将构建成功的ΔrelA重组载体质粒BamH Ⅰ、Hind Ⅲ进行酶切验证,重组载体质粒酶切验证条带大小符合预期,结果表明重组载体质粒构建成功,如图2B 所示,红色箭头指示条带为连接的上下臂。
2.3 构建ΔrelA 缺失株
同源重组构建ΔrelA缺失株的方法如图2A 所示。将重组载体质粒转化S17-1 感受态细胞与HNBP001 进行接合,第一轮筛选用双抗甲氧苄啶和庆大霉素进行转化子筛选,第二轮筛选用15%蔗糖板进行筛选,获得丢失重组载体质粒的缺失菌株。缺失株用验证引物relA-VF/relA-VR 对其进行验证,通过正确的条带大小进行确定,如图2C 所示。
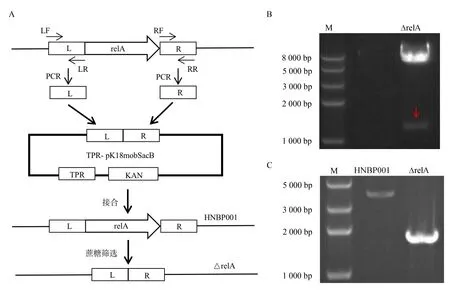
图2 同源重组模式图及relA 缺失株电泳图Fig 2 Homologous recombination pattern and electrophoresis results of mutant
2.4 敲除relA 对HNBP001 生长的影响
细菌生长代谢在适应外界环境胁迫中起着重要作用,当细菌遭遇不良环境(如抗生素、紫外线、温度等)时,细菌为了生存,会通过降低生长速度来适应逆境生存。为了探究relA是否对HNBP001 生长产生影响,通过比较HNBP001 野生株及其ΔrelA缺失菌株在营养丰富的LB 培养基中培养48 h 的生长情况,如图3A 所示。OD600nm 浊度测量显示,HNBP001 与ΔrelA缺失菌株在对数期8 h 左右前生长速度无明显区别,此后ΔrelA缺失菌株生长速度均低于HNBP001。结果表明,当ΔrelA缺失时,(p)ppGpp 合成水平降低,从而抑制细菌的生长。有研究发现(p)ppGpp 水平的升高和降低都能显著抑制大肠杆菌的生长,增加(p)ppGpp 水平会限制核糖体的合成,而降低(p)ppGpp 水平会限制代谢蛋白的表达[10]。
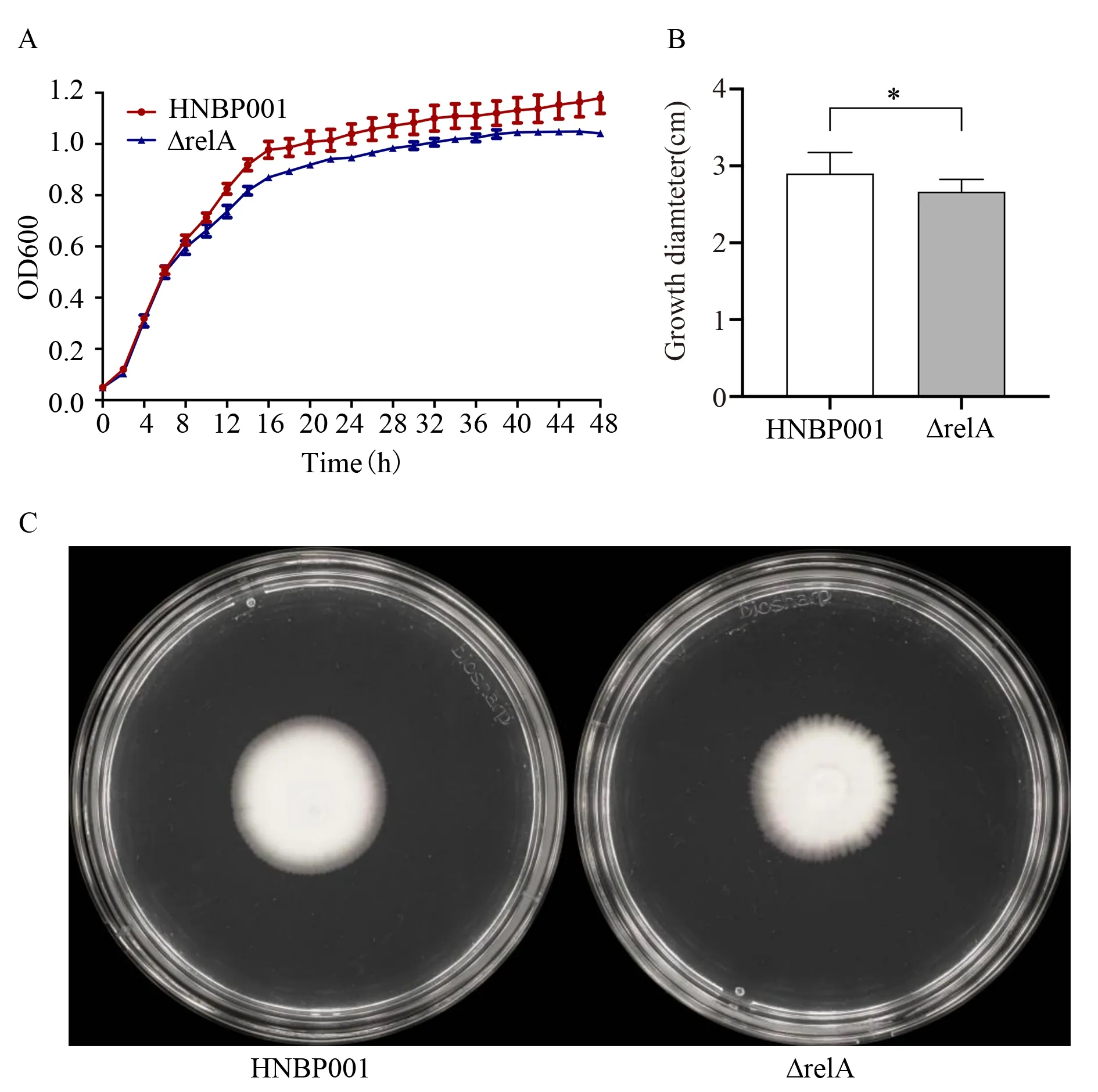
图3 生长曲线及泳动性Fig 3 Growth curve and motility
2.5 relA 对HNBP001 泳动性的影响
已有文献研究表明(p)ppGpp 会调控鞭毛的合成,细菌通过鞭毛实现其运动性[7]。通过比较野生株及其ΔrelA缺失菌株在0.3%软琼脂LB 半固体培养基中24 h 的泳动性,观察到ΔrelA缺失株泳动性低于HNBP001,如图3B 和C 所示。表明relA基因缺失可抑制HNBP001 泳动性。
2.6 relA 对HNBP001 生物被膜形成的影响
生物被膜与细菌的耐药密切相关,作为一个全局性的调控因子,已经有许多研究表明(p)ppGpp 可以参与调控细菌的生物膜形成[11]。如图4A 所示,在培养48 h 后,观察到ΔrelA缺失株气液界面生物被膜比HNBP001 薄且相对松散。结果表明在缺失relA基因后其生物被膜形成下降且变得更脆弱。结晶紫染色法观察到在气液界面出现一个明显的结晶紫染色环,如图4B 所示;定量测量结果如图4 C 所示,ΔrelA缺失株生物被膜低于HNBP001。表明relA基因缺失对HNBP001 的生物被膜形成具有抑制作用。

图4 生物被膜Fig 4 Biofilm
3 讨论
类鼻疽是一类严重潜在的致命性疾病,其复杂的临床表现和对许多抗生素的耐药性严重威胁人类生命健康,迄今为止还没有获得临床应用的疫苗[12,13]。本课题组通过对蔗糖致死质粒pK18mob-SacB 的改造,提高B. pseudomallei基因敲除的效率,两周左右即可获得所需的基因缺失菌株。整个基因敲除实验所需的试剂和仪器要求不高,可广泛应用于研究B. pseudomallei的实验室。本研究对严谨反应信号分子(p)ppGpp 合成相关基因relA进行敲除验证该方法,以及对其生物学表型进行测定。
严谨反应是一种应激信号系统,是原核生物应对不良生存环境的一种适应机制,使得细菌可以在营养饥饿和其他胁迫的条件下生存,包括抗生素的压力[14]。(p)ppGpp 信号可能是B. pseudomallei毒力基因表达和胁迫适应调控网络的一个重要组成部分,其缺失突变体可能是一种有希望的减毒活疫苗候选[15]。细菌在遭遇逆境时,为了生存会产生更耐受该环境的耐受菌,其可通过降低生长速度、运动以及增加生物膜的形成来应对外界的不利环境[16]。
在抗生素作用下,生长缓慢的耐受菌由于基础代谢活性的降低,可以避免抗生素的刺激和杀死作用[17]。发现ΔrelA缺失菌株对数中晚期和稳定期均低于野生株。这与缺失relA基因后(p)ppGpp 水平降低会限制代谢蛋白的表达有关[10]。(p)ppGpp 合成酶基因参与调节溶藻弧菌的运动[18]。结果显示,当ΔrelA缺失时泳动性降低,这可能与细菌鞭毛合成需要(p)ppGpp 参与有关[18]。生物被膜的形成是细菌在敌对环境或体内感染过程中生存的重要策略。生物被膜与细菌的耐药密切相关,作为一个全局性的调控因子,已经有许多研究表明(p)ppGpp 可以参与调控细菌的生物膜形成[11]。与HNBP001 相比,ΔrelA缺失菌株生物被膜形成量下降。
综上所述,本课题组改造的TPR-pK18mob-SacB 为B. pseudomallei基因功能的研究提供了有利的工具。在relA基因功能的表征中,发现敲除relA基因会抑制HNBP001 的生长、泳动和生物被膜的形成,为进一步研究relA基因的相关机制奠定了基础。
作者贡献度说明:
吴兴勇:课题的设计与实验,撰写论文;夏乾峰:课题设计及文章进行审校;李雪苗:论文的修订;刘成利、田申为本课题组老师,参与实验指导与评估;王彦双、厉安洋、朱侨为本课题组成员,参与了实验。
文章内容不涉及相关利益冲突。
