生物质热解过程中布朗气(HHO)对气相焦油解耦影响的数值研究
2022-08-19隋德洋邓乔声徐有宁
刘 鑫,马 瑞,2,隋德洋,邓乔声,徐有宁
(1.沈阳工程学院a.能源与动力学院;b.工程技术研究院,辽宁 沈阳 110136;2.山东理工大学 农业工程与食品科学学院,山东 淄博 255000)
目前,脱除焦油的方法主要包括物理法、高温裂解法和催化裂解法:物理法除焦油不能将焦油真正地除去,而是将焦油从气相转到冷凝相,产物难以重复利用,浪费了焦油的能量;高温裂解法可以有效地降解焦油,但对温度要求高,容易形成炭黑,且由于生物质的热值低,实验所需能耗很大;催化裂解法是运用比较多的方法,催化剂可以为焦油转化提供活化能,使其低于正常的裂解温度(700 ℃~900 ℃),由于催化裂解过程的温度过高,催化剂表面容易形成积碳,导致催化剂失活。
普遍采用的催化裂解方法是水蒸气催化重整方法,该方法可以提高生物质气化产气效率,同时为生物质裂解提供所需的氢能。产气中H2的含量较高,通入水蒸气的量也直接影响可燃气的组成。在催化剂和水蒸气的共同作用下,焦油主要发生热裂解反应、水蒸气重整反应和二氧化碳重整反应,如表1所示。

表1 催化焦油解耦反应过程
国内外学者通过水蒸气重整的方法既可以有效地脱出焦油,还可以使焦油转化为可燃气:文献[1]以NiO-MoO3/γ-Al2O3作为负载型催化剂,将其应用于焦油模型蒸汽重整和生物质水蒸汽气化焦油重整的过程中,有效地脱除了焦油并提高了焦油燃气转化率;文献[2]研究了多种镍基金属氧化物催化剂对苯的水蒸汽重整,发现其中15%的Ni/CeO2(75%)-ZrO2(25%)具有最高的催化特性,可促使苯的催化转化率达到87%。由此可见,加入水蒸气可以为生物质气化过程提供所需的氢离子和氧离子,降低了焦油脱除的温度,提高了燃气转化率。
布朗气是一种电解水时产生的可燃性混合气体,其主要成分包括氢气、氧气(氢气和氧气的比例为2:1)、水分子和少量自由基粒子(羟基—OH-、氧离子—O2-、氢离子—H+)。布朗气技术原用于金属的焊(熔焊)割(熔割)、首饰加工、加工亚克力等过程,具有清洁无污染和火焰集中功效高的特点。中国兵器科学研究院作为国内最早开展布朗气应用开发的研究机构,深入分析了布朗气的催化燃烧作用,结合布朗气燃烧、布朗气复合燃料燃烧、布朗气固体废物催化燃烧3 种技术,在医疗垃圾焚烧应用领域中取得了一定的成果。因此,从理论上来说,布朗气可以有效提供焦油裂解所需的H+、OH-、水分子和一定的热值,解决目前生物质低气化效率问题,提高生物质热解气的品质。
综上所述,本文选取生物质气化过程中不同温度下部分典型气相焦油化合物作为研究对象,对比每种气相焦油化合物在有/无布朗气施加条件下的含量及成分变化,通过数值模拟分析不同热解温度下布朗气对生物质热解气相焦油裂解及气相产物中可燃气成分的影响。
1 数学模型及反应机理
1.1 物理模型
本文选用的物理模型源于布朗气-生物质热解气化管式炉实验,如图1 所示。在数值模拟过程中,计算区域为管式炉的核心热解区,设置的温度求解参数与温控仪调节管式炉的升温速率和热解温度的特点相符合,选取的连续理想混合流动反应器符合实验中节流阀调节掺混气体(布朗气和氮气)与生物质原料充分接触的效果。
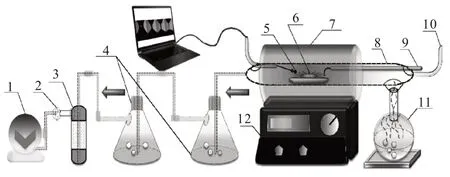
图1 卧式管式炉
1.2 数学模型
所选模型为Chemkin 模拟软件平台中的模拟稳态或瞬态的充分混合反应器模型。PSR 是连续理想混合流动反应器,可以保证气体以稳定的流量进入反应器,并在整个反应器内瞬间分散均匀,与反应器中的气相生物质焦油完全混合,不受混合过程影响。反应物转化为生成物的速率由化学反应速率控制,在减小计算强度的同时,容器内的热解过程能够用详细的化学反应机理描述。
1.2.1 假设条件
1)在瞬态条件下,温度分布均匀,反应气氛及生成的可燃气组分均匀一致,不随空间和时间变化;
2)气相中各个组分在反应容器中存在停留时间;
3)通入的布朗气与气相焦油化合物完全均匀混合,其组分的各热力学参数不随时间变化。
1.2.2 基本方程
质量和能量控制方程如下:
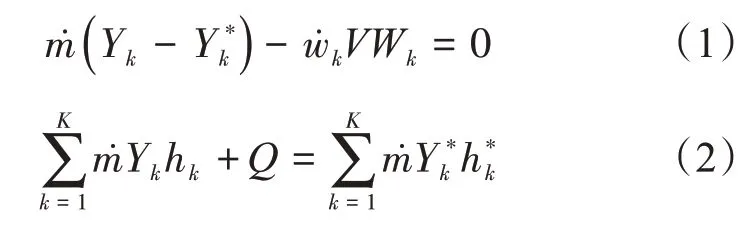
滞留时间τ:

式中,ρ为质量密度,ρ=;P为压力;R为通用气体常数;T为温度;为混合物的平均摩尔质量。
1.3 焦油化合物的选取
根据气化炉内不同温度条件下的产物将焦油分为4 类:初级焦油(Primary)、二级焦油(Second‐ary)、烷基三级焦油(Alkyltertiary)和缩合三级焦油(Condensedtertiary),如表2 所示。当温度达到500 ℃时,初级焦油开始裂解,转化为二级焦油;随着温度的升高,三级焦油浓度慢慢升高,一级焦油基本消失。
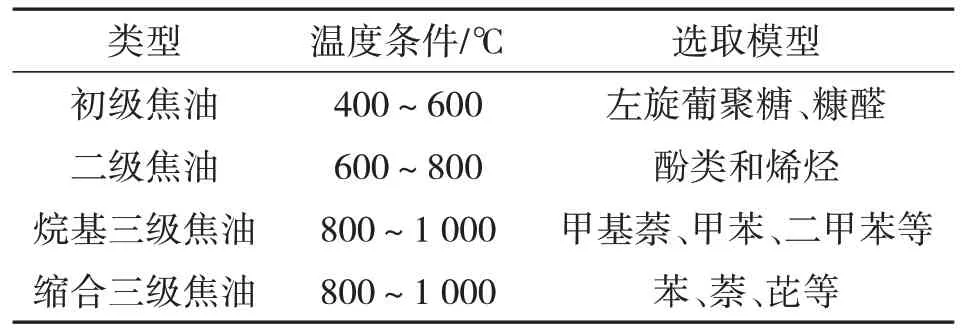
表2 焦油成分分类
1.4 布朗气(HHO)初始成分的设定
生物质焦油的组分十分复杂,可达到上百种,主要包括酚、醇、醚、多环芳烃和含氧化合物等。其中,含量大于5%的主要有苯、甲苯、二甲苯、苯乙烯和酚等。甲苯的含量可达焦油组分的20%,而且是焦油组分中最难处理的稳定单环芳烃;苯作为芳香烃中最简单的一类物质,可以代表焦油各组分的共性。为了使模拟结果与实际情况接近,减少误差,本文选取苯、甲苯、苯酚、二甲苯和甲基萘作为气相焦油化合物模型,并进行模拟研究。
布朗气(HHO)是电解水时产生的混合型气体,除了摩尔当量为2:1的氢气(H2)和氧气(O2)外,还带有部分水分子及少量自由基形式的粒子,其中H2约占60.79%,O2约占30.39%。
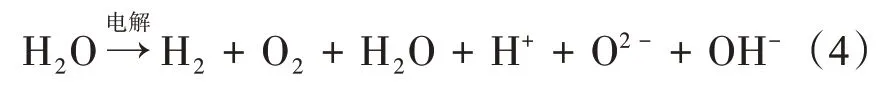
根据克拉伯龙方程式(式5),在标准状况下电解1 ml 水产出的布朗气中,水分子及少量自由基形式存在的粒子约占总气体摩尔分数的10%。因此,数值模拟初始成分设定为2:1:1(H2:O2:其他自由基离子及水分子)。

式中,P表示压强;V表示气体体积;n表示物质的量,n=或n=;T表示绝对温度;R 表示气体常数,所有气体R值均相同;Vm为摩尔体积,Vm=22.4 L/mol;M为摩尔质量。
1.5 主要基元反应
建立关于苯酚(C6H5OH)、甲苯(C7H8)、苯(C6H6)、甲基萘(C10H7CH3)和二甲苯(C8H10)的化学反应动力学模型,在实际反应系统中要考虑的基元反应包括2 个部分:一部分为自由基离子与气相生物质焦油的基元反应;另一部分为气相生物质焦油化合物之间相互转化过程中的基元反应及其过渡反应。各基元反应方程式及相应的动力学参数如表3、表4、表5、表6和表7所示。
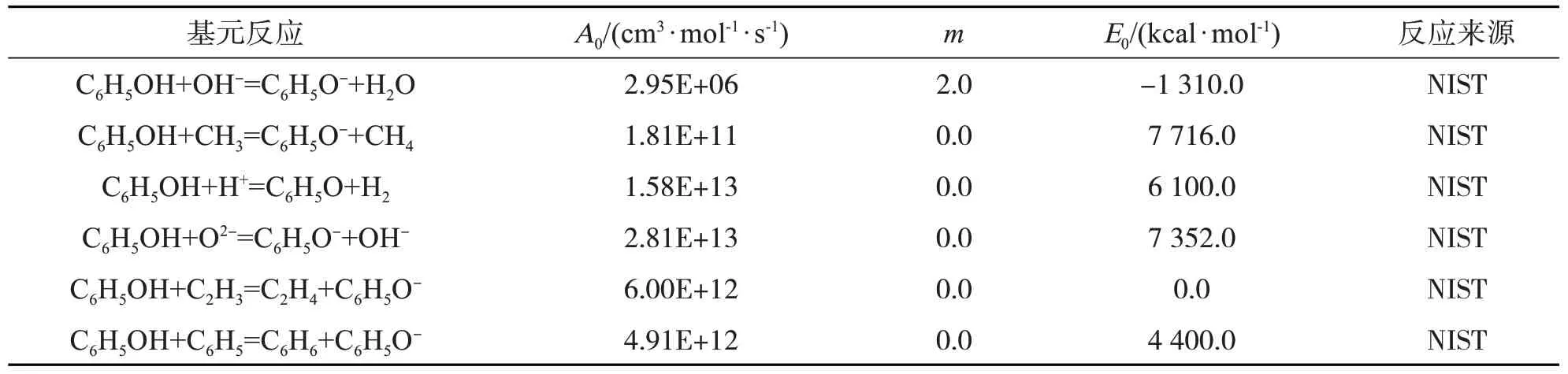
表3 涉及苯酚(C6H5OH)的基元反应方程式及相应的动力学参数
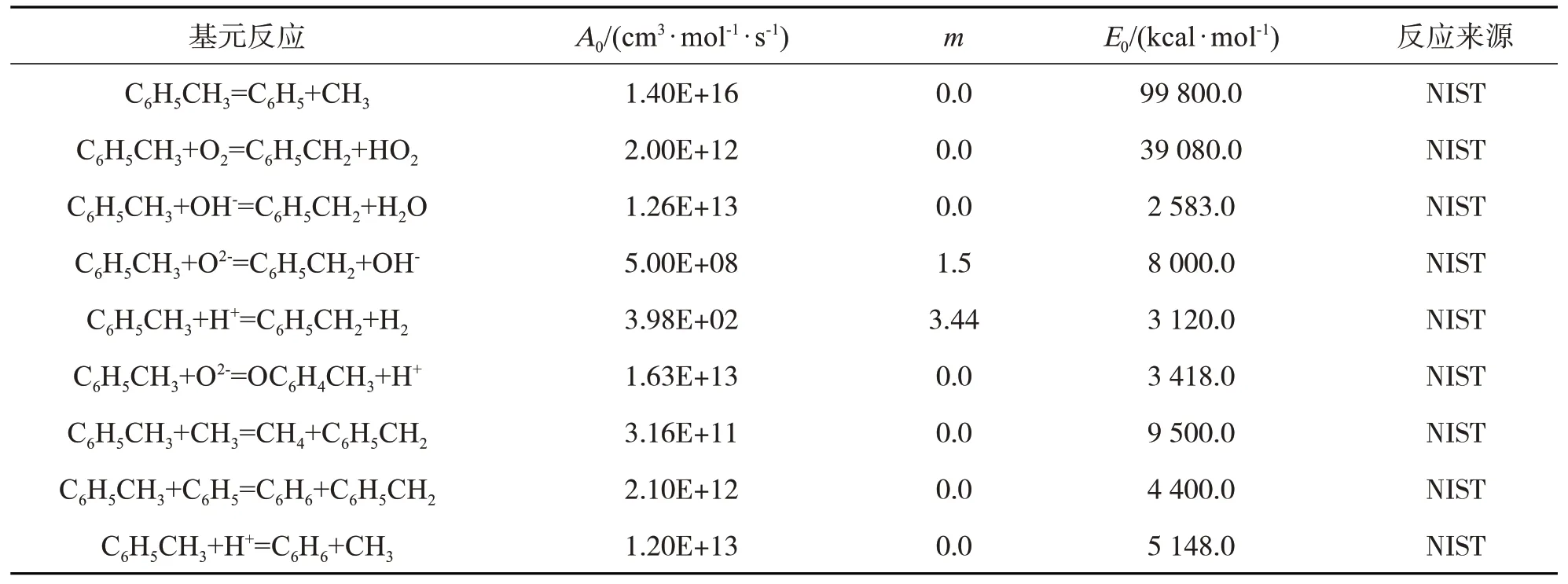
表4 涉及甲苯(C7H8)的基元反应方程式及相应的动力学参数
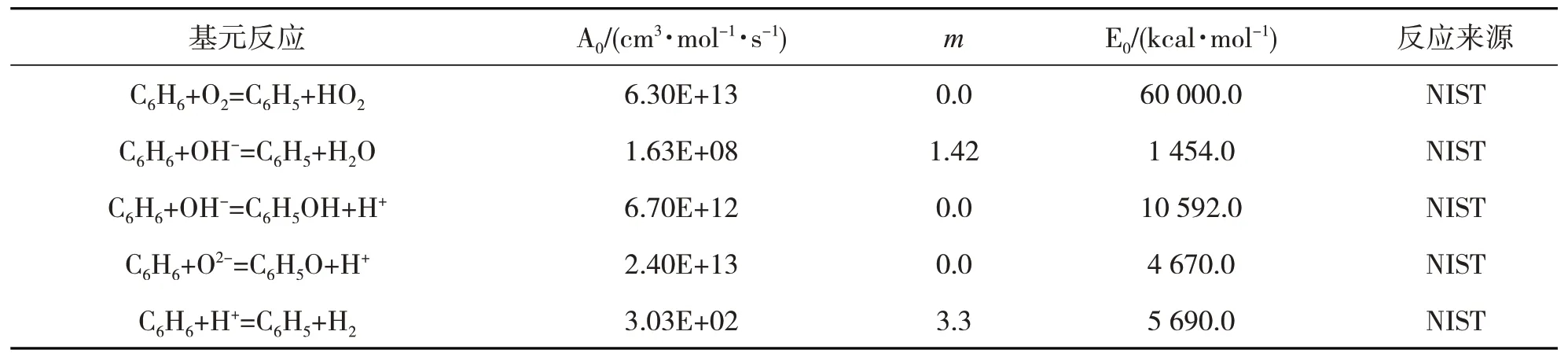
表5 涉及苯(C6H6)的基元反应方程式及相应的动力学参数

表6 涉及甲基萘(C10H7CH3)的基元反应方程式及相应的动力学参数

表7 涉及二甲苯(CH3C6H4CH3)的基元反应方程式及相应的动力学参数
2 结论与分析
该数值模拟系统反映了布朗气参与生物质热解气化过程中气相焦油化合物的整个解耦过程,对比研究有/无布朗气施加条件下,各温度区间内的生物质气相焦油化合物裂解程度和可燃气产出率。假设在系统内混合瞬间反应体系中的各相均匀同性,体系封闭、绝热、定压,容器体积对反应体系影响不大。布朗气-生物质气相焦油化合物反应的温度范围设置为873.15 K~1 273.15 K,温升速率为63.65 K/s,布朗气的初始参数及归一化处理结果如表8 所示,停留时间为0.1 s,入口温度为298 K,压强为1 atm,环境气氛为N2,反应时间为10 s。
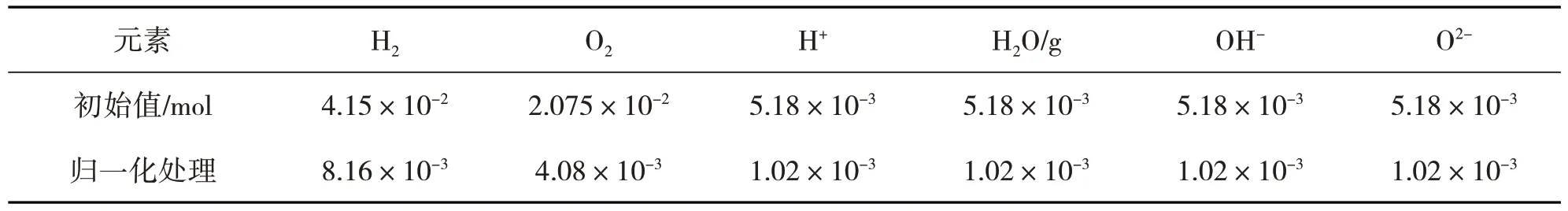
表8 布朗气的初始参数及归一化处理
2.1 气相焦油化合物成分的变化规律
通入布朗气后,焦油各组分在939.6 K 开始出现缓慢的降解趋势,热裂解温度同比下降2.06%,苯酚、甲苯、苯、甲基萘和二甲苯在1 100 K 降解趋势明显加快,加速裂解的温度同比下降3.76%,如图2所示。
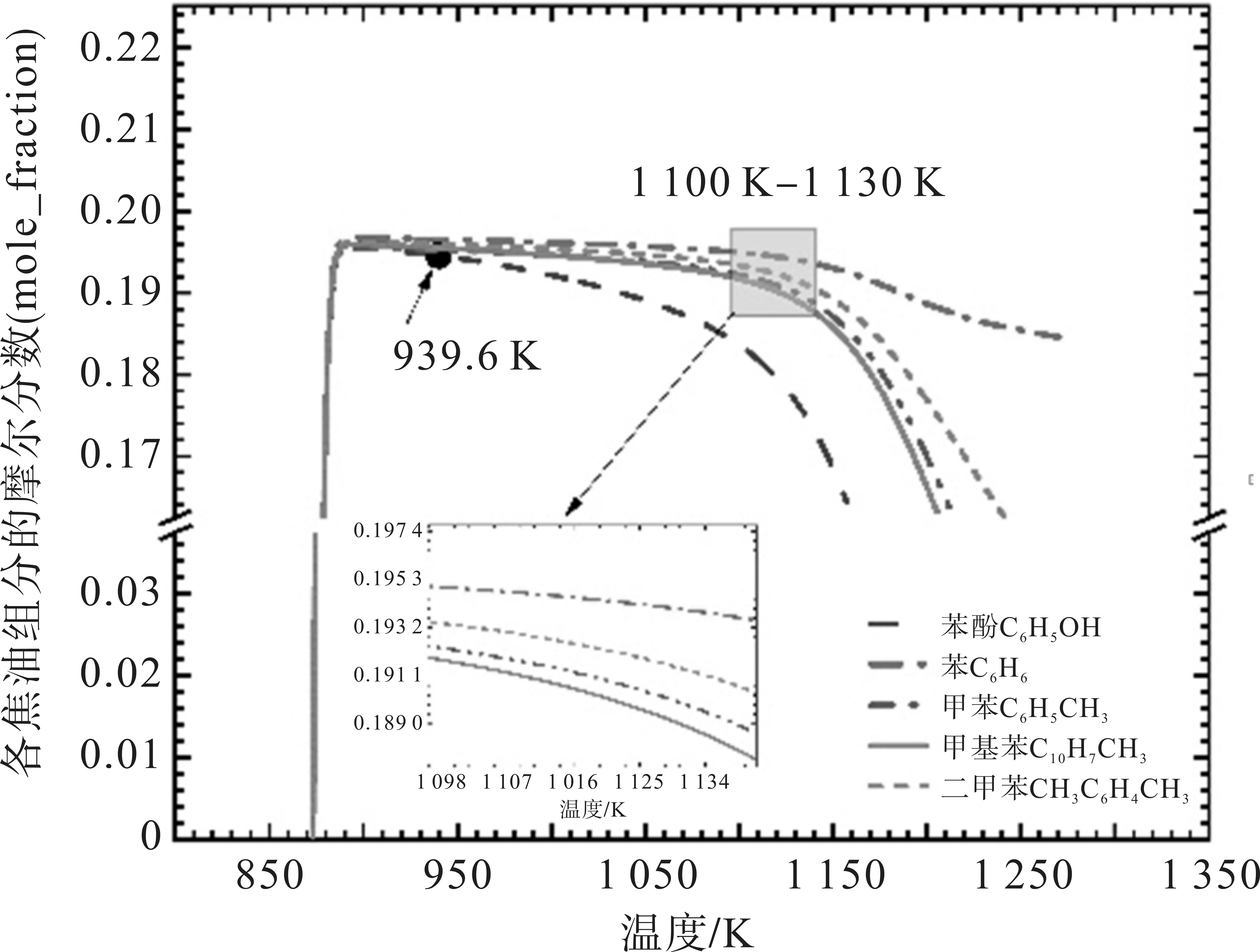
图2 通入布朗气(HHO)焦油的变化曲线
而在未通入布朗气的瞬态反应中,苯酚在1 020.2 K 时开始有明显的降解趋势,苯、甲苯、甲基萘和二甲苯在1 093.6 K 时有明显的降解趋势,如图3 所示。
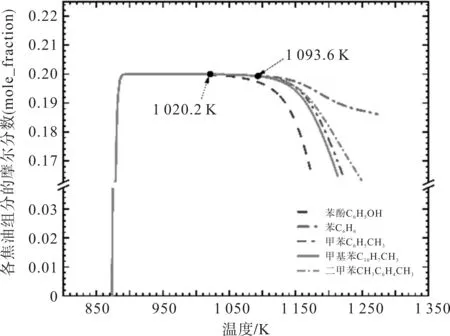
图3 未通布朗气(HHO)焦油的变化曲线
反应结束后,焦油各组分的量如图4 所示,通入布朗气后,各气相焦油化合物的摩尔分数也有所降低,同比下降1.8%、3.5%、0.9%、3.3%、2.04%。
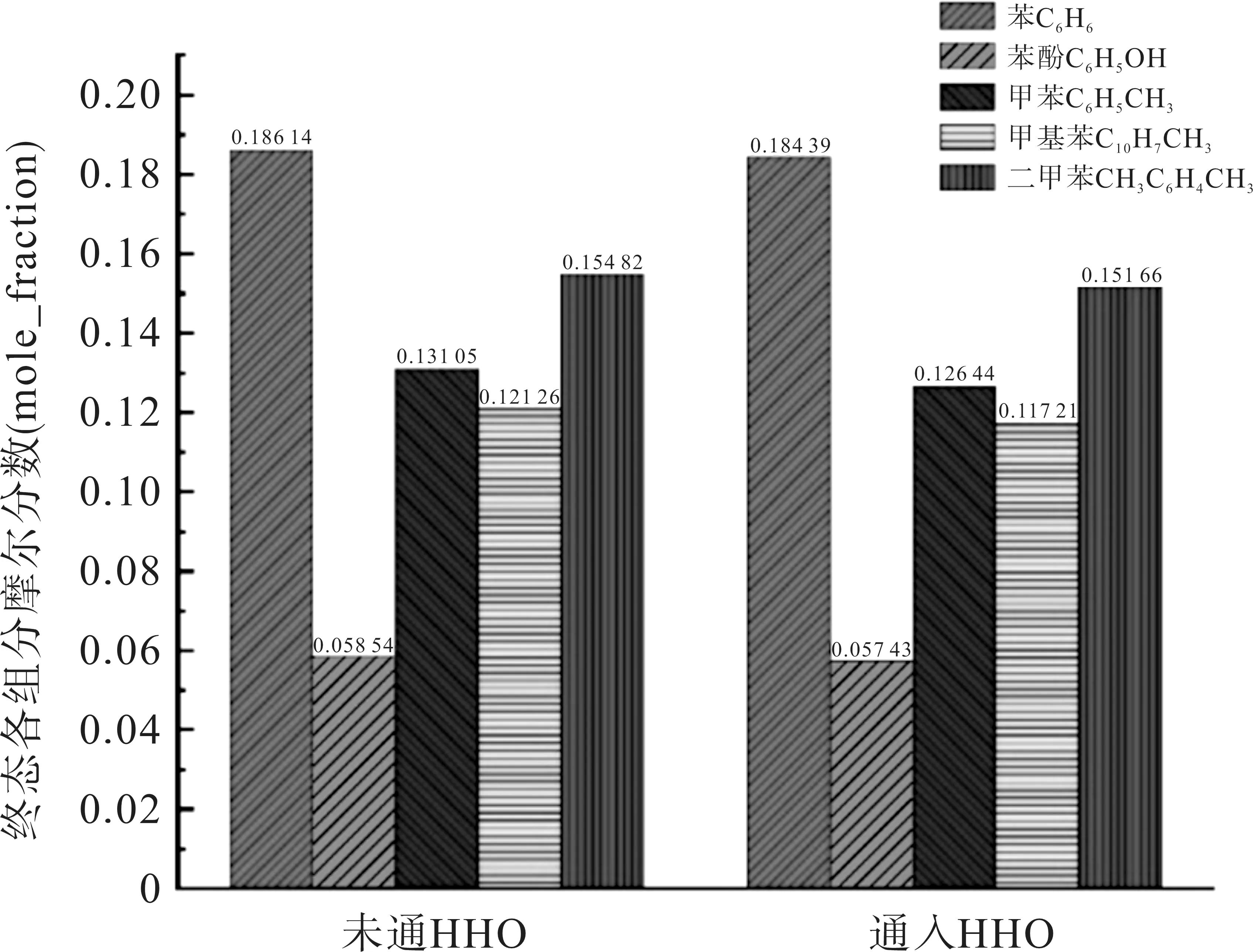
图4 终态各组分摩尔分数
2.2 可燃气的变化规律
图5和图6分别表示在有/无布朗气(HHO)条件下反应系统中可燃气体含量的变化情况。通过对比可知,H2和CO在反应开始时出现上升趋势,当温度达到1 124.6 K时上升趋势加快;CH4在反应开始时略微析出,当温度为1 100.5 K时上升趋势加快。
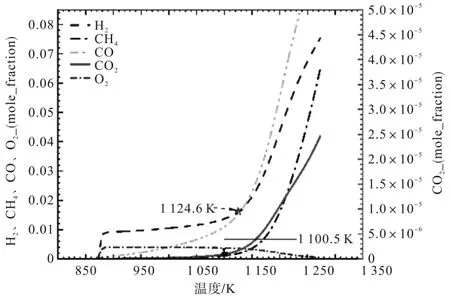
图5 通入布朗气(HHO)条件下反应系统中可燃气气体含量变化情况
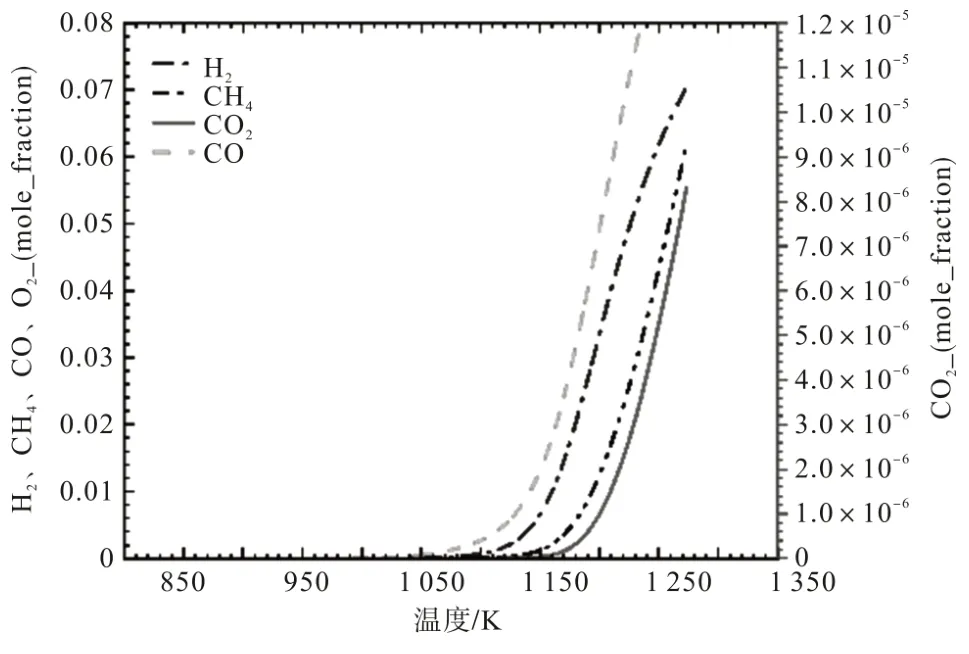
图6 未通布朗气(HHO)条件下反应系统中可燃气气体含量变化情况
图7为终态可燃气摩尔分数分布情况。
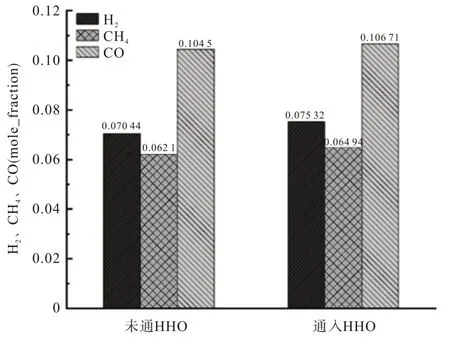
图7 终态可燃气摩尔分数
由图7 可知,通入布朗气之后生成的可燃气含量较高,产生的可燃气(H2、CO 和CH4)含量同比增长6.9%、2.1%和4.1%。
3 结论
综上所述,在未通入布朗气(HHO)时,随着燃烧温度的升高,各气相焦油化合物的裂解速度也随之加快,但是裂解温度比较高;通入布朗气(HHO)后,布朗气中的自由基离子开始与焦油反应,随着温度升高,布朗气中的氢气和氧气发生燃烧反应,放出热量,为气相焦油化合物裂解提供了额外所需的能量,加快了可燃气的析出,降低了各气相焦油的裂解温度。反应结束后,通入布朗气(HHO)可以使气相焦油裂解更完全,产生的可燃气含量更多。因此,在气相焦油化合物裂解时通入布朗气(HHO),可得如下结论:
1)可以使焦油裂解更完全,降低气相焦油的裂解温度;
2)可以提高生成可燃气的含量;
3)对气相焦油中的甲苯裂解效果更明显,裂解产生可燃气组分中H2的同比增长率也相对较高。
