基于16S rRNA测序技术对阿尔茨海默病大鼠肠道菌群的分析
2022-08-17张慧楠孙雅涵张欣怡李明祎杨立洁程义超张慧明
张慧楠,孙雅涵,张欣怡,李明祎,杨立洁,程义超,张慧明
(佳木斯大学 a.临床医学院;b.康复护理学院;c.基础医学院,黑龙江 佳木斯 154007)
阿尔茨海默病是一种具有潜在发病的进行性神经退行性疾病[1]。其临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆表现为特征[2],最重要的临床表现是认知功能的恶化和行为的变化。但该病一经发现就是重度症状,目前在临床上无比较有效的检测方法能够检测轻型阿尔茨海默病,如何能够早期预判及及时治疗成为预防医学领域的一个热点领域和难以解决的问题。近年来,肠道菌群研究不断有所突破,肠道菌群失调与中枢神经系统性疾病的发生存在相关性[3],两者存在双向交流。越来越多科学家证实,包括认知行为在内的大脑功能和行为可被肠道菌群通过微生物-肠-脑轴的方式进行调节。肠道菌群多样性调节的方式已经成为阿尔茨海默病治疗的新靶点。本研究通过建立阿尔茨海默病动物模型,采用16S rRNA测序的方法进行阿尔茨海默病大鼠模型肠道菌群分析,旨在寻找不同程度大鼠模型肠道菌群差异性,为临床上预防阿尔茨海默病发病提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1实验动物 16~18周龄雄性SD大鼠[(650±50)g]30只饲养于佳木斯大学实验中心,所有实验都得到了生物安全中心及佳木斯大学医学伦理委员会的批准。大鼠在标准化条件下保持在(22±2)℃,相对湿度为(54±5)%,昼夜交替12 h的环境中。大鼠在实验前先用1周时间适应环境,自由进食水,手术前禁食10 h。
1.1.2实验试剂 体积分数75%医用酒精(武汉市活力消毒用品有限公司)、Aβ1-40[吉尔生化(上海)有限公司]、体积分数为0.1%三氟乙酸(上海阿拉丁生化科技股份有限公司)。
1.1.3实验器材 小动物剃毛器(宁波爱克利浦电器有限公司)、小动物称量称(中国凯丰集团有限公司)、带线缝合针(上海金环)、一次性无菌注射器(上海康德莱企业发展集团股份有限公司)、颅骨钻(STR204)、脑立体定位仪(安徽正华生物仪器设备有限公司)、血压计(安徽正华生物仪器设备有限公司)、血糖试纸及血糖仪(鱼跃)。
1.2 研究方法
1.2.1实验动物造模 使用体积分数为0.1%三氟乙酸将Aβ1-40稀释成10 mg·L-1,37 ℃孵育5~7 d,使其变为寡聚体。SD大鼠麻醉后继而固定于脑立体定位仪上。用医用酒精擦拭大鼠颅部皮肤进行消毒,按照大鼠脑立体定位图谱,打开颅腔,将其中24只大鼠双侧海马CA1区缓慢匀速注射Aβ1-40寡聚体各10 μg (10 μL),留针5 min,退针后缝合切口,缓慢退针[4]。另外6只按上述操作打开颅腔,但不进行任何注射。待操作完成后,将大鼠置于鼠笼内,注意使其侧卧和保暖,并且时刻监测呼吸情况。苏醒后送回实验动物养殖中心,继续饲养。术后饲养至28 d,其间每周1次检测大鼠的体质量、血压、血糖的变化。其中发现注射过Aβ1-40的24只大鼠有12只血糖血压不稳定,将其淘汰,保留其余的12只SD大鼠。
1.2.2动物分组 大鼠手术28 d后,进行水迷宫实验。Morris水迷宫平台储存于水面以上1~2 cm处,水温控制在(22±2)℃。主要检测大鼠的被动空间学习记忆能力,包括定位航行试验和空间探针试验。测试持续6 d,测定大鼠认知功能,对大鼠进行分组。
1.2.3样本测序 提取对照组、轻症模型组和重症模型组大鼠的粪便样本,将粪便样本送至APE×BIO公司进行二代测序检测,并进行物种组成分析、物种差异与标志物种分析、Alpha多样性分析、Beta多样性分析和关联网络分析。
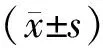
2 结果
2.1 水迷宫实验结果对照组大鼠第6天的结果显示穿越平台次数最多,其次是轻症模型组大鼠,重症模型组大鼠最少。轻症模型组大鼠和重症模型组大鼠的潜伏期均长于对照组,且重症模型组大鼠的潜伏期最长。轻症模型组和重症模型组大鼠在目标象限停留的时间短于对照组。结果说明造模成功。根据水迷宫实验判定小鼠的意识障碍程度,将动物分成对照组、轻度模型组、重症模型组,每组6只,穿越平台次数差异有统计学意义(P<0.05)。见图1。
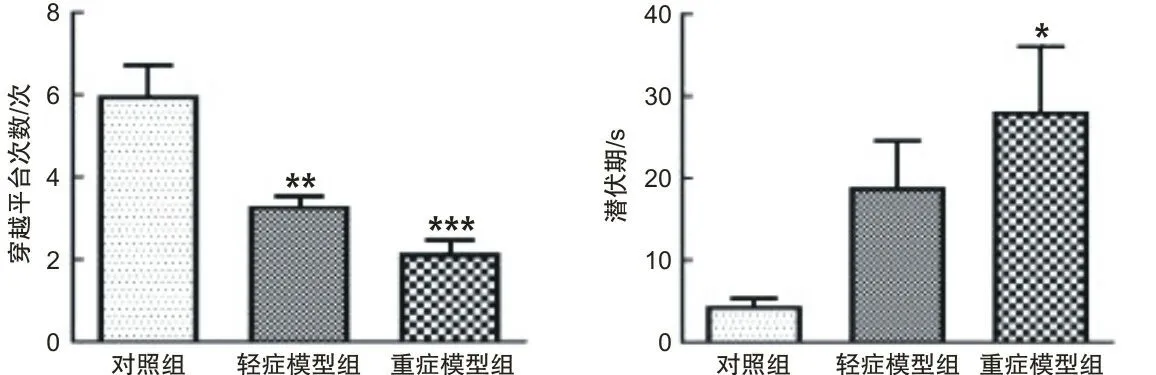
注:*P<0.05;**P<0.01;***P<0.001。
2.2 肠道菌群高通量测序结果对18个样本(对照组、轻症模型组、重症模型组)采用Illumina Miseq高通量测序仪获得高质量序列共835 807条,平均每个样本464 434条。所有样品物种积累曲线(图2)支持了取样工作的充分性。各组比较,轻症模型组的高质量序列数(46 156±4 803)低于对照组(51 451±3 226)(P=0.048 8);重症模型组的高质量序列数(41 694±1 892)低于对照组(51 451±3 226)(P=0.000 6);重症模型组的高质量序列数(41 694±1 892)低于轻症,模型组(46 156±4 803)(P=0.103 8)。各等级菌种统计显示,18个样本在不同分类水平下(门、纲、目、科、属、种)微生物单元数目的分布情况见表1。在各分类水平上,轻症模型组的微生物单元数少于对照组,重症模型组的微生物单元数少于轻症模型组。这表明阿尔茨海默病导致肠道菌群丰富度降低,且重度阿尔茨海默病要比轻度阿尔茨海默病菌群丰富度下降更快。
2.3 不同阿尔茨海默病严重程度小鼠肠道菌群Alpha分析Alpha多样性包括Chao指数、ace指数、Shannon指数以及Simpson指数、PD_whole_tree指数等[5]。其中,Chao指数和ace指数反映样品中群落的丰富度。Chao指数值是对样本中菌群物种总数的评估,其数值越大,表明样本物种丰富度越高[6]。如图3箱线图所示,对照组大鼠的Chao指数、observed species、Shannon均大于重症模型组和轻症模型组,但Simpson小于重症模型组、大于轻症模型组,重症模型组又大于轻症模型组,结果表明,与对照组相比,重症模型组大鼠和轻症模型组大鼠的菌群丰富度均降低,且重症模型组与轻症模型组菌群丰富度相似,重症模型组略高于轻症模型组。Simpson越大,多样性越低,模型组菌群丰富度发生改变。

表1 18个样本在6个水平微生物单元数统计表
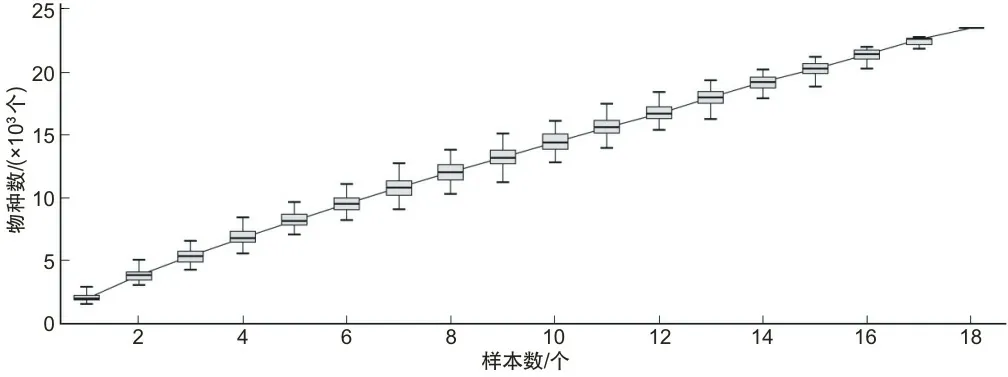
图2 物种积累曲线

注:A组为对照组;B组为轻症模型组;C组为重症模型组。
2.4 不同阿尔茨海默病严重程度小鼠肠道菌群Beta分析Beta多样性通过分析坐标轴中样本和样本之间的距离直观地观察3组样本之间的菌群差异性。若3组样本之间的直线距离较近,则表示这3组样本的菌群差异性较小;相反,若3组样本之间的直线距离较远,则表示3组菌群差异性较大。如图4A所示,在相同组中个体之间的直线距离较短,菌群差异性小,在不同组之间,直线距离较大,菌群差异性较大,在阿尔茨海默病的干预下,3组大鼠分别本能显著地聚集分布,其距离相距较远,PCOA1的横坐标影响因素占总成分的16%,PCOA2的纵坐标影响因素占总成分的13.5%。NMDS模型能更准确地反映出距离矩阵的数值排序信息,图4B中的stress值为0.156,具有一定的解释意义,且3组大鼠在二维空间分布上存在着较大的差异,表明其肠道菌群的Beta多样性发生了变化,结合PCOA和NMDS图像分析,阿尔茨海默病模型建立对肠道菌群Beta多样性造成了一定的影响。

A为距离矩阵与PCOA分析图;B为NMDS结果分析图。
2.5 不同阿尔茨海默病严重程度小鼠肠道菌群的组成将对照组小鼠编号为A1~A6,轻症小鼠编号为B1~B6,重症小鼠编号为C1~C6,肠道内微生物种类分类如下,图5所示,在总体水平上A1~A6的门水平和属水平存在较大差异,现就3组大鼠肠道菌群测序门和属水平进行分析。
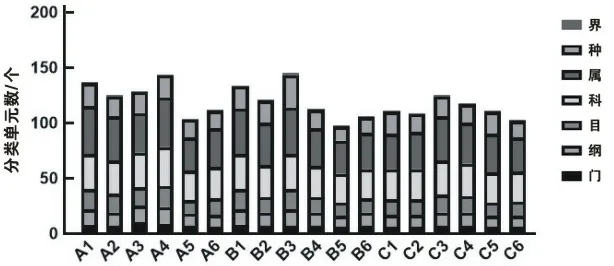
图5 肠道内物种分类学注释结果
在门水平,3个组(对照组、轻症模型组、重症模型组)的优势菌相似,为硬壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)。按照3个组的顺序,优势菌所占比率依次为:Firmicutes66.05%、53.33%、48.63%;Bacteroidetes28.07%、45.70%、49.45%。其中,Firmicutes的比率在轻症模型组和重症模型组均低于对照组,差异有统计学意义(P=0.009 5);Bacteroidetes的比率在轻症模型组和重症模型组均高于对照组,差异有统计学意义(P=0.024 7、0.003 7)。此外,由各组大鼠在门水平肠道菌群组成成分中发现,在对照组中原有的螺旋体门(Spirochetes)在轻症模型组和重症模型组中含量大幅度降低,模型组中Firmicutes、Spirochetes丰度降低而Bacteroidetes丰度上升,阿尔茨海默病可能导致肠道菌群丰度发生变化,特别可能针对优势菌群丰度的变化。在属水平,对照组和轻症模型组排前4位的菌相同,这4个菌种在这3组中(按照对照组、轻症模型组、重症模型组的顺序)占比依次为:普氏菌属(Prevotella)6.11%、15.10%、16.37%;乳酸杆菌属(Lactobacillus)7.64%、15.75%、3.66%;颤螺菌属(Oscillospira)7.74%、4.97%、3.36%;异杆菌属(Allobaculum)3.26%、0.53%、6.03%。模型组的Prevotella多于对照组,轻症模型组的Lactobacillus多于对照组和重症模型组,对照组的Oscillospira多于模型组,模型组的帕拉普氏菌属(Paraprevotella)多于对照组,差异有统计学意义(P<0.05)。结合以上各分类水平和各组间数据分析,组间差异明显的菌群主要为Prevotella和Lactobacillus。相比于对照组,轻症模型组的Prevotella和Lactobacillus均增加,重症模型组的Prevotella增加,Lactobacillus减少。轻症模型组和重症模型组之间,差异明显的菌群为乳酸菌,重症模型组的乳酸菌少于轻症模型组,值得关注的是,重症模型组大鼠其他菌群多于对照组和轻症模型组。
2.6 不同阿尔茨海默病严重程度小鼠肠道菌群网络分析网络分析是通过计算特征值间的相关系数,寻找变量之间的联系,以网络图或者连接模来展示数据,并将显著相关的特征节点用不同粗细的线相连来表示不同变量(物种或基因等)间的相互作用关系,从而简化复杂系统并提取有用信息的一种定量分析方式。本图为大鼠关联图,选取了大鼠中联系最为紧密的几个模型,反映了其之间的关系,模型1、4、5为正常组大鼠,通过观察可发现1、4、5内部相似度较高,但与7、8、9、10、14之间的相似度较低,甚至为负值,而7、8、9、10、14这5组数据之间的相似度较高,均为阿尔茨海默病大鼠,表明阿尔茨海默病大鼠与正常组之间存在一定的差异性。

A为门水平物种组成分析图;B为属水平物种组成分析图。
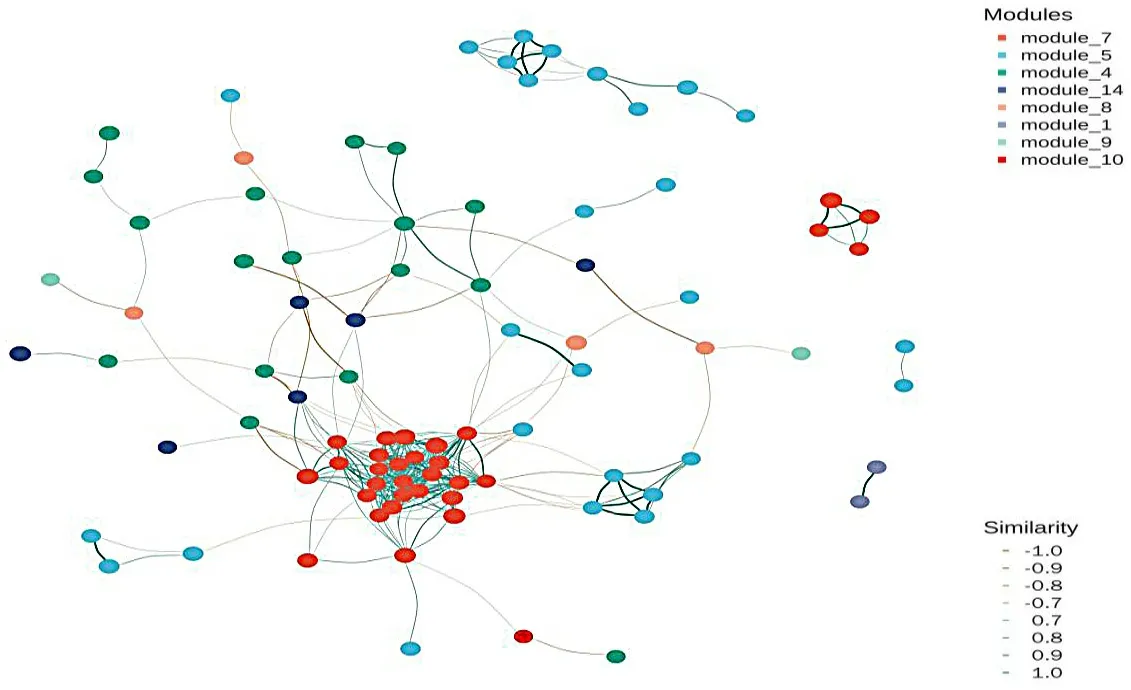
图7 网络分析图
3 讨论
阿尔茨海默病作为当代中老年人常见疾病,在社会上已经引起了广泛重视。近年来,肠道菌群研究不断有所突破,肠道菌群失调与中枢神经系统疾病的发生存在相关性,两者存在双向交流。现有大量实验不断证实了肠道菌群与中枢神经系统疾病的关系,认为肠道菌群失调与退行性疾病、免疫性疾病甚至精神性疾病的产生有着密切的联系[7-8]。肠道微生物通过代谢作用产生了大量的脂多糖、多种分泌物和淀粉样蛋白,而且在机体正常水平下,也会使脂多糖和淀粉样蛋白质暴露[9]。这可能对机体平衡有害,特别是当人老龄化时,消化道黏膜和血脑屏障的成分改变,通透性增加,这些物质则更易到达中枢神经系统,引起阿尔茨海默病、帕金森病等疾病[10-11]。
本实验通过用Aβ1-40对大鼠脑部进行干预对实验动物进行造模,并术后进行血压、血糖、体质量的检测,依赖水迷宫定位航行试验和空间探索实验对大鼠进行分组,分为对照组、轻症模型组、重症模型组。通过16S rRNA测序分析3组大鼠肠道菌群之间的差异性。各等级菌种数目统计显示,在各分类水平上,轻症模型组的菌种数目少于对照组,重症模型组的菌种数目少于轻症模型组。这表明阿尔茨海默病导致肠道菌群丰富度降低,且重度阿尔茨海默病要比轻度阿尔茨海默病菌群丰富度下降更快。轻症模型组的高质量序列数低于对照组;重症模型组的高质量序列数低于对照组;重症模型组的高质量序列数低于轻症模型组。在门水平上,3组大鼠优势菌相似,为Firmicutes、Bacteroidetes,Firmicutes66.05%、53.33%、48.63%,Bacteroidetes28.07%、45.70%、49.45%。在属水平上,对照组和轻症模型组排前4位的菌相同,为Prevotella、Lactobacillus、Oscillospira、Allobaculum。对照组、重症模型组与轻症模型组丰富度仍然存在一定差异,分别为Prevotella6.11%、15.10%、16.37%,Lactobacillus7.64%、15.75%、3.66%,Oscillospira7.74%、4.97%、3.36%,Allobaculum3.26%、0.53%、6.03%。
Vogt等[12]研究表明,与健康人相比,阿尔茨海默病患者的微生物多样性降低,Firmicutes的数量减少而Bacteroidetes表达上升,这个结论在本实验中得以证实。细菌或病毒感染可能是造成阿尔茨海默病的原因之一。幽门螺杆菌感染直接或间接参与阿尔茨海默病的发生和发展[13],幽门螺杆菌属变形菌门,在本实验中也发现对照组与模型组的变形菌数目存在差异。其他病毒如巨细胞病毒和水痘带状疱疹病毒、单纯疱疹病毒1型也与阿尔茨海默病有关[14],且单纯疱疹病毒1型已被证明是阿尔茨海默病发展的一个重要危险因素。有一些菌属提示对大脑有保护作用:如酪酸梭菌,通过增加胰高血糖素样肽-1的分泌而具有神经保护作用,另外一些肠道细菌产生的短链脂肪酸和抗氧化剂,也能保护大脑免受病原体的侵害。真菌、细菌可以在代谢过程中产生淀粉样蛋白,和真菌表面结构形成淀粉蛋白样物质。同时反过来,这些神经紊乱往往与肠道健康的改变有关,其特征是肠道微生物群组成的改变,这可能会破坏肠道菌群和大脑之间的相互作用。曾有研究表明阿尔茨海默病患者相比于正常人肠道中菌群丰富度和多样性均降低,其中双歧杆菌丰度显著减少[15]。另有研究显示,肠道菌群,如乳酸菌和双歧杆菌(革兰阳性菌)具有代谢谷氨酸的能力,谷氨酸是一种著名的初级兴奋性神经递质,产生γ-氨基丁酸[16],是一种脑内抑制性神经递质,与认知障碍、阿尔茨海默病、焦虑和抑郁等息息相关[17-19]。
肠道菌群与阿尔茨海默病的发病机制应成为临床研究的热点,应用肠道菌群治疗阿尔茨海默病已经成为临床研究的热门内容。肠道菌群多样性调节的方式已经成为阿尔茨海默病治疗的新靶点,目前临床采用最多的方式是粪菌移植的方法。了解微生物群的作用可能为治疗提供一片新天地,以延缓阿尔茨海默病发病、进展及逆转,同时也可能降低阿尔茨海默病发病率[20]。此外,应用某些标志物对疾病的发现和早期治疗也起到了重要作用[21]。本实验证明了轻型及重型阿尔茨海默病大鼠与正常大鼠之间肠道菌群的差异性,利用差异菌群有助于对早期阿尔茨海默病患者进行诊断及干预,延缓其发病速度,有望成为临床检测及治疗阿尔茨海默病的新方法。
