莪术醇抑制人骨肉瘤细胞系的增殖和促凋亡
2022-08-17江宁,郭钧,刘铖,周举
江 宁,郭 钧,刘 铖,周 举
(1.中国人民解放军总医院第五医学中心(原中国人民解放军第307医院)骨科,北京 100007;2.清华大学第一附属医院 骨科,北京 100016)
骨肉瘤是骨科恶性肿瘤中最为常见的一种,由间质细胞恶性增生引起,多发于股骨、胫骨、骨盆等部位,具有高度异质性,其特点是形成不成熟的骨样组织或类骨质[1]。外科手术治疗、放射治疗、化学治疗和靶向分子治疗是现阶段治疗骨肉瘤的主要手段[2],随着国内外学者对骨肉瘤的不断探索,越来越多的分子被证实参与了骨肉瘤的发生发展过程[3-4],最新的研究也证实了,β-连环蛋白(β-catenin)的异常表达与骨分化和骨形成有关,β-catenin在骨肉瘤细胞中的表达显著升高,参与调控骨肉瘤细胞增殖、分化、发育和凋亡[5],β-catenin是目前临床治疗骨肉瘤的重要分子靶点。莪术醇是从传统中药姜科植物莪术中提取出的化合物,具有抗菌、消炎、抗血小板凝集、镇痛及抗肿瘤活性,对于胃癌、食管癌、非小细胞肺癌等实体瘤均有较好的抑制作用[6-7],然而目前尚不清楚莪术醇对于骨肉瘤细胞的增殖和凋亡的影响。本次研究旨在探究莪术醇作用于骨肉瘤细胞的效应及相关机制,希望为骨肉瘤的靶向治疗提供更多理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞:人骨肉瘤细胞系MG-63和U2OS(中国科学院细胞库)。
1.1.2 试剂(盒):莪术醇溶液(中国食品药品检定研究院);Trizol试剂(Invitrogen公司);反转录试剂盒(广州泛思生物科技有限公司);Bax一抗、Bcl2一抗、caspase3一抗和β-catenin一抗[艾博抗(上海)贸易有限公司]。
1.2 方法
1.2.1 细胞的分组及处理:将MG-63细胞、U2OS细胞置于含10%胎牛血清和0.5%青霉素、0.5%链霉素的培养基中进行培养,保持培养箱内温度为37 ℃、5% CO2浓度,持续培养至细胞汇合达到80%以上以0.25%胰蛋白酶消化传代,待细胞稳定增殖后将其分为对照组、莪术醇20、40、80和160 μmol/L干预组,取对数期细胞进行后续实验。
1.2.2 MTT法检测细胞增殖:取经上述培养的各组MG-63细胞和U2OS细胞,调整细胞为2×104个/mL接种于96孔板中,每组设置5个复孔。对照组中加入无血清培养液,莪术醇0、20、40、80和160 μmol/L给药组分别加入100 μL以无血清培养液稀释至相应浓度的莪术醇溶液,待各组溶液滴加完毕,继续保持37 ℃、5% CO2浓度培养48 h。48 h后向每孔中避光滴加10 μL MTT溶液(5 g/L),继续孵育4 h后丢弃上层培养液,再滴加100 μL二甲基亚砜溶液,振荡摇匀后培养10 min,待底部结晶完全溶解时,使用酶标仪检测波长570 nm处的吸光度值,计算细胞抑制率和半数抑制浓度(IC50)值。
1.2.3 Transwell小室法检测细胞迁移和侵袭水平:取对数增殖期的上述各组MG-63细胞和U2OS细胞,调整细胞为2×104个/mL,加入Transwell上室,下室中加600 μL含20%胎牛血清的培养液,37 ℃培养12 h后移除上室细胞,用4%多聚甲醛将下室细胞固定,结晶紫染色晾干后拍照并记录细胞迁移数目。细胞侵袭实验步骤除Transwell上室需预先用Matrigel基质胶进行包被,其他与上述一致。
1.2.4 流式细胞测量术检测细胞凋亡:取经过不同处理的上述各组人骨肉瘤MG-63细胞和U2OS细胞,并将其制成1×106个/mL的细胞悬液,磷酸盐缓冲液清洗多次后转移至离心管中,高速离心后取细胞沉淀,加入500 μL按碘化丙啶染色液(×20)∶核糖核酸酶A(×50)=50∶2.5配置的工作液,37 ℃下避光孵育30 min,使用流式细胞仪检测波长488 nm处的红色荧光强度,计算细胞凋亡率。
1.2.5 RT-qPCR检测凋亡相关蛋白和β-catenin的mRNA表达:取经过不同处理的上述的各组MG-63细胞和U2OS细胞,磷酸盐缓冲液冲洗3次后加入Trizol试剂提取骨肉瘤细胞中的总RNA,调整RNA浓度后采用反转录试剂盒将RNA反转录为cDNA,引物设计见表1,以GAPDH作为标准化内部参照,设置反应条件为:95 ℃ 15 min预变性,95 ℃ 10 s变性,65 ℃ 30 s退火/延伸,采用PCR仪检测各组细胞内凋亡相关蛋白Bax、Bcl2、caspase 3和β-catenin的mRNA表达水平。
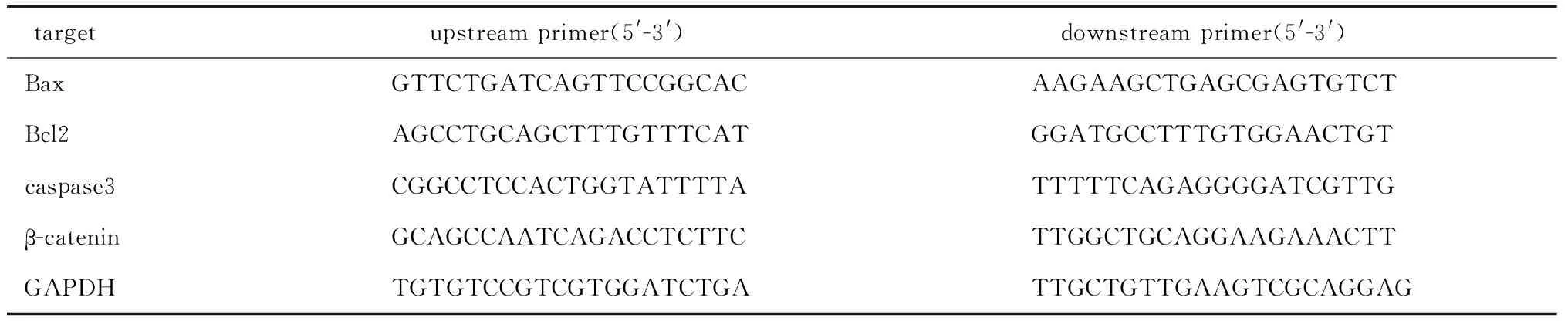
表1 引物设计Table 1 Primer design
1.2.6 Western blot检测凋亡相关蛋白和β-catenin蛋白表达:取经过不同处理的上述各组人骨肉瘤MG-63细胞和U2OS细胞,缓冲液清洗多次后加入细胞裂解液进行裂解,3 000 r/min离心15 min后取上清液保存于-80 ℃条件下,蛋白质定量法测定中蛋白浓度,取20 μg样品以10% SDS-PAGE凝胶电泳进行分离,设置上层胶电压为90 V,电泳30 min,设置分离胶电压为120 V,电泳2 h,再将蛋白以90 V电转移至聚偏氟乙烯膜上,封闭2 h后加入Bax、Bcl2、caspase 3和β-catenin一抗4 ℃孵育过夜,Trisl缓冲液漂洗3次后加入二抗室温下培养2 h,Trisl缓冲液再次漂洗3次后滴加化学发光液,以目的蛋白β-actin表示各组蛋白相对表达量[8]。
1.3 统计学分析
采用SPSS22.0软件处理本次所有实验数据,Prism8.0软件绘制图表,计数资料率用(n,%)表示,χ2检验。计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。
2 结果
2.1 莪术醇抑制骨肉瘤细胞增殖
莪术醇呈浓度依赖性地抑制MG-63和U2OS细胞体外增殖,IC50值分别为128.03 μmol/L、117.95 μmol/L(图1)。

图1 莪术醇对骨肉瘤细胞增殖的影响Fig 1 Effects of curcumol on proliferation of osteosar-coma cells (x±s,n=3)
2.2 莪术醇抑制骨肉瘤细胞迁移和侵袭
以上述药物浓度实验中得出的半数抑制浓度IC50值128.03 μmol/L、117.95 μmol/L作为后续莪术醇组浓度,Transwell检测莪术醇对骨肉瘤MG-63、U2OS细胞迁移和侵袭的影响,与对照组相比,莪术醇显著抑制骨肉瘤MG-63、U2OS细胞的体外迁移和侵袭(P<0.05)(图2)。
2.3 莪术醇诱导骨肉瘤细胞凋亡
与对照组相比,莪术醇显著诱导MG-63、U2OS细胞凋亡(P<0.05)(图3)。
2.4 莪术醇对Bax、BCl2和caspase 3基因mRNA表达的影响
与对照组相比,莪术醇组Bax、caspase 3的mRNA表达上调,Bcl2的mRNA表达下调(P<0.05)(图4)。
2.5 莪术醇对Bax、BCl2和caspase 3蛋白表达的影响
与对照组相比,莪术醇组Bax、caspase 3的蛋白表达上调,Bcl2的蛋白表达下调(P<0.05)(图5)。
2.6 莪术醇对β-catenin基因和蛋白的调控
与对照组相比,莪术醇组MG-63、U2OS细胞内β-catenin的mRNA表达水平和蛋白表达均被显著抑制(P<0.05)(图6~7)。
3 讨论
骨肉瘤具有高度侵袭性,恶性程度高,极易复发和转移,患者预后差[9]。血管内皮生长因子受体酪氨酸酶抑制剂等靶向药物在骨肉瘤的治疗中拥有较好的应用前景,通过抑制靶向识别特定的分子受体,抑制免疫检查点,发挥抗肿瘤免疫作用[10]。探究骨肉瘤发生发展的分子机制,确定有效治疗靶点和抗肿瘤药物,对于临床治疗而言意义重大。
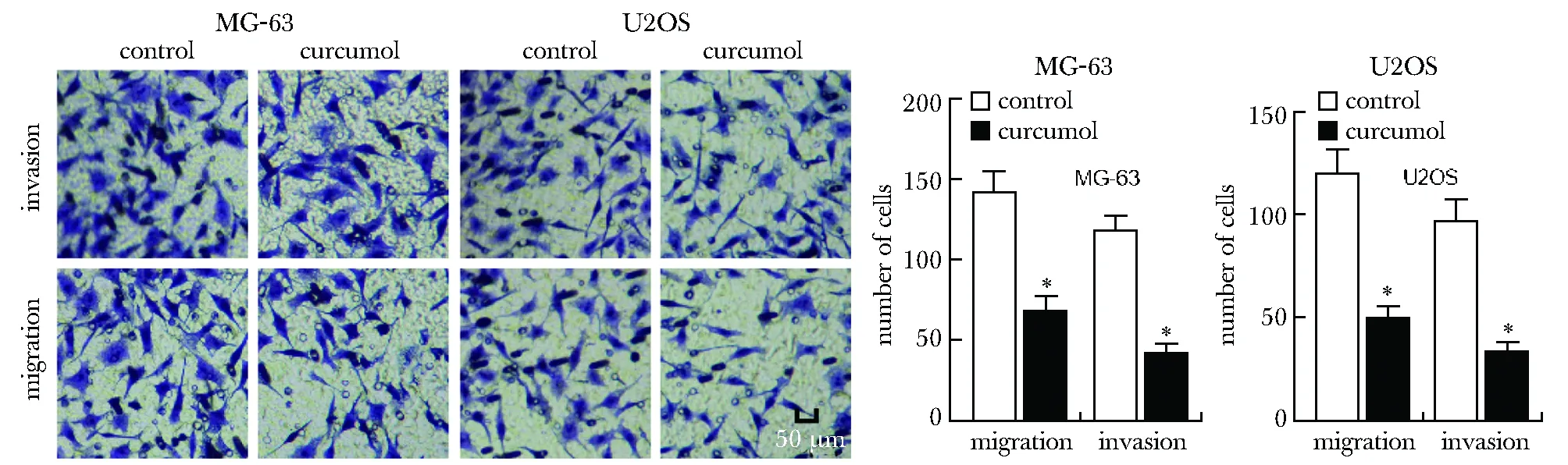
*P<0.001 compared with control图2 莪术醇对骨肉瘤细胞迁移和侵袭的影响Fig 2 Effects of curcumol on migration and invasion of osteosarcoma cells(x±s,n=3)
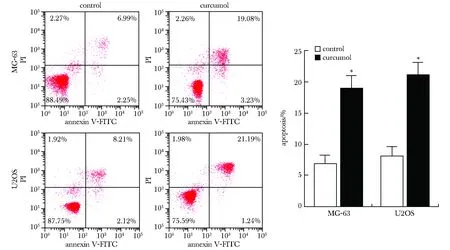
*P<0.001 compared with control图3 莪术醇对骨肉瘤细胞凋亡的影响Fig 3 Effects of curcumol on apoptosis of osteosarcoma cells(x±s,n=3)
骨肉瘤的发病因素较为复杂,不同于正常细胞,骨肉瘤等癌细胞的特点是具有无限增殖、可发生上皮间质细胞转化和易转移能力[11]。本研究结果表明莪术醇可显著抑制骨肉瘤MG-63、U2OS细胞的迁移和侵袭,诱导细胞凋亡。莪术醇等小分子药物对于癌的治疗效果通常是通过与癌细胞内的蛋白质靶点结合来实现的,在本次研究中,莪术醇通过调控骨肉瘤MG-63和U2OS细胞内的β-catenin的表达,阻断Wnt/β-catenin通路的活性,提高莪术醇对肿瘤细胞的杀伤性,发挥抑制肿瘤细胞增殖、迁移和侵袭的作用,诱导细胞凋亡[12]。
研究表明, Wnt/β-catenin通路的异常激活与骨肉瘤组织形态学的异常、细胞增殖和分化异常有关[13],当细胞质内的β-catenin大量积累时,β-catenin由胞质转向胞核,并与细胞核内的T细胞因子/淋巴增强因子(T-cell factor/lymphoid enhanc-ing factor,TCF/LEF)等转录因子相结合,激活下游靶基因的启动子,诱导骨肉瘤细胞的异常增殖和凋亡抗性[14],最终导致骨肉瘤的发生发展。本次研究发现莪术醇可显著抑制细胞内β-catenin的mRNA表达水平及蛋白表达。推测原因可能为莪术醇可引起骨肉瘤MG-63、U2OS细胞内钙离子稳态失衡,导致钙超载[15],过量的钙离子堆积可引起β-catenin上游靶基因糖原合成酶激酶3β表达增强,而活化的糖原合成酶激酶3β可通过影响β-catenin的磷酸化和泛素蛋白酶体途径抑制β-catenin的稳定性,从而发挥抑制骨肉瘤MG-63、U2OS细胞增殖、迁移和侵袭,诱导细胞凋亡,抑制骨肉瘤进展的作用。

*P<0.001 compared with control图4 莪术醇对骨肉瘤细胞内Bax、BCl2和caspase 3基因mRNA表达的影响Fig 4 Effects of curcumol on mRNA expressions of Bax, Bcl2 and caspase 3 genes in osteosarcoma cells(x±s,n=3)

*P<0.001 compared with control图5 莪术醇对骨肉瘤细胞内凋亡相关蛋白表达的影响Fig 5 Effects of curcumol on apoptosis-related proteins expressions in osteosarcoma cells(x±s,n=3)

*P<0.05 compared with control图6 莪术醇对骨肉瘤细胞内β-catenin基因mRNA表达水平的影响Fig 6 Effects of curcumol on mRNA expression level of β-catenin gene in osteosarcoma cells(x±s,n=3)
综上所述,莪术醇通过抑制β-catenin蛋白的表达,抑制骨肉瘤MG-63、U2OS细胞的增殖、迁移和侵袭,诱导细胞凋亡。本次研究结果提示莪术醇具有作为骨肉瘤靶向治疗药物的潜力,但也存在一定的局限性,比如仅探讨了莪术醇对于体外骨肉瘤细胞生物学的影响,未验证其是否在活体中拥有相似的效应,后续还需要进一步探索。

*P<0.05 compared with control图7 莪术醇对骨肉瘤细胞内β-catenin蛋白表达的影响Fig 7 Effects of curcumol on β-catenin protein expression in osteosarcoma cells(x±s,n=3)
