6-生物素氨基己酸-七叶亭合成及其生物活性评价
2022-08-17王佳茂韦永华卢易扬李美芽王林燕应佳妮蒋福升
王佳茂 韦永华 卢易扬 李美芽 王林燕 应佳妮 蒋福升
1.浙江中医药大学生命科学学院 杭州 310053 2.浙江中医药大学第一临床医学院 3.浙江中医药大学中医药科学院
七叶亭(esculetin,ESC),又名秦皮乙素、七叶内酯,化学名称为6,7-二羟基香豆素,是中药秦皮的主要药效成分之一,也是合成平喘药东喘宁的重要中间体[1]。现代药理学研究表明,ESC不仅具有平喘作用[2],还具有抗炎[3]、抗氧化[4]、保肝[5]、抗癌防癌[6-7]、抑菌[8]等诸多药理活性,并在脑缺血再灌注损伤[9-10]和肝、肾纤维化[11-12]等疾病的治疗方面展现出潜在的应用价值,是近年来开发应用研究热点天然化合物之一。现代分子药理学研究表明,ESC对诸多信号通路具有调控作用[13-14],但其确切的作用靶蛋白尚不清楚,这对以其为先导化合物进行结构修饰,开发活性更强的衍生物带来了困难。
亲和性蛋白组学(affinity-based protein profiling,ABPP)方法是近年发展起来的一种用于揭示小分子药物可能的靶蛋白的有利技术方法[15]。以生物素为报告基团,通过连接臂及反应基团和小分子药物偶联,制备小分子药物探针是ABPP方法中使用较为广泛和成熟的一种。通过该方法,已经揭示了青蒿素、小檗碱、雷公藤甲素等众多中药活性单体成分作用的靶蛋白[16]和相关分子机制。因此,本文对6-生物素氨基己酸(6-biotinamidohexanoic acid,Bio-AHA)偶联ESC合成条件进行优化,以制备6-生物素氨基己酸-七叶亭(6-biotinamidohexanoic acid-esculetin,Bio-AHAESC)探针,并对其抗炎和细胞保护活性进行评价,为进一步揭示中药单体ESC的作用靶点和分子机制奠定基础。
1 材料和方法
1.1 仪器和材料
1.1.1 主要仪器 U3000型高效液相色谱(high performance liquid chromatography,HPLC) 系统购于美国戴安公司;C6型流式细胞仪购于美国BD公司;Enspire多功能酶标仪购于美国PerkinElmer公司;ACQUITY H-Class PLUS型超高效液相色谱仪及SYNAPT G2-Si型高分辨四级飞行时间串联液质联用仪均购于美国Waters公司;Magnet System 600型600 MHz核磁共振波谱仪为德国Bruker公司产品。
1.1.2 药品和试剂 ESC购于九鼎化学(上海)科技有限公司 (批号:TWI52);Bio-AHA购于天津希恩思生化科技有限公司(批号:1069023020);4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP)和N,N'-二环己基碳化二 亚胺(N,N'-dicyclohexyl carbodiimide,DCC)均购于上海麦克林生化科技有限公司(批号:C12072879、C11697350);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDCI]购于研峰科技(北京)有限公司(批号:SPSJH8B);干燥(水分≤30 ppm)N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)购于安徽泽升科技有限公司(批号:92HRBRRA);色谱纯乙腈购于西格玛奥德里奇(上海)贸易有限公司(批号:WXBD5691V);色谱纯甲酸购于上海阿拉丁生化科技股份有限公司(批号:B1912070);细胞活力测定试剂盒(cell counting kit-8,CCK-8)购于日本同仁化工株式会社(批号:PH632);杜尔伯克改良伊格尔培养基 (Dulbecco's modified Eagle medium,DMEM)和胎牛血清均购于Gibco公司(批号:GP2011011、20151103);BDTM小鼠炎症因子微量样本多指标流式阵列(cytometric bead array,CBA)分析试剂盒购于美国BD公司(批号:0325011);其他试剂均为分析纯。
1.1.3 细胞株 人肝癌细胞HepG2和小鼠单核巨噬细胞RAW264.7均购于上海中科院细胞库。
1.2 方法
1.2.1 不同反应条件对Bio-AHA-ESC合成率影响分别称取Bio-AHA,以干燥DMF溶解,冰浴30 min后加入DCC并冰浴搅拌反应30 min,然后加入DMAP和ESC,继续冰浴搅拌反应3 h,自然恢复室温后继续搅拌反应[17]。另外称取Bio-AHA,以干燥DMF溶解,加入ESC、DMAP和EDCI,室温搅拌反应[18]。定量取样稀释,进样10 μL进行HPLC分析,考察不同催化剂、反应温度、反应时间、Bio-AHA和ESC投料比及催化剂用量对ESC转化率和产物产率的影响。
1.2.2 HPLC色谱条件 采用戴安UltiMateTM3000分析型HPLC系统,色谱条件为:岛津Inertsil®ODS-SP色谱柱(4.6 mm×250 mm,5 μm),Phenomenex C18保护柱(4.0 mm×3.0 mm),柱温25 ℃,流速1 mL·min-1,检测波长343 nm,流动相为乙腈(A)和0.1%甲酸水(B),梯度洗脱:0~10 min 15%A,10~15 min 15%~25%A,15~25 min 25%A,25~30 min 25%~95%A,30~31 min 95%~15%A,31~41 min 15%A。 配制系列对倍稀释ESC标准液,进样10 μL,按上述色谱条件绘制ESC标准曲线:Y=862.51X-2.9645,R2=0.9998。
1.2.3 产物分离鉴定 反应结束后直接进样UltiMate 3000半制备型HPLC系统,色谱条件为:welch Ultimate®XB-C18色谱柱 (10 mm×250 mm,10 μm),柱温30 ℃,流速5 mL·min-1,检测波长325 nm,流动相为乙腈(A)和0.1%甲酸水(B),梯度洗脱:0~3 min 20%A,3~11 min 20%~80%A,11~12 min 95%A,12~17 min 20%A,收集对应产物峰。产物作紫外光谱扫描,同时进样SYNAPT G2-Si Q-TOF高分辨质谱仪作质谱鉴定,并于600 MHz核磁共振被谱仪上测定氢谱。
1.2.4 细胞毒性检测 取指数生长期HepG2或RAW264.7细胞,调整细胞密度为1×105个·mL-1,以每孔200 μL的体积接种于96孔板,置于37 ℃,5% CO2培养箱中培养过夜。分别加入不同浓度的ESC和Bio-AHA-ESC,继续培养22 h,每孔加入CCK-8试剂10 μL,继续培养2 h,于Enspire多功能酶标仪上检测450 nm处吸光度(absorbance,A)值,每个浓度设3个复孔,同时设立试剂对照,计算细胞存活率。

1.2.5 氧化应激损伤保护作用检测 取指数生长期HepG2细胞,以1×105个·mL-1的数量接种于96孔板,每孔200 μL,置于37℃,5% CO2培养箱中培养过夜。分别加入不同浓度的ESC和Bio-AHA-ESC,预培养2 h,然后加入终浓度为0.60 mmol·L-1的过氧化氢继续培养22 h,每孔加入CCK-8试剂10 μL,继续培养2 h,酶标仪上检测450 nm处A值,每个浓度设3个复孔,同时设立试剂对照,同上计算细胞存活率。
1.2.6 抗炎活性分析 取指数生长期RAW264.7细胞,接种于96孔板,贴壁培养过夜,加入不同浓度ESC和Bio-AHA-ESC预处理1 h后, 加入终浓度为200 μg·L-1的脂多糖(lipopolysaccharide,LPS)刺激处理,12 h后吸取上清液50 μL,以流式CBA法测定炎症因子水平。
1.3 统计学分析 采用GraphPad Prism 6.0软件进行统计学分析和作图。计量资料以±s表示,各组间比较采用一维方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同催化剂对产物合成的影响 称取ESC 17.80 mg(0.10 mmol)、Bio-AHA 17.90 mg (0.05 mmol)、DCC 20.60 mg(0.10 mmol)或EDCI 19.20 mg(0.10 mmol)及DMAP 12.00 mg(0.10 mmol)。其中DCC催化反应先低温反应3 h,然后恢复室温反应至24 h;而EDCI直接室温反应24 h,反应后分别取样稀释进行HPLC分析。见图1。在上述羧基和羟基摩尔比为1:4的反应条件下,DCC催化约(49.18±5.93)%的ESC被转化(图1B中1号峰),而EDCI催化约(87.51±7.26)%的ESC被转化(图1C中1号峰);生成的产物DCC催化产率仅为EDCI的(66.04±7.27)%(图1B和C中2号峰),且DCC催化在31.35 min有一副产物(图1B中3号峰),不利于产物分离纯化。因此,从ESC转化率、产物生成率和产物是否易于分离、纯化的角度考虑,选择EDCI作为催化剂较为合适。
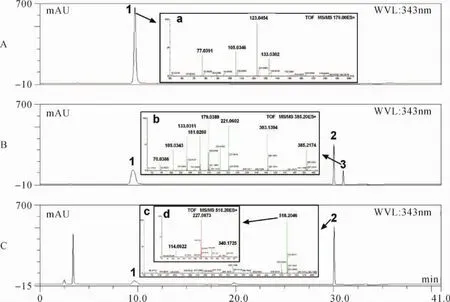
图1 反应24 h后样品HPLC图Fig.1 HPLC diagram of the samples after 24 h of reaction
2.2 反应温度和时间对EDCI催化产物合成的影响以EDCI为催化剂,按照2.1中的各物质配比,一组冰浴搅拌反应3 h后恢复室温反应,另一组直接室温搅拌反应,分别于反应3、6、9和24 h精密吸取反应液20 μL,以色谱纯乙腈稀释到1 mL,0.22 μm滤膜滤过,进样10 μL进行HPLC分析,通过比较2号峰面积变化,考察不同反应温度和时间对产物产率影响。见图2。从图2A可以看出,反应3 h时室温条件产物峰面积显著高于冰浴条件峰面积(P<0.05),说明室温有利于产物生成;但6 h后无论冰浴还是室温,各组峰面积差异无统计学意义(P>0.05),因此确定室温反应6 h为宜。

图2 不同条件反应产物峰面积变化Fig.2 Changes of peak area of Bio-AHA-ESC under different reaction conditions
2.3 EDCI和DMAP催化剂用量对产物合成的影响按照2.1中的方法配比,固定其他试剂不变,分别考察不同EDCI添加量对产物产率影响。结果表明,当EDCI添加量与羧基等摩尔时(均为0.05 mmol),产物量显著低于2倍羧基摩尔数(0.10 mmol)添加量(P<0.01);但继续增加EDCI量,产物并无显著增加(P>0.05)。 见图2B。因此,固定EDCI添加量为2倍羧基摩尔数(与ESC等摩尔数)。考察DMAP添加量对产物的影响,发现在0.01~0.15 mmol范围内,DMAP添加量对产物产率无显著影响(P>0.05),即EDCI摩尔数十分之一的DMAP即可达到较好的催化效率。见图2C。
2.4 Bio-AHA和ESC投料比对产物合成的影响 按照2.1中的方法,固定Bio-AHA为0.05 mmol,EDCI 0.10 mmol,DMAP 0.01 mmol,考察ESC与Bio-AHA摩尔比为0.5、1、2和3时对产物合成影响。结果表明,上述摩尔比为0.5~2范围内,随着ESC量增加,产物合成量显著提高(P<0.01);但当摩尔比为2和3时,产物量差异无统计学意义(P>0.05)。见图2D。因此确定两者摩尔比以2为宜,此时羟基和羧基摩尔比为4。
2.5 Bio-AHA-ESC合成、纯化和结构表征 按照2.1中的方法,称取ESC 35.60 mg(0.20 mmol)、Bio-AHA 35.80 mg(0.10 mmol)、EDCI 38.40 mg(0.20 mmol)及DMAP 24.00 mg(0.20 mmol),以4 mL干燥DMF溶解,室温搅拌反应6 h。直接进样半制备液相色谱系统,收集9.48~9.85 min峰(见图3A),经2次制备得到单一峰产物(见图3B),减压浓缩,冷冻干燥得产物32.56 mg。

图3 Bio-AHA-ESC半制备液相色谱图Fig.3 Semi-preparation liquid chromatogram of Bio-AHA-ESC
产物紫外光谱特征与ESC类似,但最大波长324.60 nm较ESC最大波长342.60 nm紫移18.00 nm。见图4A、B。这与氨基己酸羰基吸电子效应导致ESC苯环电子云密度降低有关,表明已发生酯化反应。另外,产物二级质谱中呈现典型的Bio-AHA碎片离子([M-H2O+H]+=340.17)、生物素碎片离子([M-H2O+H]+=227.09)和氨基己酸碎片离子([M-H2O+H]+=114.09)。见图1C中d。表明Bio-AHA已与ESC酯化连接。而产物一级谱分子离子峰[M+H]+=518.20,表明ESC一个酚羟基被Bio-AHA衍生化。见图1C中c。
为了进一步明确是6位还是7位酚羟基衍生化,对产物进行了核磁氢谱分析。比较ESC和Bio-AHA-ESC氢谱图,可以发现产物H-5和H-8化学位移均向低场移动(见图4C、D),这与羰基吸电子效应导致紫外光谱紫移结果一致;更为关键的是,H-5化学位移从原来的6.98变成7.39,显著大于H-8氢化学位移变化(从6.74变成6.82),表明6位羟基被修饰,生成了图4D中所示结构的衍生物,这一氢谱化学位移的改变与刘季红等[19]报道的ESC衍生物氢谱化学位移变化规律一致。
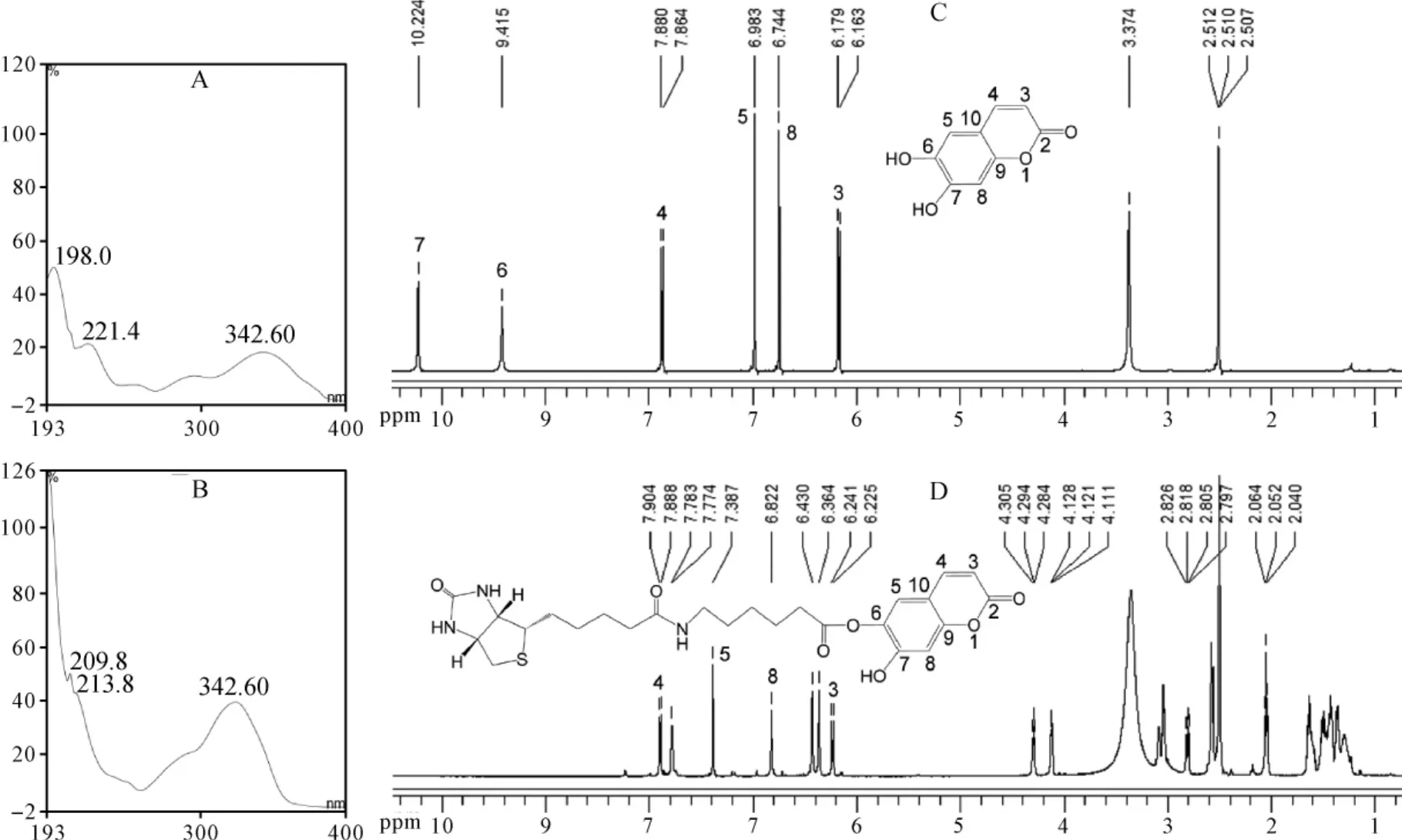
图4 ESC和Bio-AHA-ESC紫外光谱图和核磁氢谱图Fig.4 UV-VIS spectra and1H NMR spectra of ESC and Bio-AHA-ESC
2.6 Bio-AHA-ESC对过氧化氢诱导的HepG2细胞损伤保护作用 CCK-8结果表明, 在20~80 μmol·L-1范围内,ESC和Bio-AHA-ESC对HepG2细胞无明显细胞毒性。见图5A。0.60 mmol·L-1过氧化氢显著诱导HepG2细胞氧化损伤,而ESC和Bio-AHA-ESC均可剂量依赖性抑制过氧化氢诱导的HepG2细胞损伤。见图5B。 在20~60 μmol·L-1范围内,Bio-AHA-ESC保护作用稍优于ESC,且20 μmol·L-1时差异有统计学意义(P<0.05);但高剂量80 μmol·L-1时,两者细胞存活率分别为(88.38±5.77)%和(84.13±6.50)%,ESC保护作用相对较强,但差异无统计学意义(P>0.05)。见图5B。
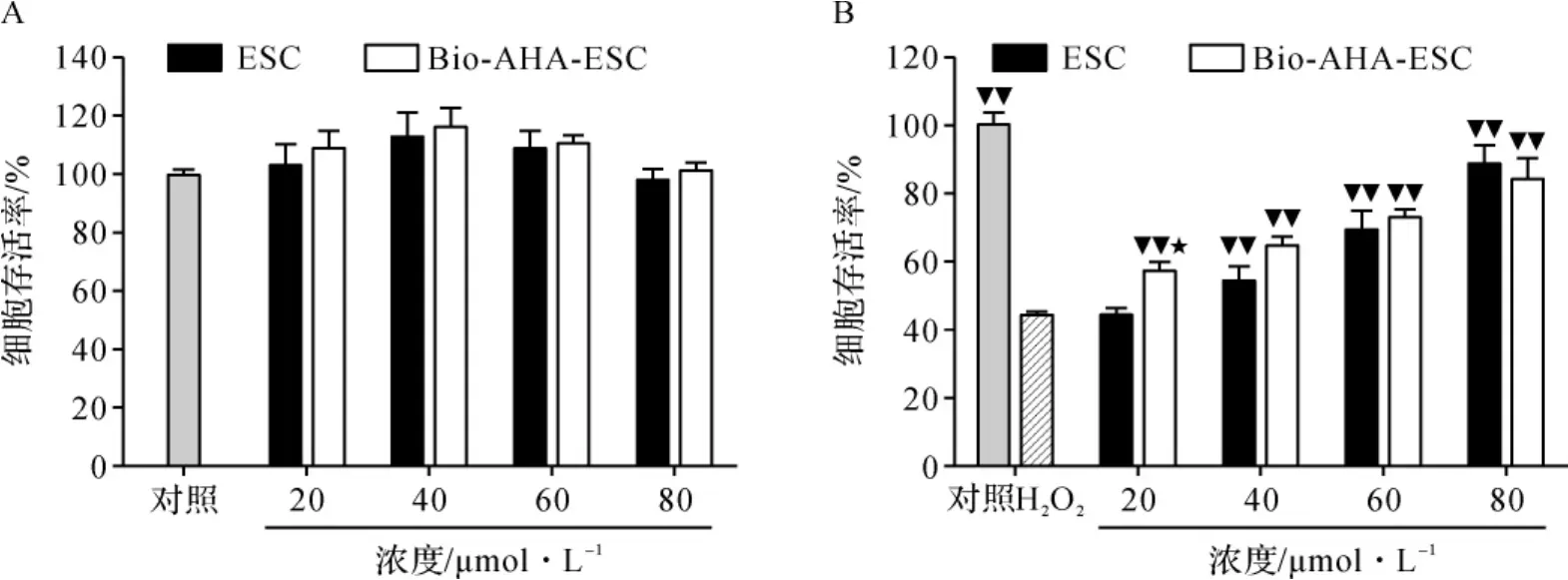
图5 ESC和Bio-AHA-ESC对HepG2细胞生长的影响和对过氧化氢诱导的HepG2细胞损伤的保护作用Fig.5 Inhibitory effect of ESC and Bio-AHA-ESC on HepG2 cell growth and its protective effect on HepG2 cell injury induced by hydrogen peroxide
2.7 Bio-AHA-ESC的抗炎活性 在20~80 μmol·L-1范围内,ESC和Bio-AHA-ESC对RAW264.7细胞无显著细胞毒性。 见图6A。 200 μg·L-1的LPS刺激24 h后,IL-6水平显著升高(P<0.01),而ESC和Bio-AHA-ESC均可剂量依赖性抑制IL-6分泌。总体上,相同浓度的药物处理组间比较,ESC的抑制活性优于Bio-AHAESC,尤其60 μmol·L-1时两者差异有统计学意义(P<0.01);80 μmol·L-1时两者对IL-6抑制率分别为(82.49±2.06)%和(79.48±2.93)%,差异无统计学意义(P>0.05)。 见图6B。

图6 ESC和Bio-AHA-ESC对RAW264.7细胞生长影响及其对LPS诱导的IL-6分泌抑制作用Fig.6 Inhibitory effects of ESC and Bio-AHA-ESC on the growth of RAW264.7 cells and IL-6 secretion induced by LPS
3 讨论
DCC和EDCI是常用的酯化偶联催化剂,两者均能在温和条件下促进Bio-AHA羧基和ESC酚羟基发生酯化反应。但本研究发现,DCC催化在产物附近有一明显的副产物,不利于产物分离纯化,而且其催化ESC转化效率和产物生成率低于EDCI,因此EDCI是较为理想的催化剂。但从投料比(ESC与Bio-AHA摩尔比为2:1,即酚羟基与羧基摩尔比为4:1)和最终生成的单酚羟基酯化产物看,如果Bio-AHA完全反应,理论上应有50%的ESC被转化;但实际上EDCI催化后(87.51±7.26)%的ESC被转化;说明部分ESC也被转化生成了副产物,图1C中2.5 min和3.0 min左右出现的峰证实了这一推测。
以EDCI为偶联剂,本研究对反应温度、反应时间、DMAP添加量、ESC和Bio-AHA投料比进行了优化,结果表明反应条件为ESC与Bio-AHA摩尔比为2:1,DMAP为EDCI摩尔数的十分之一,干燥DMF溶解室温搅拌反应6 h时可获得较高的产率。所得反应液直接通过半制备液相分离纯化,即可获得产物;经紫外光谱、核磁氢谱和高分辨率质谱鉴定为ESC 6位酚羟基Bio-AHA衍生化产物,即在上述反应条件下ESC 6位酚羟基活性较高,EDCI可选择性催化其发生单酯化反应,这对今后类似邻位酚羟基化合物衍生化研究具有一定指导意义。
近年来新型冠状病毒肺炎的临床治疗研究表明,抗炎中药具有重要开发应用价值[20]。ESC是中药秦皮中主要功效成分之一,对哮喘具有较好疗效;现代药理学研究表明其具有较强抗炎活性[3]和氧化应激损伤保护作用[4]。因此,本研究对所制备的Bio-AHAESC的上述生物活性进行了初步评价,结果表明产物活性和ESC类似,对HepG2细胞和RAW264.7细胞毒性均较低,但均可剂量依赖性抑制过氧化氢诱导的HepG2细胞氧化应激损伤和LPS诱导的RAW264.7细胞炎症因子IL-6的释放。而且在低剂量时(20.00 μmol·L-1),Bio-AHA-ESC氧化应激损伤保护作用优于ESC,80.00 μmol·L-1时两者相当; 但抗炎方面,Bio-AHA-ESC抗炎活性较弱,尤其是浓度为60 μmol·L-1时弱于对应浓度的ESC,而且差异有统计学意义,但高浓度80.00 μmol·L-1两者抗炎活性差异无统计学意义。
综上所述,本研究建立了一种高效的Bio-AHAESC合成方法,工艺优化条件为:ESC与Bio-AHA摩尔比为2:1,DMAP添加量为EDCI摩尔数的十分之一,干燥DMF溶解室温搅拌反应6 h。抗炎、抗氧化活性评价结果表明,ESC经Bio-AHA衍生化后仍然保留了其生物学活性,这为后续采用ABPP揭示ESC可能的靶蛋白和确切分子机制奠定了良好基础。
