副猪嗜血杆菌血清7型菌株的分离鉴定及生物学特性研究
2022-08-17王治方朱文豪徐引弟张青娴焦文强李海利王克领
王治方,朱文豪,徐引弟,张青娴,焦文强,李海利,王克领
(河南省农业科学院畜牧兽医研究所,河南 郑州 450002)
副猪嗜血杆菌是当前规模化猪场主要的细菌性病原,是一种革兰氏阴性、需NAD的多形态细小杆菌,可长期寄生于健康猪的上呼吸道中,当机体抵抗力降低时,可使各年龄、品种的猪只感染发病,4~8周龄的保育仔猪发病率、死亡率相对较高,临床常表现多发性纤维素性浆膜炎、关节炎、脑膜炎等病理特征,在世界范围内广泛流行,给养猪业造成很大经济损失[1-2]。
副猪嗜血杆菌致病机制非常复杂,通常认为与菌株携带的毒力基因有密切关系。副猪嗜血杆菌已鉴定出15个血清型,还有20%左右的临床分离菌株用现有方法无法分型,不同血清型菌株的毒力及致病性存在较大差异,同一血清型不同分离菌株的致病力也有一定差异,发病情况也有一定的不同[3]。因此,开展副猪嗜血杆菌临床分离菌株生物学特性的研究,对该病综合防控具有重大意义。
2021年5月,河南省三门峡某猪场一栋保育猪出现食欲减退、发烧、消瘦、被毛粗乱、咳嗽、呼吸困难、关节肿大或跛行等临床症状,先后死亡20多头猪只。为了确诊发病原因,河南省农科院畜牧兽医研究所传染病研究室对送检的发病猪只进行了剖检,根据剖检情况采集了相关样品,进行细菌病原分离鉴定、血清型鉴定、药敏试验以及毒力基因检测,旨在为猪场临床有效防控该病提供参考依据。
1 试验材料
1.1 病料
病料采自河南省三门峡某规模化猪场濒死期的发病保育猪,病料包括肺、气管黏液、心血、关节液。
1.2 主要仪器及试剂
Thermo 5020 PCR扩增仪、Thermo 1300SERIES A2生物安全柜购自赛默飞世尔科技(中国)有限公司;电泳仪(DYY-6型)购自北京市六一仪器厂;凝胶成像系统购自沙船(天津)生物科技发展有限公司;5418台式高速离心机购自eppendorf公司。胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)购自碧迪医疗器械(上海)有限公司;烟酰胺腺嘌呤二核苷酸(辅酶Ⅰ,NAD)购自 Roche公司;胎牛血清、Tap PCR master mix、DL 2 000 DNA Marker、DNA提取试剂盒等 PCR 试剂购自北京擎科生物科技有限公司;基因引物由北京擎科生物科技有限公司合成。药敏片购自杭州滨河微生物试剂有限公司。
1.3 试验动物
体重250 g左右的健康雄性豚鼠10只,购自郑州大学实验动物中心。
2 试验方法
2.1 病原的分离、纯化
无菌将样品接种于TSA平板(含5%的新生牛血清,1/10万的NAD)上,放置于5% CO2培养箱,37 ℃培养24~48 h,挑取可疑单个菌落纯化,分别接种含有NAD的TSA平板和不含NAD的TSA平板上,再培养24~48 h后观察菌落形态;挑取纯化的单个菌落进行革兰氏染色镜检,观察菌体形态。
2.2 菌株PCR鉴定及序列分析
按照DNA提取试剂盒说明书提取菌株的DNA作为模板。参照文献[4-7]设计合成副猪嗜血杆菌16S rRNA基因特异性引物和副猪嗜血杆菌血清型1~15型引物(表1)进行PCR扩增鉴定,回收PCR扩增产物送北京擎科生物科技有限公司测序,对测序结果用BLAST进行同源性比较。

表1 副猪嗜血杆菌及血清型引物序列信息
2.3 毒力基因检测
以可疑菌株的DNA为模板,参照文献[8-10]合成副猪嗜血杆菌毒力基因的引物(表2)进行PCR扩增检测,鉴定该株副猪嗜血杆菌毒力基因携带情况。

表2 毒力基因引物序列信息
2.4 致病性试验
将试验豚鼠随机分为试验组和对照组,5只/组。挑选纯化好的单个菌落接种于TSB(含5%的新生牛血清)液体培养基中,置于培养箱37 ℃培养24 h,计数备用。试验组豚鼠腹腔注射2.0×109浓度的菌液0.5 mL/只;对照组豚鼠腹腔注射生理盐水0.5 mL/只。接种后仔细观察记录每组发病情况,对发病豚鼠做细菌分离鉴定。
2.5 药敏试验
采用纸片扩散法。挑取典型菌落用生理盐水制成浓度为0.5麦氏单位的菌悬液,用灭菌棉签蘸取制成待检细菌悬液,均匀涂满TSA平板(含5%的新生牛血清,1/10万NAD)表面;用灭菌镊子夹取药敏纸片均匀有规律的贴于TSA平板上,并用镊子轻按纸片中心,使药敏纸片与平板培养基附着严密,置于5% CO2培养箱37 ℃培养36 h,取出测量抑菌圈大小,判断标准参照药敏片说明书。
判定结果分为敏感、中介、耐药。抗生素药敏片有头孢噻呋、头孢他啶、阿莫西林、青霉素、氨苄西林、复方新诺明、左氟沙星、恩诺沙星、氧氟沙星、环丙沙星、卡那霉素、阿米卡星、壮观霉素、替米考星、阿奇霉素、四环素、强力霉素、土霉素。
3 试验结果
3.1 细菌的分离、纯化
37 ℃培养36 h后,在接种肺脏、心血的TSA平板(含5%的新生牛血清,1/10万NAD)上均长有一种光滑、湿润、边缘整齐、略带荧光、露珠样、针尖大小的菌落。该菌株在含有NAD的TSA平板上生长良好,在不含NAD的TSA平板上不生长。革兰氏染色镜检,该细菌为革兰氏阴性、球杆状、棒杆状和长丝状多形态杆菌(图1)。

图1 菌体形态(1 000×)
3.2 菌株鉴定和分型鉴定
用副猪嗜血杆菌16S rRNA鉴定引物和分型引物对分离菌株进行PCR扩增鉴定,结果分别扩增出822 bp、490 bp两条条带,大小和副猪嗜血杆菌、血清7型目的条带一致,表明该分离菌株为副猪嗜血杆菌,血清型为7型(图2),暂命名为HNSMX1 。回收PCR扩增产物送北京擎科生物科技有限公司测序,对测序结果用BLAST进行同源性比较,该菌株与副猪嗜血杆菌vHPS7菌株(GenBank No.:CP049089)同源性高达100%。
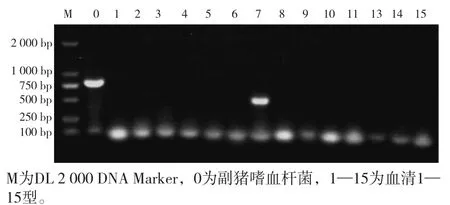
图2 HNSMX1菌株PCR鉴定及分型
3.3 毒力基因测定结果
通过PCR扩增测定HNSMX1菌株的毒力基因。结果基因vta1、vta2、vta3、wza、ompP2、nanH、cdtA、cdtB、cdtC、espP2为阳性(图3)。
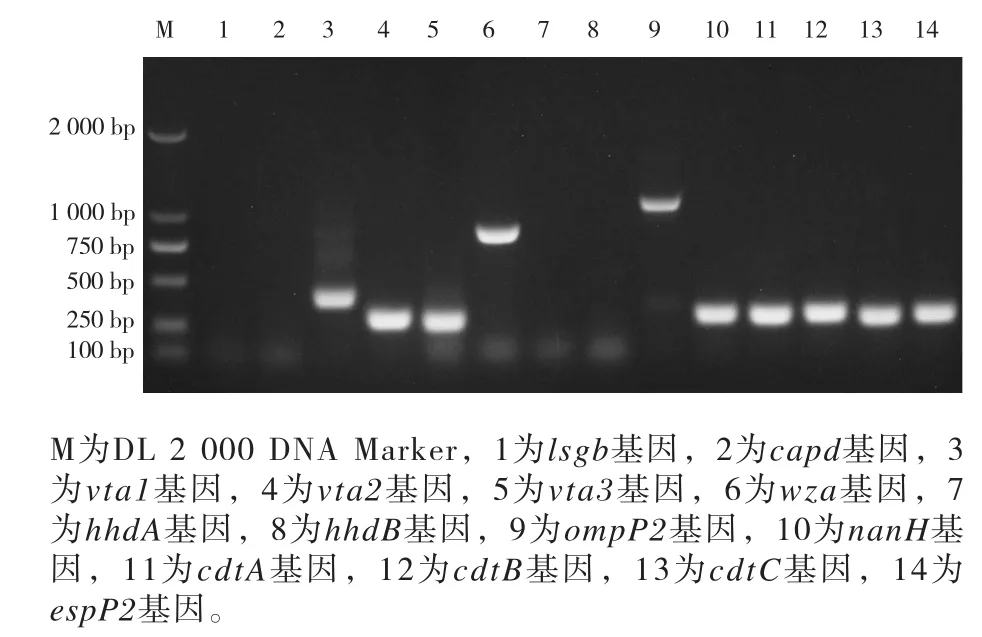
图3 HNSMX1毒力基因PCR检测结果
3.4 致病性试验结果
在攻毒24 h后,试验组有2只豚鼠逐渐出现被毛粗乱、蜷缩发抖等症状;对照组豚鼠生长状态良好,未出现任何临床症状。攻毒5 d后,试验组和对照组豚鼠均未发生死亡,对试验组发病豚鼠进行剖检发现,胸腔、腹腔有少量积液,有纤维性渗出物附着;用心血、肝脏触片,革兰氏染色镜检发现有革兰氏阴性、长短不一的细丝状菌体。同时无菌采集试验组死亡豚鼠的心血、肝脏接种TSA平板(含5%的新生牛血清,1/10万的NAD),37 ℃培养30 h后,分离获得和接种菌株相一致的单一细菌。
3.5 药敏结果
HNSMX1菌株常规药敏试验结果见表3。结果可见,该菌株对头孢噻呋、头孢他啶、强力霉素、土霉素、四环素、阿奇霉素6种药物敏感;对替米考星药物为中介;对青霉素G、阿莫西林、氨苄西林、复方新诺明、左氟沙星、氧氟沙星、恩诺沙星、环丙沙星、壮观霉素、卡那霉素、阿米卡星11种药物耐药。
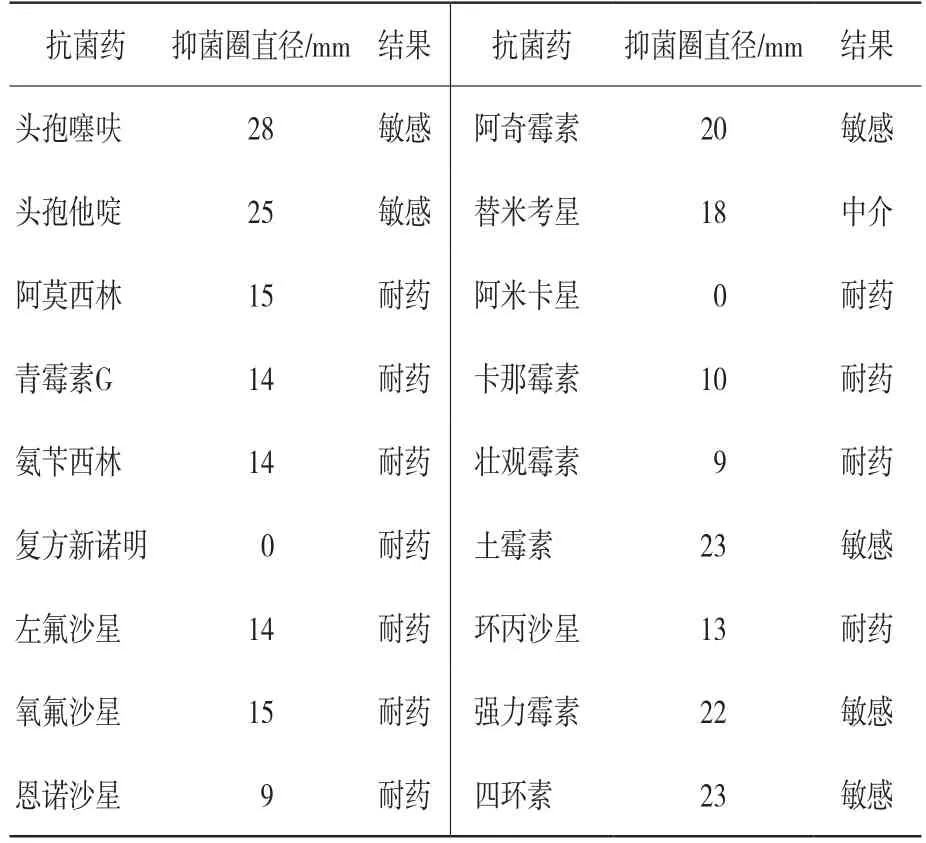
表3 药敏试验结果
4 讨论
副猪嗜血杆菌病已经成为当前养猪行业的重要细菌性疾病之一,常常单独发生或作为继发病原继发感染于病毒病之后,给养猪行业造成不小的经济损失。本试验从患病保育仔猪病料分离获得1株病原菌,通过培养特性、形态学观察、PCR扩增鉴定及分型鉴定,表明该株细菌为副猪嗜血杆菌,血清型为7型。通过BLAST比对,该菌株与副猪嗜血杆菌vHPS7菌株(GenBank No.:CP049089)同源性高达100%。
副猪嗜血杆菌临床血清型较多,不同血清型菌株的毒力及致病性不同,临床感染发病情况也不尽相同。菌株毒力的强弱与其携带的毒力因子有着直接关系,副猪嗜血杆菌毒力因子较多且尚未完全研究清楚。本试验筛选检测的14个毒力基因很有可能是副猪嗜血杆菌的致病关键因子。通过毒力因子检测,结果表明HNSMX1菌株携带vta1、vta2、vta3、wza、ompP2、nanH、cdtA、cdtB、cdtC、espP2毒力基因,与张青娴等[11]检测报道的HPS血清7型只携带vta1、ompP2、nanH、espP2毒力基因有很大差异。一般情况下,毒力基因vta2、vta3、wza、cdtA、cdtB、cdtC存在于中等毒力和强毒力菌株中,wza基因在菌株荚膜多糖转运过程中起重要作用,缺失wza基因能使HPS菌株毒力显著降低;在体内感染情况下,cdtA、cdtB、cdtC毒力基因均出现上调表达,是HPS菌株直接发挥细胞毒性的重要武器,而vta2、vta3毒力基因主要被致病菌株所携带。
抗生素对细菌性疾病的控制起着非常关键的作用,但由于养殖过程中不科学的、长期盲目滥用抗生素,临床很多致病性细菌产生了耐药性,使得药物的抗菌效果越来越差,不但造成药物浪费,而且还延误病情,给养殖户造成了很大的经济损失。HNSMX1菌株药敏试验结果表明,该菌株对β内酰胺类的头孢噻呋、头孢他啶敏感,对阿莫西林、青霉素G、氨苄西林耐药,这和刘英玉[12]的研究结果相同。该菌株对四环素类的强力霉素、四环素、土霉素均敏感,与王治方等[13]的研究结果一致。该菌株对大环内酯类的阿奇霉素敏感,对替米考星表现为中介,这可能和本场对替米考星的长期使用有关。该菌株对氨基糖苷类、磺胺类、喹诺酮类8种药物均表现为耐药。该菌株表现出明显的多重耐药现象,其耐药性与先前有关报道结果既有部分相符,又有明显差异。因此,生产实际中对临床分离菌株进行及时、准确的耐药性检测,对防控、治疗副猪嗜血杆菌病非常重要。
本试验从河南三门峡病例中分离获得的HPS血清7型HNSMX1菌株,根据菌株毒力基因检测结果、致病性试验结果,结合临床发病情况,表明该HPS血清7型菌株有一定的毒力,在一定条件下,能够引起猪群发病,和先前报道的HPS血清7型为无毒力菌株有一定差异,可能是部分菌株在临床自然进化过程中,出现毒力增强现象,在临床副猪嗜血杆菌病的防控中,应引起广大养猪场的重视。
