黄芪总黄酮对血管性痴呆模型大鼠学习记忆损伤的干预作用*
2022-08-17江增宏
陈 攻,江增宏
(合肥职业技术学院,安徽 合肥 230012)
血管性痴呆(Vascular dementia, VD)是因多种脑血管疾病所致脑组织损伤引起,以学习认知功能障碍为主的临床综合征,是仅次于阿尔茨海默病(Alzeimer's disease, AD)的常见痴呆原因,约占痴呆的20%[1]。随着年龄的增长和中风存活率的提高,VD发病率不断升高;据统计,60岁以上的脑卒中幸存者中,25%~41%将会在3个月内发展为VD[2-3]。目前仍缺乏有效的干预VD的药物和手段。
黄芪是豆科黄耆属植物,据中国药典记载,黄芪具有生津养血、敛疮生肌、补气升阳等功效。现代医学研究表明黄芪具有免疫调节和抗炎作用、抗氧化、抗肿瘤、预防心脑血管疾病等功效。黄芪总黄酮(total flavonoids of Astragalus, TFA)是从黄芪干燥根中提取的有效成分。一系列研究表明,TFA具有抗氧化、抗衰老、抗肿瘤、抗突变、抗动脉粥样硬化等生物学效应[4-5]。另有研究表明TFA通过抗凋亡、减轻炎症反应、抑制氧化应激反应保护脑缺血再灌注损伤[6]。因TFA对血管性痴呆大鼠的学习记忆损伤作用未见明确报道, 因此, 本研究就TFA对血管性痴呆模型大鼠学习记忆损伤的作用和机制进行了研究。
1 材料与方法
1.1药品与试剂 TFA(批号:DST160804-093)由上海源业生物科技有限公司(中国上海)提供, 临用前用生理盐水(NS)溶解至所需浓度。抗ROCK2单克隆抗体、Tau Ser262磷酸化单克隆抗体、内参β-actin抗体购于Biosourse公司。大鼠神经特异性烯醇化酶(NSE)酶联免疫分析试剂盒购于南京建成生物工程研究所有限公司。国产或进口分析纯均购自于上海生工公司。
1.2动物 SD大鼠,雌雄各半,购于安徽省实验动物中心,合格证号: SCXK 2005001。
1.3方法
1.3.1建立大鼠血管性痴呆模型[7]70只野生型SD大鼠分成6组,每组12只。实验分组如下:模型组、生理盐水对照组、假手术组、TFA治疗组(25,50,100 mg/kg)。于模型建立当日开始给予相关药物灌胃(每日给药一次),连续给药15 d。血管性痴呆模型的建立:大鼠给予5%异氟烷吸入麻醉,固定,颈部切开,分离双侧颈总动脉,颈总动脉下方穿2根浸有生理盐水的4号丝线,进行双重结扎并剪断血管保证血液断流。缝合颈部切口,术后肌肉注射青霉素3 d。
1.3.2神经功能评分 脑缺血后第30天,根据改良的Garcia评分系统评估神经系统评分[8],0-3分:自发活动;1-3分:侧抚摸反应;1-3分:触碰振动反应;0-3分:肢体对称性;0-3分:前肢伸展;0-3分:攀爬;0-4分:横木行走能力。以上7个子测验的总分用于评价神经功能。低分表示神经功能较差,高分表示功能较好。
1.3.3Morris水迷宫试验(Morris Water Maze Test, MWM) 神经功能评分测试结束后,MWM检测实验大鼠的学习记忆功能。(1)定位航行试验:MWM包括一个圆形水池(直径150 cm,高度60 cm)和一个平台。水池内注入清水至水深21 cm,水温控制在22~24 ℃,圆形水池划分为4个象限(Ⅰ、Ⅱ、Ⅲ和Ⅳ)。第1天,将大鼠放入池内游泳60 s,并剔除游泳能力差的大鼠。第2天,在第Ⅲ象限放置平台,低于水面约1 cm处,将大鼠分别从4个象限的入水点(从Ⅰ~Ⅳ的顺序)面向池壁放入水中,观察并记录大鼠爬上平台的时间,即逃避潜伏期。如果大鼠在60 s内爬上平台并停留3 s,视为寻台成功。如果在60 s内,大鼠不能找到平台,则将其引至平台并停留15 s以熟悉环境,该逃避潜伏期按60 s记,按顺序进行下一个象限测试。连续训练4 d,每天4次,每次间隔30 s。大鼠在迷宫中的运动通过连接到计算机的视频跟踪系统进行监控。(2)空间探索观察小鼠的学习能力观察小鼠的空间记忆能力:定位航行试验的第5 天撤去平台,将大鼠从第Ⅰ象限入水点处面向池壁放入水中自由游泳,分别记录大鼠在60 s内穿过原平台所在象限的次数、原平台所在象限游程比率和时间比率(即大鼠在原平台所在象限的游程、时间分别占总游程、总时间的比率)。以此来评价动物的空间记忆能力。MWM试验结束,麻醉处死大鼠,取脑组织、取血,收集血清。
1.3.4血清NSE活力检测 MWM试验结束,麻醉处死大鼠,收集血清,转移至96孔板里,按照NSE酶联免疫分析试剂盒(南京建成)说明书,分光光度法检测血清NSE活性。
1.3.5Western blot 将脑组织匀浆,加入细胞裂解液,离心取上清。制作聚丙烯酰胺凝胶,用微量移液枪将蛋白样品或Marker加入凝胶孔内,恒压电泳。裁剪合适大小的PVDF膜,用无水甲醇浸泡,同样裁剪适合大小的滤纸,用转移液浸泡。根据marker指示条带小心切下待测目的蛋白及内参β-肌动蛋白(β-actin)凝胶,与滤纸一同浸泡在转移液中,按照2张滤纸、胶、膜、两张滤纸的顺序叠放好,各层之间重复接触,不能有气泡,滤纸和膜的大小相同,用夹子固定好后放入转移槽中,合上电极,接通电源,200 mA恒流转膜3 h。转膜结束后,取出PVDF 膜,放入封闭液中,室温封闭 1~2 h,封闭结束后TBST洗一遍;分别加入抗ROCK2抗体(1∶1000)或者抗pTau抗体(1∶1000),4 ℃摇床孵育过夜;用TBST洗3次后,加入相应的辣根过氧化物酶(HRP)标记的羊抗鼠IgG(1:5000),室温孵育2 h;TBST洗膜3次,每次10 min,将显影液A和B按1∶1比例混合涂于膜上,用凝胶图像处理系统分析目标条带的光密度值。
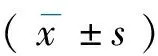
2 结果
2.1TFA对实验性血管性痴呆大鼠的学习记忆损伤的作用
2.1.1Morris水迷宫试验结果 血管性痴呆大鼠造模的第30天,Morris水迷宫试验检测各组大鼠的学习记忆功能改变。训练第1天,各组大鼠寻台潜伏期相似,无显著性差异(P>0.05)。训练第2天,虽然潜伏期减少,但各组之间仍无显著差异(P>0.05)。训练第3~4 天,模型组与假手术的潜伏期出现显著差异(P<0.01);与模型组相比,TFA(50,100 mg/kg)治疗组大鼠的寻台潜伏期明显缩短(P<0.05或0.01),但是25 mg/kg TFA对大鼠寻台潜伏期的影响不明显(P>0.05),表明(50,100 mg/kg)TFA对血管性痴呆大鼠的学习损伤有明显保护作用。见图1。

图1 TFA对血管性痴呆大鼠学习记忆功能的影响
2.1.2空间探索实验结果 训练第5 天进行空间探索实验。模型组大鼠的穿过原平台象限次数,时间及游程比率与假手术组相比均明显减少(P<0.01);与模型组相比,TFA(50,100 mg/kg)组大鼠穿过原平台象限次数,时间及游程比率明显增多(P<0.01),进一步表明黄芪总黄酮对血管性痴呆大鼠的记忆损伤有保护作用。见表1。
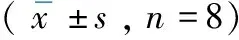
表1 TFA对血管痴呆模型大鼠空间探索能力的影响
2.2TFA对大鼠神经功能评分和血清NSE活性的影响 脑缺血30 d后,模型组与假手术组比较神经功能评分明显降低(P<0.01);给予50,100 mg/kg TFA治疗可明显提高大鼠神经功能评分(P<0.01)。与假手术组相比,模型组大鼠血清中NSE活性明显增高(P<0.01),提示脑缺血后神经损伤;与模型组比较,TFA50,100 mg/kg治疗组大鼠血清中NSE活性明显降低(P<0.01),进一步提示TFA具有神经保护作用。见图2。

图2 TFA对大鼠神经功能评分(A)和血清NSE活力(B)的影响
2.3TFA对大鼠脑组织中ROCK2表达和Tau Ser262磷酸化的影响 Western blot检测海马CA1区的脑组织中ROCK2表达和Tau Ser262位点磷酸化改变:模型组ROCK2表达和Tau Ser262位点磷酸化与假手术组比较明显增高(P<0.01);与模型组比较,TFA(25,50,100 mg/kg)可以明显下调ROCK2表达和Tau Ser262位点磷酸化(P<0.01)。见图3。

图3 TFA对大鼠海马CA1脑组织内ROCK2表达和Tau Ser262磷酸化的影响
3 讨论
VD是由脑组织低灌注或脑血管疾病引起脑功能障碍而导致的严重认知功能衰退综合征。随着研究的深入,VD被证实是可预防、可治疗的痴呆。但目前仍缺乏有效干预药物[9]。因此,VD研究的首要任务是探索神经保护策略,并为临床应用寻找新的药物。
中草药被认为是具有多靶点、多层次、多环节作用的特点,具有广阔的应用前景[10]。几千年来,人们发现中药被用于治疗各种疾病[11]。前期研究发现,一些植物源性天然活性成分具有抗蛛网膜下腔出血后脑损伤作用[12]。TFA是从黄芪干燥根中提取的有效部位,前期研究发现TFA通过调节巨噬细胞中细胞因子和介质肿瘤坏死因子(TNF-α)、白细胞介素(IL)-1β、IL-6、一氧化氮(NO)的产生,具有显著的免疫调节和抗炎作用[13]。本研究运用双侧颈总动脉结扎构建大鼠血管性痴呆模型,观察TFA对VD大鼠的学习记忆损伤影响,发现50和100 mg/kg TFA可逆转VD大鼠的学习记忆障碍。
tau是微管相关蛋白(microtubule associated protein, MAP)之一[14],存在于胞质和轴突中。tau蛋白促进微管形成和维持微管结构,维持轴突的营养物质和代谢产物的运输,为轴突延伸生长创造条件[15]。过度磷酸化修饰的tau与微管结合能力会明显降低,影响微管的稳定性,其中Ser262、Ser356 过度磷酸化直接影响 tau 蛋白与微管结合,最终使微管解聚[16]。从微管上脱落下来的过度磷酸化tau蛋白彼此相互聚集成双螺旋细丝形成神经纤维缠结(neurofibrillar tangles, NFTs),损害神经元的形态和功能。本研究运用Western blot检测VD模型大鼠海马CA1区的脑组织内tau蛋白Ser262磷酸化改变,发现模型组tau Ser262磷酸化(pTau)明显上调(与假手术组比,P<0.01),而黄芪总黄酮(50,100 mg/kg)可以明显下调pTau。
tau蛋白磷酸化水平受蛋白激酶的磷酸化作用和蛋白磷酸酯酶(protein phosphatases, PPs)的去磷酸化作用共同调节。Rho相关卷曲螺旋激酶(Rho associated coiled coil-forming kinase, ROCK)是细胞内广泛存在的Ser/Thr蛋白激酶,包括ROCK1和ROCK2亚型。ROCK的功能改变在中风的病理过程中发挥重要的作用,局灶性(大鼠)脑缺血模型可见缺血脑组织ROCK表达呈2倍以上的增加,而给予非选择性ROCK抑制剂处理,脑缺血急性期损伤明显减轻,并且能促进缺血损伤后神经功能的恢复[17-19]。虽然ROCK在各种组织细胞内均有表达,但是在脑组织中ROCK2表达更为丰富,siRNA干扰ROCK2的表达,可以明显减轻轴突的退化,促进轴突再生[20]。局灶性脑缺血模型实验动物的学习和记忆损伤与ROCK2表达上调有关[21-22]。由此可见,ROCK2可作为中枢损伤及退行性神经系统疾病研究的主要靶点[23]。本研究运用Western blot法检测海马CA1区的脑组织内ROCK2表达,并发现TFA(50,100 mg/kg)可逆转VD大鼠海马组织中ROCK2表达增高,提示TFA抗血管性痴呆大鼠学习记忆损伤与下调ROCK2表达有关。
综上所述,黄芪总黄酮可明显改善血管性痴呆大鼠的学习记忆损伤,其机制可能与抑制ROCK2表达和下调tau磷酸化有关。
