紫苏智能排湿干燥过程的干燥动力学及品质变化规律研究
2022-08-16曹崇江李竹心黄德春
曾 岩,曹崇江,,李竹心,黄德春,乐 龙
(1.中国药科大学工学院,国家中药材加工加工技术研发专业中心,江苏南京 211198;2.中国药科大学工学院,制药工程教研室,江苏南京 211198)
唇形科植物紫苏(Perilla frutescens(L.)Britt.)是传统的药食同源中药材,其干燥的茎、叶及果实均可入药。传统中医认为紫苏味辛、性温,归肺脾经。紫苏具有解表散寒、行气和胃等功效,可用于风寒感冒、妊娠呕吐、解蟹毒鱼毒等[1]。现代研究证明紫苏还具有镇静、抗抑郁、调节代谢等多种药理活性[2-3]。紫苏作为药食同源中药材,其鲜香扑鼻的独特风味也让其成为一种饮食调味品,常用于肉类食材的烹制。挥发油是紫苏中最主要的活性成分,也是紫苏独特风味的来源,其中包括紫苏酮、紫苏醛、柠檬烯等风味物质[4]。此外,紫苏还含有多种必需脂肪酸、黄酮类、酚酸类及花色素等丰富的化学成分[5]。
紫苏在我国分布广泛,主要产于山东、江苏及浙江等地[6]。一般紫苏叶及紫苏茎在夏季采收,紫苏子在秋季采收,目前紫苏采后多制成干燥品以便长时间保藏,以自然阴干为主要的干燥方式,此外也有少部分会使用烘干、冻干等现代干燥工艺。但是干燥过程中紫苏的品质容易发生变化,如挥发油、黄酮类及酚酸类等物质受环境因素影响较大[7],自然干燥难以对温度、湿度等条件进行精准控制,此外还容易造成药材染菌或引入杂质而影响其品质。刘佳陇等[8]研究了不同干燥方式下紫苏梗中迷迭香酸的差异,结果表明自然阴干条件下迷迭香酸损失量最少。毛祈萍等[9]基于UHPLC-Q/TOF-MS 的方法分析鉴定了紫苏的化学成分,紫苏经过阴干和冷冻干燥处理后成分会发生变化,且紫苏阴干及冷冻干燥两种不同处理方式鉴别出成分也存在差异。烘干是目前较为常用的一种干燥方式,由于其具有操作简单、干燥效率高、投资成本少等优点,因而适用于大面积生产,在紫苏初加工方面具有应用的潜力[10]。冷冻干燥虽然可以较大程度地保持药材品质,但设备昂贵,耗能较高[11]。干燥是一个复杂的过程,但是可以通过数学模型来描述干燥行为,并优化干燥参数。薄层干燥模型可用于干燥时间预测,并概括干燥曲线。常用的薄层干燥模型有:Newton 模型、Page 模型、Henderson and Pabis 模型、logarithmic 模型及Wang and Singh模型等[12-13]。Goyal 等[14]用六种薄层干燥模型描述了李子切片后的干燥过程,结果显示logarithmic 模型的拟合结果最好,具有较高的R2值。
本课题组先前研制的干燥装置会在干燥过程中实时监控干燥介质的湿度,在保证恒定风速的同时,通过冷凝的方式除去介质中的水汽,以此种干燥方法可以一定程度减少干燥过程中的能耗。本研究使用自研的智能除湿烘干装置在不同温度下对紫苏茎叶分别进行干燥处理,并用不同的薄层干燥模型对干燥过程进行动力学分析,明确其干燥特性与过程。为了反映不同温度干燥处理后紫苏的品质,本文以自然阴干处理和冻干处理的紫苏茎叶为对照,借助HPLC、电子鼻等手段表征紫苏茎、叶的品质变化,以期为紫苏采后干燥处理提供理论支持。
1 材料与方法
1.1 材料与仪器
新鲜紫苏 购于上海老一生鲜有限公司,经中国药科大学国家中药材加工技术研发专业中心鉴定为唇形科植物紫苏(Perilla frutescens(L.)Britt.)的新鲜茎叶;迷迭香酸 色谱纯,上海阿拉丁生化科技有限公司;芦丁、没食子酸、ABTS、DPPH 色谱纯,上海源叶生物科技有限公司;甲醇、丙酮 色谱纯,美国天地有限公司;其余试剂均为国产分析纯。
5HY-32A0 型恒温除湿干燥箱 自研,如图1所示;FreeZone 2.5 L 冷冻干燥机器 美国Labconco公司;UltiMate 3000 超高效液相色谱仪、Multiskan GO 酶标仪 美国ThermoFisher 公司;Heracles II 型电子鼻 法国Alpha MOS 公司。
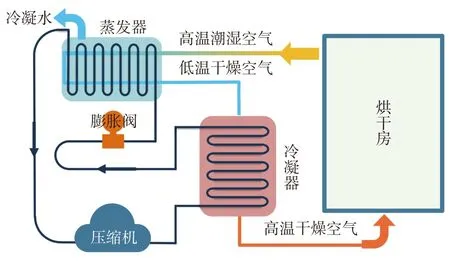
图1 干燥装置图Fig.1 Drying device diagram
1.2 实验方法
1.2.1 紫苏前处理 将新鲜紫苏清洗并晾干表面水分,后将紫苏茎与紫苏叶分开。选择叶片完好,大小相似的紫苏叶备用。选取粗细相当的紫苏茎并切分成长度均为5 cm 的短杆备用。
1.2.2 紫苏样本干燥处理 紫苏叶和紫苏茎分开测定,每次实验所用样本量均为500 g。将待测物料均匀摊放在智能除湿干燥箱的置物架上,分别于50、60、70、80 ℃的温度条件下以恒定风速(25 m/s)进行干燥处理,实时监控介质空气相对湿度,定期排湿保持介质相对湿度≤17%。干燥过程中以适宜的时间间隔定期记录物料的重量变化,直至物料接近恒重时停止实验。
此外将500 g 的紫苏茎叶用冻干及自然阴干的方式干燥。冻干方法:冻干机冷阱提前预冷至-60 ℃以下,将500 g 紫苏茎叶先放置于-80 ℃冰箱预冻2 h 后快速转移至冻干机的置物架上,开启真空泵,保持真空度≤0.2 MBar 干燥24 h。阴干方法:将紫苏茎叶平铺在阴凉通风的室内,室温(约25 ℃)阴干2~3d。
干燥后的样本按照中国药典2015 版通则0832水分测定法第二法测定其含水量。另按照与上述实验相同的干燥条件干燥用于测试表征的紫苏茎及紫苏叶,将所有用于后续实验的样本密封置于-20 ℃冰箱保存。
1.2.3 干燥动力学数据处理 干燥动力学计算参考Zhao 等[15]的方法,干基含水率(Dry Basis Moisture content,X)以公式(1)计算:

式中,mt、md分别代表干燥过程中任意时间的物料重量(g)、绝对干燥的物料重量(g)。
水分比(Moisture ratio,MR)以公式(2)计算:

式中,X0、X、Xe分别代表初始状态物料、干燥过程中任意时刻物料及干燥平衡时物料的干基含水率,在整个干燥过程中Xe值都远小于X0及X,可将其忽略不计,则公式(2)可简化为式(3):

干燥速率(Drying rate,DR)以公式(4)计算:

即求任意时刻干基含水量对时间的微分。
本实验采用四个较为典型的薄层干燥模型(见表1)对干燥数据进行曲线拟合以筛选较为合适的干燥模型来描述紫苏的干燥过程。数据拟合的结果中决定系数R2是评判模型优劣最主要的标准之一,此外,各种统计学参数也可以作为评判依据,如:简化卡方(reduce chi-square,χ2)、均方根误差(root mean square error,RMSE)。χ2和RMSE 按公式(5)、(6)计算:

表1 描述干燥过程的理论模型Table 1 Mathematical models to describe the drying process
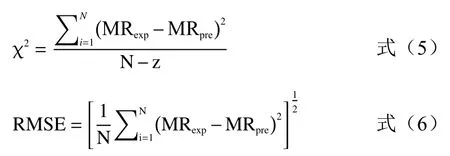
式中,N 为一组数据中的样本数量;z 为公式中干燥常数的数量;MRexp、MRpre分别为实测值及拟合值。
1.2.4 干燥紫苏品质分析
1.2.4.1 紫苏叶中挥发油含量测定 挥发油是紫苏叶中的主要活性成分,按中国药典2015 版[1]通则2204 挥发油测定法甲法测定1.2.2 步中各紫苏叶样品的挥发油含量(mL 挥发油/g 干燥紫苏)。
1.2.4.2 紫苏茎中迷迭香酸含量测定 参照药典[1]方法以高效液相色谱法测定迷迭香酸的含量,取1.2.2 步中紫苏茎样品各0.5 g,精密称量,置于具塞锥形瓶中,精密加入60%丙酮25 mL,密塞并称重,超声(250 W,40 kHz)提取30 min,用60%丙酮补足失重,摇匀,滤过,取续滤液过0.22 μm 滤膜即得到供试品溶液。取迷迭香酸标准品,精密称定,用60%丙酮制成0.05 mg/mL 迷迭香酸对照品溶液,标准曲线:y=39849.0774x+1.0905,R2=0.9999。
高效液相色谱色谱条件:Agilent Zorbax SB-Ag C18(4.6 mm×250 mm,5 μm)色谱柱,流动相:甲醇-0.2%甲酸水溶液(34:66)等度洗脱,流速1 mL/min,柱温30 ℃,紫外检测波长330 nm,进样量10 μL。通过保留时间定性判定,以外标法定量计算迷迭香酸的含量(mg 迷迭香酸/g 干燥紫苏)。
1.2.4.3 总黄酮及总酚含量测定 提取液制备:取1.2.2 步中各紫苏茎、叶样品0.2 g,精密称量。首先置于索氏提取器中,加石油醚100 mL,回流1 h 左右脱脂脱色。回流结束,弃去石油醚将药渣挥干后置于50 mL 具塞锥形瓶,加60%乙醇溶液10 mL,超声(250 W,40 kHz)提取30 min,将提取液转入25 mL容量瓶,重复上述操作再次提取后合并提取液并用60%乙醇定容即得紫苏提取液,置于4 ℃冰箱贮藏待测。
总黄酮含量(mg 黄酮/g 干燥紫苏)测定法:参照Xie 等[19]的方法,向2 mL 紫苏提取液中加入200 μL 5% NaNO2,避光反应片刻后加入200 μL 10% Al(NO3)3,再避光反应5 min,最后加入600 μL 1% NaOH,避光反应20 min 后以40%乙醇为空白对照测定反应液在510 nm 波长处的吸光度。以芦丁作为标准品,配制1 mg/mL 的芦丁标准溶液,梯度稀释后测定并绘制标准曲线:y=2.3597x+0.0014,R2=0.9999。
总酚含量(mg 总酚/g 干燥紫苏)测定:参照Cheng等[20]的方法,向1 mL 紫苏提取液中加入1 mL 福林-酚试剂,反应片刻后加入2 mL 1% Na2CO3溶液,40 ℃避光孵育30 min 后以15%乙醇为空白对照测定765 nm 波长处的吸光度。以没食子酸为标准品,配置2 mg/mL 的没食子酸标准溶液,梯度稀释后测定并绘制标准曲线:y=7.7828x+0.0077,R2=0.9999。
1.2.4.4 抗氧化能力测定 抗氧化实验参照Chen 等[21]的方法。1,1-二苯基-2-三硝基苯肼(DPPH·)自由基清除率测定:DPPH 用60%乙醇配制成5×10-4mol/L的溶液,向1 mL 上述紫苏提取液中加入2 mL DPPH溶液,静置避光反应20 min 后测量波长517 nm 下的吸光度At,以60%乙醇作为空白对照测量吸光度A0。依公式(7)计算DPPH·清除率:
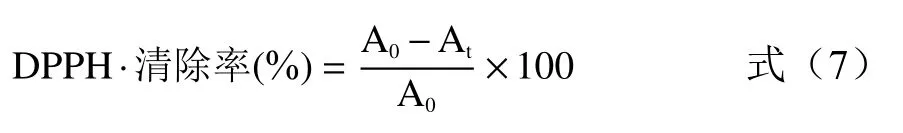
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(ABTS)自由基清除率测定:称量0.05 g ABTS 用少量60%乙醇溶解后,加入10 mL 1 mg/mL 的K2S2O8溶液,避光静置反应12 h 后用60%乙醇稀释至工作液在波长734 nm 处的吸光度为0.70±0.02。向1 mL 紫苏提取液中加入ABTS 工作液5 mL,静置避光反应20 min 后测量波长734 nm 处的吸光度At,以60%乙醇作为空白对照测量吸光度A0。依公式(7)计算ABTS+自由基清除率:
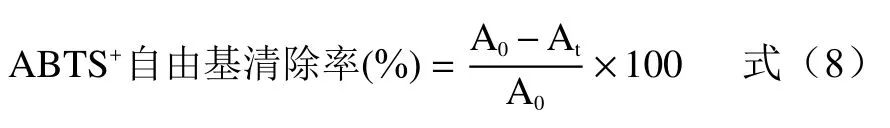
总还原能力测定:采用普鲁士蓝法测定紫苏提取液总还原能力。向2 mL 紫苏提取液中加入2 mL 2x pH6.6 PBS 及2 mL 1% K3[Fe(CN)6]溶液,37℃孵育20 min 后再加入2 mL 10%三氯乙酸和0.5 mL 0.1% FeCl3溶液,避光反应5 min 后测定其在波长700 nm 下的吸光度,此结果的吸光度越高,待测样的还原力越强。
1.2.4.5 电子鼻气味分析 挥发性气味是紫苏叶作为调味品的重要特征,对于不同干燥温度下的紫苏叶样本,用Heracles II 型超快速气相电子鼻对其进行挥发性风味物质分析。实验及分析方法参照D’Alessandro 等[22]的方法,在20 mL 的顶空进样瓶中装入0.5 g 样品,并用聚四氟乙烯表面的硅橡胶帽密封。孵化温度40℃、捕集温度40 ℃、进样量5000 μL、采集时间14.8 min、初始炉温50 ℃、初始温线20,其余条件为系统预设。
1.3 数据处理
使用Excel 2019、Origin 2019b 进行数据处理及绘图,统计学分析使用IMB SPSS Statistics 23,电子鼻气味分析使用Alphasoft v16.0,风味物质信息来自于AroChemBase 数据库(Alpha M.O.S,Toulouse,France)。
2 结果与分析
2.1 紫苏干燥特性及其干燥动力学分析
干燥曲线即物料的平均干基湿度与干燥时间的关系曲线,它反映物料在干燥过程中平均干基湿度随干燥时间变化的关系。如图2 所示,是紫苏叶(图2a)及紫苏茎(图2b)在不同干燥温度下其干基含水率的变化。总体趋势表明,在50~80 ℃的温度区间内,温度越高则物料含水率降低到目标值所需的时间越快。由于紫苏叶叶片薄,有效干燥面积更大,因此相较于紫苏茎所需的干燥时间更短。对于紫苏叶和紫苏茎,提高干燥温度(80 ℃)相较于低温干燥(50 ℃)耗时分别降低了67.53%、80.64%。
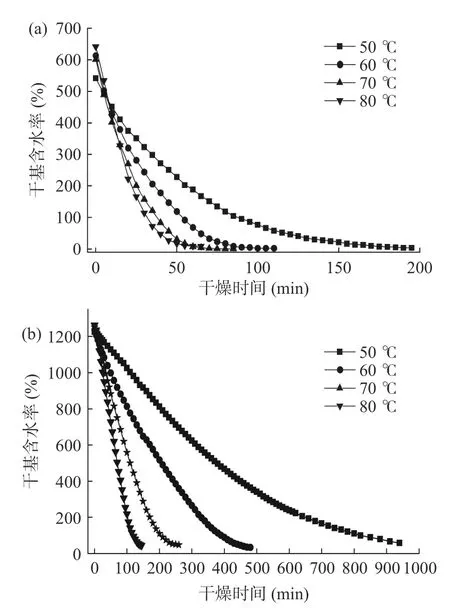
图2 不同干燥温度下物料的干基含水率曲线Fig.2 Dry basis moisture content curves of materials at different temperatures
典型的干燥过程分为三个阶段,即提速干燥阶段、恒速干燥阶段及降速干燥阶段三个过程。图3反映了不同干燥温度下紫苏叶及紫苏茎的干燥速率变化,在干基含水率相同的情况下,温度越高则干燥速率越快,这一点与前文所述干燥时间的变化相匹配。关于物料的干燥特性,图3a 是紫苏叶的干燥速率曲线,在温度为50、60、70 ℃时,整个干燥过程中干燥速率总体都呈现明显下降的趋势,且干基含水率越高干燥速率越快,处于降速干燥阶段。而温度为80 ℃时,前期为恒速干燥阶段,当干基含水率降至223%时干燥速率开始明显下降,而后是降速干燥阶段。由于紫苏叶的厚度很薄,传热效率高,因此加速干燥阶段历时很短而难以被观测到,表观上以降速干燥阶段为主,Bensebia 等[23]在研究迷迭香叶片干燥过程时也得到类似的结论。图3b 是紫苏茎的干燥速率曲线,在温度为70 和80 ℃时可以明显观测到加速干燥阶段的存在。在80 ℃条件下,干基含水率在1150%~280%之间为恒速干燥阶段,之后转变为降速阶段。70 ℃条件下,干基含水率在1150%~240%之间呈幅度较小的降速干燥阶段,而后的干燥速率则急剧下降。对于较低的温度(50、60 ℃)条件,整个干燥过程以降速干燥为主,且干燥速率降低的趋势较为平缓。在干燥过程的初期,以物料表层的水分蒸发为主,同时热量由外向内传递,随着干燥时间的增长与物料温度的提高,植物细胞死亡后细胞膜细胞壁失去活性,水分活度大、水分快速蒸发。当物料内部水分扩散速率与水分蒸发速率达到平衡时,物料进入恒速干燥阶段[24-25]。当水分含量降低到一定值后水分活度下降、有效水分扩散率降低,干燥速率开始逐渐降低[26]。
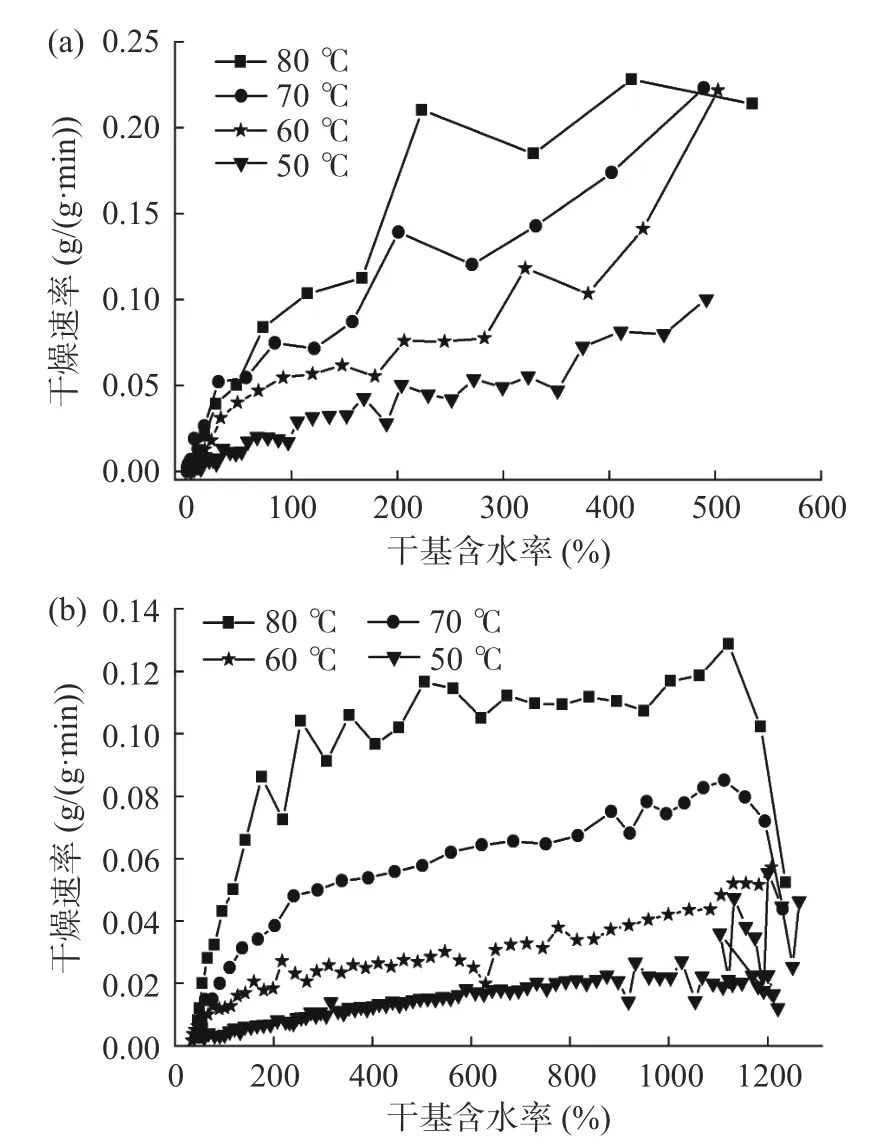
图3 不同温度下物料的的干燥速率曲线Fig.3 Drying rates curves of materials at different temperatures
紫苏叶及紫苏茎在外形及内部结构上的不同决定了二者不同的干燥特性,为了更直观地描述这种变化,表2 及表3 给出了不同薄层干燥模型对实测数据拟合的结果:可以看出,表中所示的四种模型对干燥数据拟合得到的R2值均在0.99 左右,因此这些薄层干燥模型都可以用于描述紫苏的干燥过程。对于紫苏叶,Two-term 模型相较于其他模型在各个温度条件下的R2值(0.9981~0.9996)最高,χ2值(0.000022~0.000105)及RMSE 值(0.0045~0.0084)均最小。对于紫苏茎,Page 相较于其他模型在各个温度条件下的R2值最高(0.9963~0.9997),χ2(0.000114~0.000199)及RMSE 值(0.0044~0.0295)均最小。综上所述,可见在本文所选择的四个薄层干燥模型中,Two-term模型更适合用于描述紫苏叶的干燥过程,而Page 模型更适合用于描述紫苏茎的干燥过程。
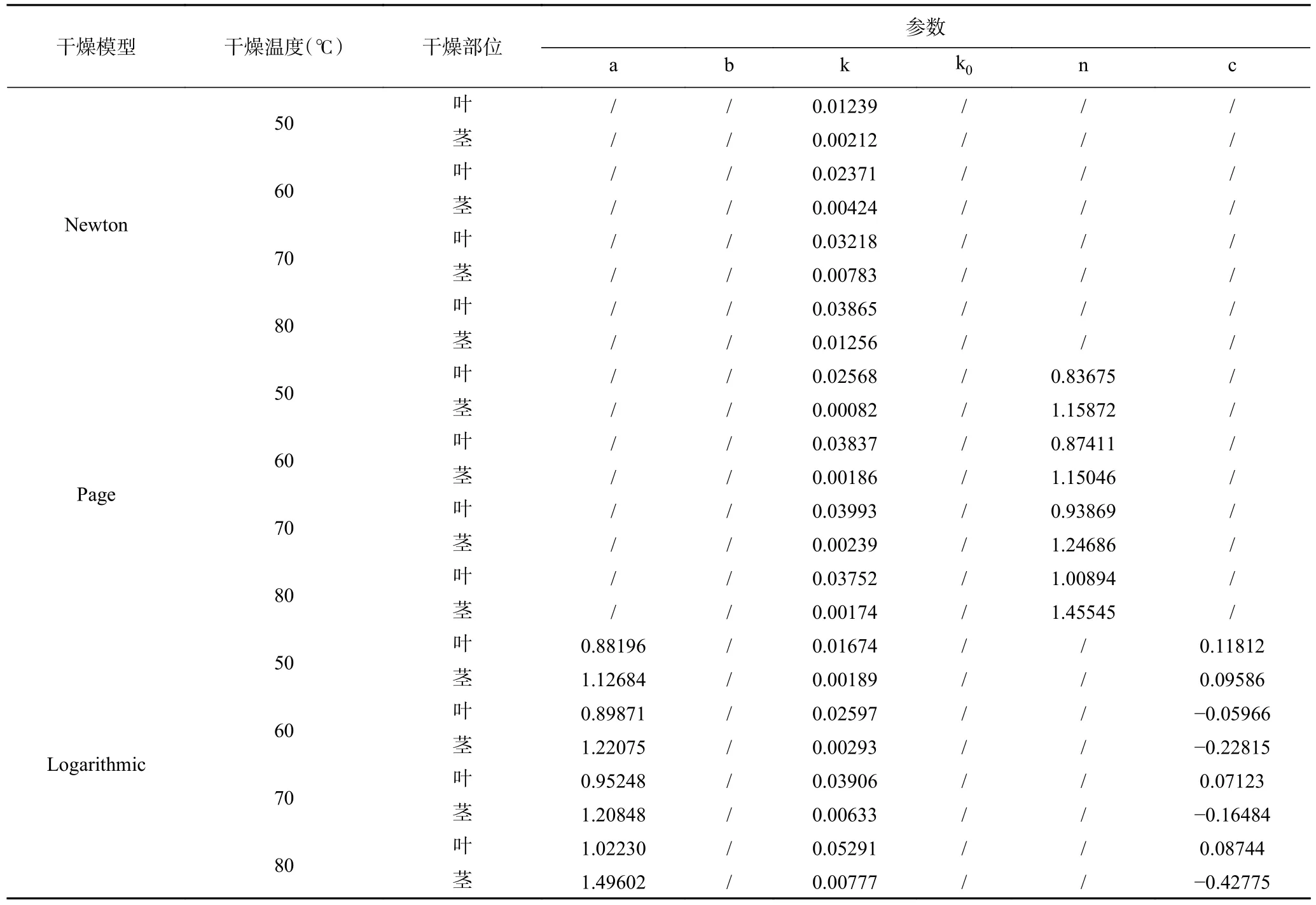
表2 薄层干燥模型拟合结果Table 2 Fitting results of thin layer drying model
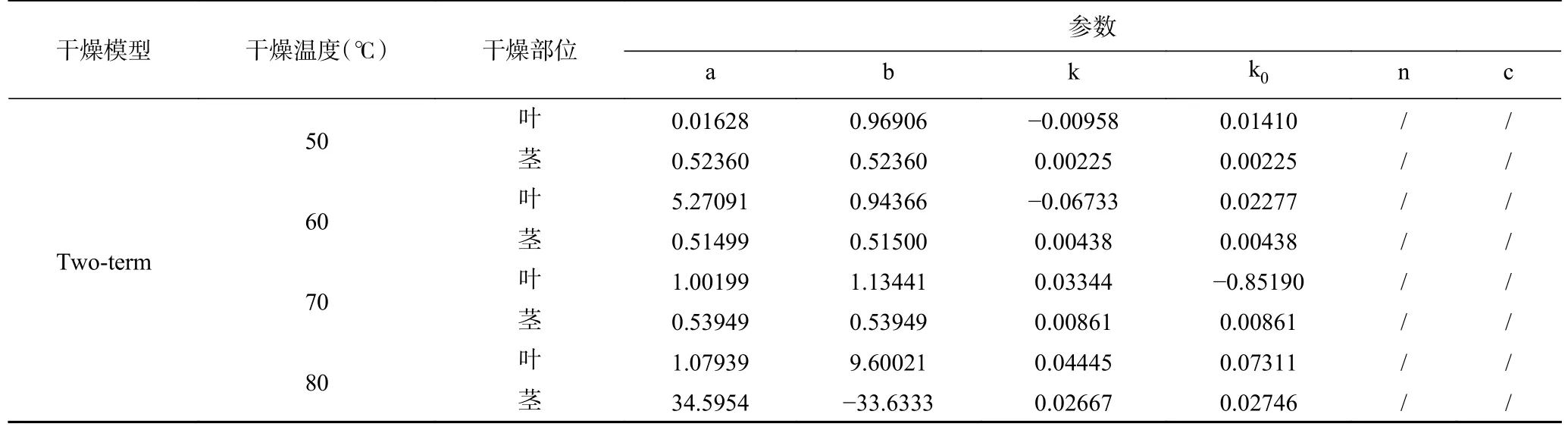
续表2
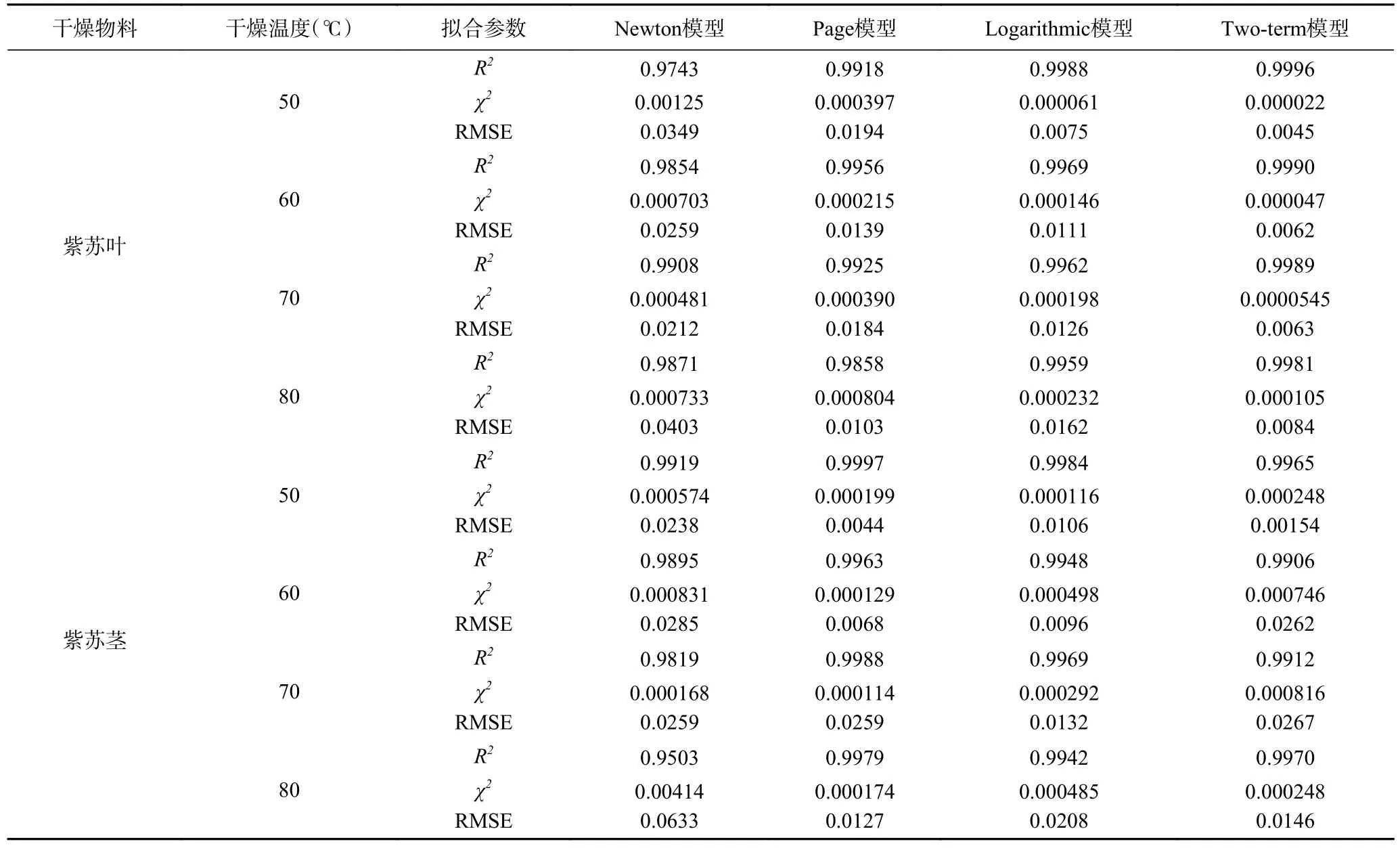
表3 薄层干燥模型拟合的统计学结果Table 3 Results of statistical analysis on the thin layer drying
2.2 不同干燥条件下紫苏品质特性变化规律分析
2.2.1 不同干燥条件下紫苏的活性成分对比 2015版中国药典中规定以挥发油含量(>0.004 mL/g)为紫苏叶的质量标准,迷迭香酸含量(>1 mg/g)为紫苏茎的质量标准。由图4 可知,常温阴干、冷冻干燥以及温度在50~70 ℃间的干燥得到的干燥紫苏均能满足药典标准,其中冻干品不论是紫苏叶还是紫苏茎的活性成分含量均为最高(紫苏叶中挥发油含量为0.0190 mL/g,紫苏茎中迷迭香酸含量为14.90 mg/g),50 ℃干燥品在智能排湿干燥组中活性成分含量最高(紫苏叶中挥发油含量为0.0147 mL/g,紫苏茎中迷迭香酸含量为7.57 mg/g)。对于紫苏叶,干燥温度等因素对其挥发油含量影响较大,不同干燥条件下的挥发油含量均有显著性差异(P<0.05),但是低温烘干(50 ℃)的紫苏叶的挥发油含量较传统的阴干品相比反而较高,虽然在自然阴干的条件下紫苏始终处于较低的温度环境,但是相比加热烘干及冻干等条件此过程不仅历时久而且细胞代谢与呼吸也更为活跃,因此反而会造成活性成分的代谢损失[27]。温度对紫苏茎中迷迭香酸含量存在一定影响,50 ℃条件下得到的干燥紫苏茎中迷迭香酸含量与阴干品相比无显著性差异(P>0.05),但总体趋势为温度越高,活性成分含量越低。迷迭香酸与挥发油都是对温度较为敏感的物质,在干燥过程中极易因温度的提高而被降解或挥发损失,程嘉莉等[28]在对红花玉兰干燥特性的研究中也得到了相同的结论。
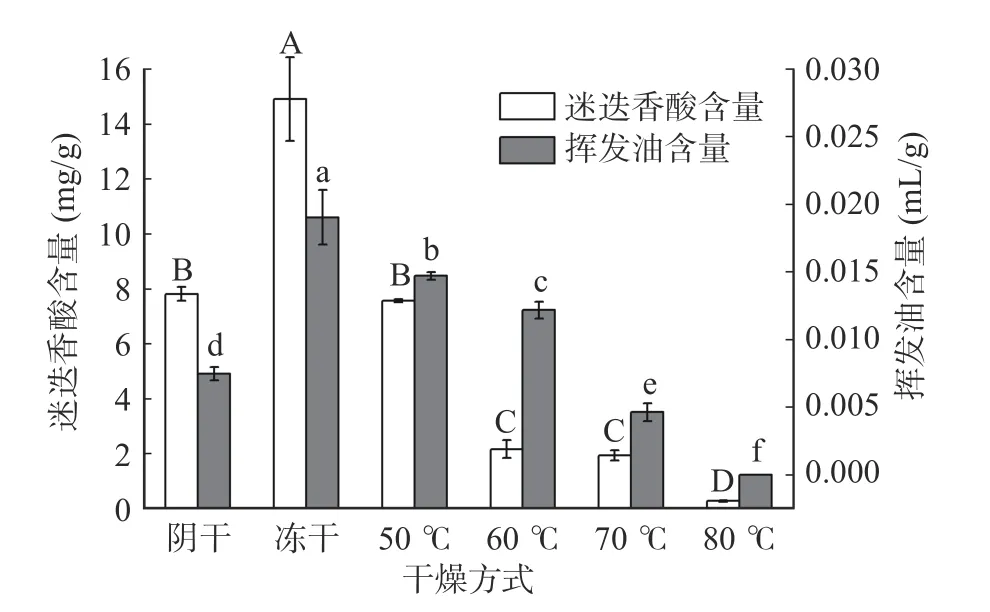
图4 不同干燥条件下活性成分含量对比Fig.4 Comparison of active components in Perilla at different drying conditions
总黄酮和总酚广泛存在于多种植物中,也是一些中药材的主要活性来源。图5 所示是不同干燥条件下紫苏中总黄酮及总酚的变化情况。对于紫苏叶,冷冻干燥、自然阴干及50 ℃干燥三种条件下总酚含量无显著性差异(P>0.05),总黄酮含量虽有差异,但不甚明显。当温度提高至60 ℃后总酚及总黄酮含量明显下降。对于紫苏茎,冷冻干燥品的总酚及总黄酮含量均最高;其次为自然阴干品及50 ℃干燥品,且二者无显著性差异(P>0.05),当温度提高至60 ℃后,总酚及总黄酮含量明显下降。
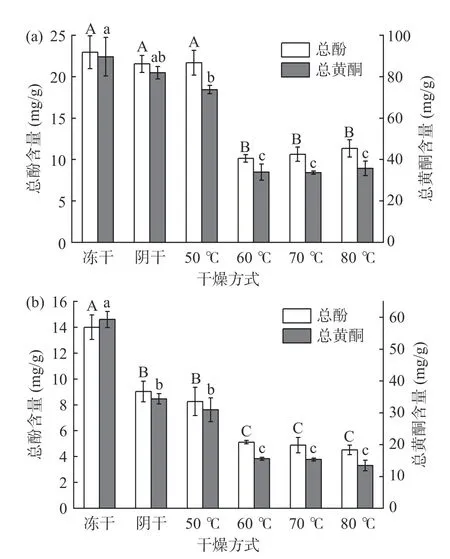
图5 不同干燥条件下紫苏中总黄酮及总酚含量变化Fig.5 Comparison of total flavonoids and phenolic contents in Perilla at different drying conditions
已有研究指出,低温干燥有利于保留植物中活性成分,此外较快的干燥速度也能更小程度的减少加工处理中活性成分的流失[29],本研究的结果同样表明低温干燥更有利于保留中药材中的活性成分。值得关注的是,常温阴干品的活性成分含量有时稍低于50 ℃干燥组,可能是因为自然干燥过程水分流失速度慢,在持续漫长的干燥过程中,黄酮及酚类等多数活性成分都会有不同程度的氧化或参与细胞代谢被消耗,这些原因都可能导致了活性成分的降低[30-31]。许多研究指出高于50 ℃的干燥条件相较于低温干燥,植物内黄酮等成分的含量一般无显著性差异,也会出现温度升高,黄酮含量少量增加的情况,这也与本研究的结果相吻合,一种可能是干燥前期在细胞还保留活性的时候可能仍有部分活性物质生产,这与干燥后期高温造成的损耗相互抵消,还有一种可能是高温条件下快速灭酶,在细胞凋亡后活性成分不会被酶解破坏[32]。
2.2.2 不同干燥方式下紫苏的抗氧化活性 紫苏具有极强的抗氧化作用,其中所含的迷迭香酸及黄酮、酚类都是优良的抗氧化剂[33],观测干燥对抗氧化性能的影响能侧面反映紫苏的品质变化。试验过程中发现紫苏叶及紫苏茎对DPPH 自由基及ABTS+自由基均有清除作用及一定的还原能力(表4),冻干品的还原能力及自由基清除能力最优,其次是阴干品,智能排湿干燥组均不及冻干品及阴干品。在智能排湿干燥的各个温度条件下,50 ℃的自由基清除能力及还原能力最强,随温度的提高有所降低,温度为80 ℃时,自由基清除能力又有所回升(低于50 ℃但高于60 ℃),干燥过程中的美拉德反应及褐变等因素发生的复杂物质变化也可能影响抗氧化能力[34-35],因此抗氧化性能随温度的异常升高可能与美拉德反应产物积累有关。
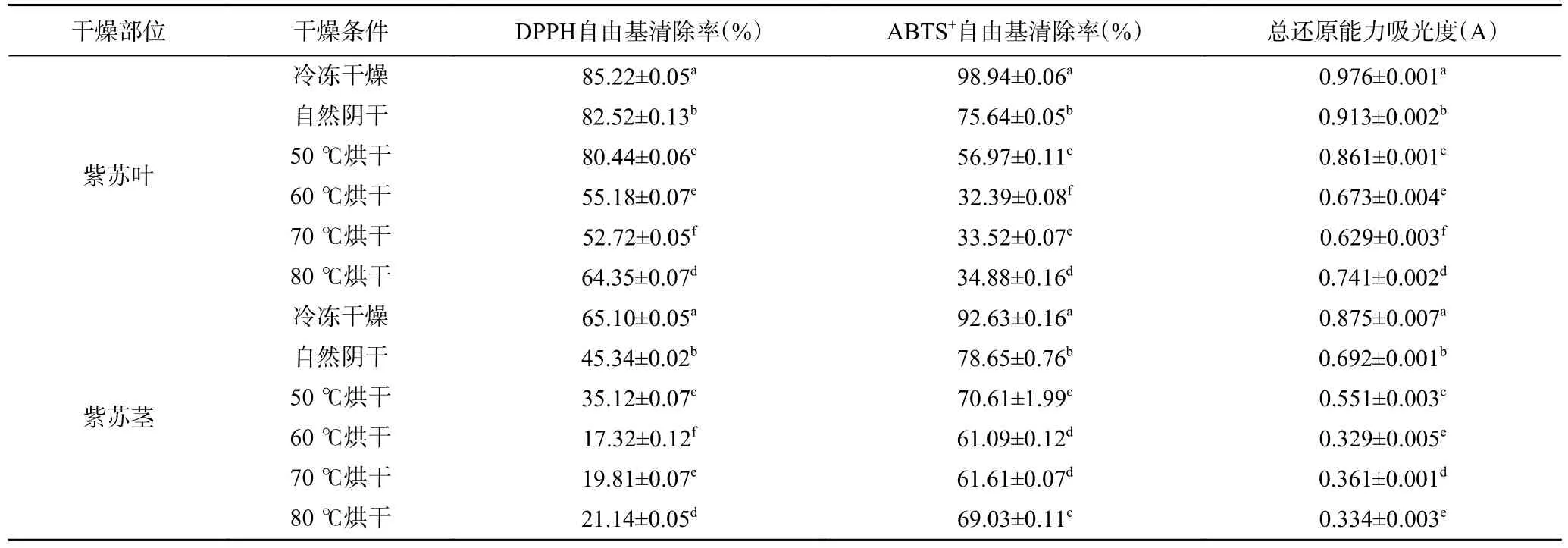
表4 不同干燥条件下紫苏的抗氧化活性Table 4 Antioxidant activity of Perilla under different drying conditions
2.2.3 不同干燥方式的紫苏电子鼻风味分析 紫苏叶作为一种调味品含有丰富的挥发性气味物质,其风味物质的变化值得关注,本文对不同干燥条件下的紫苏叶进行了电子鼻风味分析。基于电子鼻记录的风味物质信息做出图6 所示的主成分分析图,其中PC1 贡献率为63.2%、PC2 贡献率为27.9%,累计贡献率为91.1%。冻干品、阴干品及50 ℃干燥品之间的置信区间无重叠,三者可以较好地区分开。而剩余三个温度条件下的紫苏气味信息有部分重叠,说明三者的主要气味信息差异较小。总体来看,冻干品的气味信息与其他干燥品相比较差异更显著,而阴干品与智能排湿干燥品的气味主成分相似,含量上有一定差异。表5 反映了各个温度条件下紫苏叶的具体气味信息。
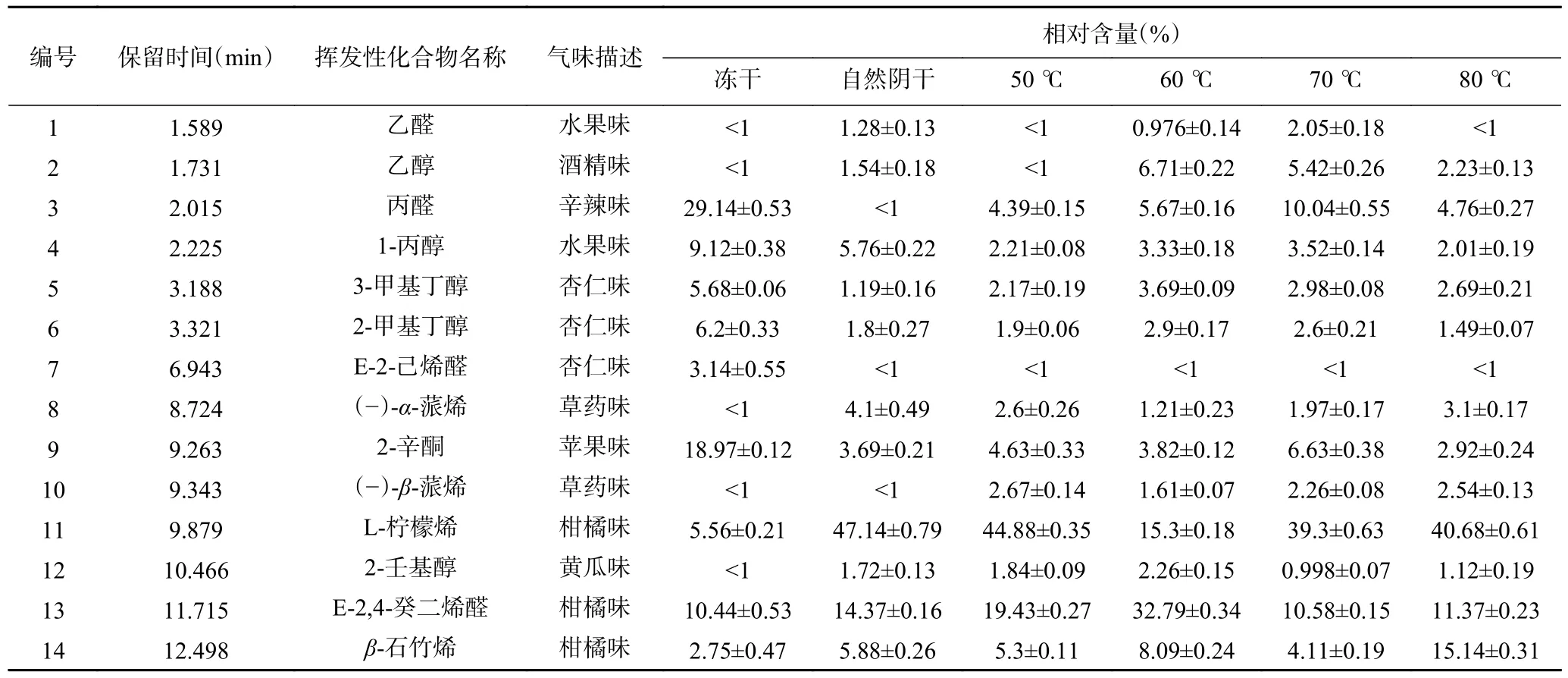
表5 不同干燥条件下紫苏的挥发性风味物质分析Table 5 Analysis of volatile flavor compounds of Perilla under different drying conditions
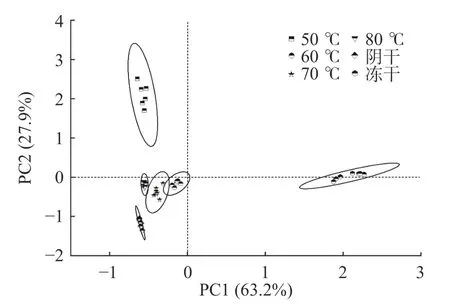
图6 不同干燥条件下紫苏的气味PCA 图Fig.6 PCA of Perilla under different drying conditions
通过Heracles II 型电子鼻给出的色谱峰信息,计算筛选出相对峰面积在1%以上的色谱峰并将实测峰的Kovats 保留指数与Arochem Base 数据库比对,判定其可能的化学成分,判定结果与和Ha 等[36]的报导基本一致。结合图7 的色谱峰分布及其响应值可以看出冻干品中各类气味物质均有较高的相应值,说明其保留了较多风味物质,而其他干燥方式所得紫苏叶的响应值均有所下降,说明在干燥过程中损失了部分风味物质。在冻干品中,丙醛、1-丙醇、3-甲基丁醇、2-甲基丁醇、2-辛酮、L-柠檬烯及E-2,4-癸二烯醛等物质均在较高的响应值水平。而对于其他干燥条件下的紫苏叶,丙醛、1-丙醇、3-甲基丁醇、2-甲基丁醇、2-辛酮等物质相对含量明显降低,L-柠檬烯等物质相对含量提高,实际上从响应值可以看出多数风味物质成分含量是有所下降的。但是在干燥过程中可能发生的氧化反应等物质变化导致了这些物质的生成与转化[37],如50 ℃干燥品的L-柠檬烯的响应值较其他组别更高,60 ℃干燥品的E-2,4-癸二烯醛较其他组更高。对比所有干燥条件,可以看出,干燥温度对醇类物质及醛类物质的含量及丰度有较大程度的影响,在高温下,脂肪酸氧化、美拉德反应等复杂的热诱导化学反应促进了这一现象的发生,而醇、醛类等化合物多为脂肪氧化产物,这些挥发性风味物质变化可能与前体化合物的代谢及成分之间的相互异构、分解转化有关[38]。
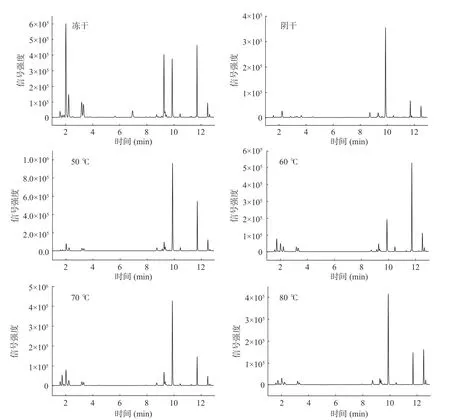
图7 不同干燥条件下紫苏的电子鼻色谱图Fig.7 Electronic nose chromatograms of Perilla under different drying conditions
3 讨论与结论
适宜的农产品采后初加工方式能够在保证农产品品质的同时,延长其贮存时间,而紫苏作为芳香性药食同源中药材,其干制过程对其品质特性影响极大,目前国内外对芳香性药食同源中药材的研究多集中于品质特性的检测分析。本研究基于恒定风速、实时排出干燥介质水分的烘干方式探讨了紫苏茎、叶在不同干燥温度下的干燥特性。结果表明,紫苏茎、叶的干燥特性分别适合用Page 模型及Twoterm 模型进行拟合描述,紫苏茎叶的干燥过程以降速干燥阶段为主,提高温度虽然能增大恒速干燥阶段的占比,从而减少干燥时间,但是会造成活性成分的损失、抗氧化能力减弱以及芳香性风味物质含量减少。虽然冷冻干燥处理在产品品质上有一定优势,但是其投入成本高、设备耗能大、处理量小等问题限制了在紫苏采后大规模处理中的应用。此外,自然阴干作为目前应用最为广泛的紫苏初加工方式,仍存在一定的弊端,本研究中,智能排湿的低温烘干条件(50 ℃)与传统的阴干处理相比,在活性成分含量、抗氧化性能及气味物质含量及丰度上均无较大的差异,如挥发油等物质含量上低温智能烘干反而较自然阴干表现更优。因此以轻微的品质减损换取更大的处理量和更低的能耗是可行的,低温智能烘干在紫苏采后加工上具有良好的发展前景。
