板栗壳多酚的超声波辅助低共熔溶剂提取工艺优化及其成分分析
2022-08-16张晓云梅晓宏
张晓云,梅晓宏,
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083)
据联合国粮食及农业组织(FAO)报道,2017 年中国的板栗产量占世界的83%以上,是世界上最大的板栗生产国[1]。板栗加工过程中产生大量的废弃物,包括内壳和外壳,约占整个板栗重量的15%~20%[2-3]。这些板栗壳废弃物通常用作燃料燃烧或者自然腐烂,不仅浪费资源还污染环境[4]。近年来有研究发现[5],板栗壳中富含酚类、鞣质、有机酸、黄酮等物质,而酚类物质具有一定的抗氧化、抗肥胖、抗癌、抗糖尿病、抗动脉粥样硬化等特性,对人体健康有益[6]。因此板栗壳多酚具有较高的开发利用价值,在创造更高的经济效益的同时,能减少环境污染和资源浪费。然而,使用传统有机溶剂(如乙醇)或水提取板栗壳多酚,存在提取时间长、提取率低、能耗高等缺点[7]。
低共熔溶剂(Deep eutectic solvents,DESs)通常由氢键受体(Hydrogen bond acceptor,HBA)和氢键供体(Hydrogen bond donor,HBD)组成,具有低熔点、高热稳定性、低毒性或无毒性、高生物降解性和低制备成本等特性。氯化胆碱(Choline chloride,ChCl)是最常用的HBAs 之一,天然初级代谢物(如糖、有机酸和胺类)是HBDs 的丰富来源[8]。目前,DESs 作为一种绿色、高效的有机溶剂替代品已被广泛应用于各种天然产物的提取,包括酚类、黄酮类、蛋白质、多糖、蒽醌类、萜类、生物碱等[9-14]。超声波辅助提取(Ultrasonic-assisted extraction,UAE)作为一种新型的有效萃取技术,不仅可以降低溶剂和能量的消耗,而且还可以缩短提取时间[15],因此,UAE 的DESs 提取已成为植物组织中高效提取功能性成分的重要手段[6,8,16-17]。
基于以上现状,本研究利用DESs-UAE 提取板栗壳中的多酚,筛选出最佳的DESs 溶剂,并采用响应面法优化最佳工艺条件,以实现板栗壳中酚类物质的高效快速提取,并对粗提物中酚类物质进行鉴定,旨在获得一种绿色、高效提取板栗壳废弃物中多酚的方法,以实现板栗壳废弃物的资源化利用。
1 材料和方法
1.1 材料与仪器
板栗壳 购买于当地农贸市场;氯化胆碱(>98.0%)、乙二醇(>98.0%)、1,2-丙二醇(>99.0%)、1,3-丁二醇(>98.0%)、甘油(>99.0%)、草酸(>99.8%)、D-山梨醇(>98.0%)、葡萄糖 Macklin 生化有限公司;Folin-Ciocalteu 试剂、没食子酸标品、三种大孔树脂(D-101,AB-8 和NKA-9)、尿素(>99.5%)中国北京Solarbio 科技有限公司;HPLC 级甲酸Sigma-Aldrich 公司;MS 级乙腈 Fisher Scientific公司。
FW100 型高速万能粉碎机 天津市泰斯特仪器有限公司;SCIENTZ-IID 型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Centrisart D-16C 型高速离心机 德国Eppendorf 公司;TU-1901 型紫外可见分光光度计 北京普析通用仪器有限责任公司;FTIR 光谱仪 美国Perkin-Elmer 公司;TripleTOF 5600+质谱仪 美国AB SCIEX 公司;Nexera UHPLC LC-30A UHPLC 色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 板栗壳前处理 取板栗壳于50 ℃干燥,磨碎,过60 目筛,储存在玻璃瓶内,放置于干燥器中,使用前干燥至恒重。
1.2.2 DESs 的制备 HBD 和HBA 按一定摩尔比混合,水浴80 ℃下搅拌1.5 h,直至形成均匀透明的液体,储存在室温下过夜[17],使用前真空干燥24 h。本实验合成8 种DESs,DESs 的编号、HBA、HBDs以及HBA 与HBD 的摩尔比如表1 所示。

表1 不同类型的DESsTable 1 Different systems of the prepared DESs
1.2.3 板栗壳多酚提取及提取溶剂选择 称取0.5 g板栗壳粉末,加入15 mL DESs(含水量20%,v/v)或水或40%乙醇于50 mL 离心管中,混匀,在室温下超声处理10 min,超声功率200 W,超声过程中实时检测超声温度,控制其不超过55 ℃。之后10000×g离心10 min,取上清液,过0.22 μm 滤膜,备用。
1.2.4 总酚得率的计算 基于预实验结果,DESs 不会干扰福林酚显色反应。因此,本实验采用福林酚法测定1.2.3 所得提取液中总酚含量[18],按公式(1)计算总酚得率。取10 μL 提取液,加入一定量超纯水进行稀释,然后依次加入1 mL 福林酚试剂(1/10,v/v超纯水稀释)和1 mL Na2CO3溶液(10%,w/v,超纯水溶解),定容至4 mL。在50℃下避光反应5 min,于765 nm 处测吸光度。以没食子酸作为标准品,标准曲线为y=12.605x-0.1111(R2=0.9992)。总酚得率(mg/g)用没食子酸当量表示,按照如下公式进行计算:

式中:Y 表示总酚得率,mg/g;C 表示所测吸光度值对应的标准曲线浓度,mg/mL;V0表示显色反应液体体积,4 mL;V1表示提取样品总体积,mL;V2表示用于显色的提取液体积,mL;m 表示板栗壳质量,0.5 g。
1.2.5 DES-1 的傅里叶红外变换光谱(FTIR)分析将氯化胆碱、草酸和DES-1 进行傅里叶红外光谱扫描,扫描前将样品置于烘箱中,55 ℃下干燥12 h,充分烘干以除去水分。扫描分辨率为4 cm-1,扫描波数范围4000~400 cm-1,扫描32 次,并使用OMNIC 8.2 软件对数据进行分析。
1.2.6 多酚提取工艺优化
1.2.6.1 单因素实验 采用1.2.3 方法提取多酚,以DES-1 为提取溶剂,固定液固比30:1 mL/g、超声波功率200 W、超声波时间10 min,考察水分含量(0、20%、30%、40%、50%)对总酚得率的影响;固定超声波功率200 W、水分含量20%、超声波时间10 min,考察液固比(20:1、30:1、40:1、50:1、60:1 mL/g)对总酚得率的影响;固定水分含量20%、液固比30:1 mL/g、超声波时间10 min,考察超声波功率(250、300、350、400、450 W)对总酚得率的影响;固定水分含量20%、超声波功率200 W、液固比30:1 mL/g、超声提取时间(2、5、10、15、20 min)对总酚得率的影响。
1.2.6.2 响应面试验优化工艺 在单因素实验的基础上,用响应面分析法进一步优化提取工艺参数。依据Design-Expert 8.0 软件中Box-Behnken 的实验设计原理见表2,以总酚得率为响应值,确定最佳提取条件。
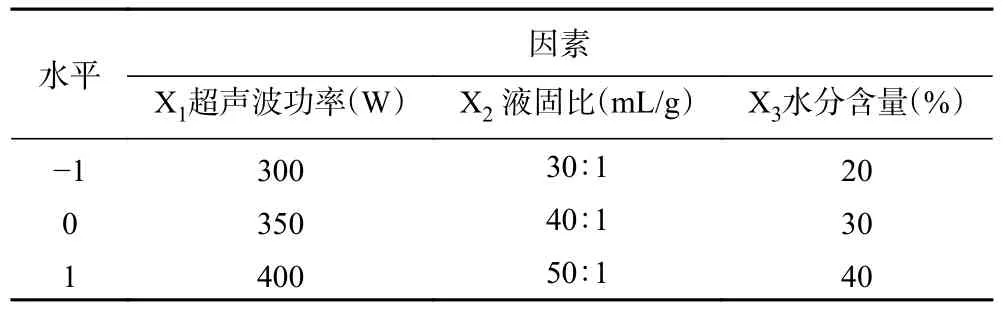
表2 优化方案的因素水平设计Table 2 Factors and levels in the optimal scheme
1.2.7 大孔吸附树脂纯化多酚
1.2.7.1 树脂活化 大孔吸附树脂活化参考Wang等[8]方法稍并做修改。分别称取D-101(非极性)、AB-8(弱极性)和NKA-9(极性)大孔吸附树脂15 g,用超纯水冲洗,除去白色漂浮物,滤纸吸走树脂水分,再用无水乙醇浸泡24 h,超纯水冲洗至冲洗液无白色浑浊;4% HCl 浸泡5 h,超纯水冲洗至中性;4%NaOH 浸泡5 h,超纯水清洗至中性,滤纸吸去树脂表面水分。
1.2.7.2 吸附与洗脱 将活化后的大孔吸附树脂以95%乙醇湿法上柱,浸泡24 h。然后用超纯水洗净乙醇,浸泡4 h 后备用。将2 mL 多酚提取液过层析柱,未吸附的部分使用200 mL 超纯水冲洗,而后用95%(v/v)乙醇洗脱至无色,将洗脱液收集。将洗脱液进行45 ℃恒温旋转蒸发浓缩。用超纯水定容至10 mL,测定总酚含量,计算回收率。
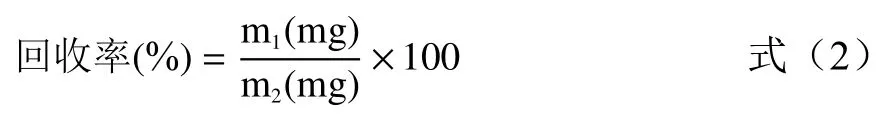
式中:m1表示洗脱液中总酚量,mg;m2表示2 mL 上样中总酚量,mg。
1.2.8 UHPLC-ESI-Q-TOF-MS/MS 分析 基于响应面优化的实验条件,提取多酚并用AB-8 大孔吸附树脂进行回收,过0.22 μm 滤膜,进一步通过UHPLCQ-TOF-MS/MS 进行定性分析。色谱条件如下:岛津InerSustain C18反相色谱柱(100 mm×2.1 mm,2 μm),柱温35 ℃,流速0.3 mL/min,进样量2 μL,流动相A、B 分别为0.1%甲酸水溶液与乙腈;梯度洗脱(0~2 min,5% A;2~4 min,5%~20% A;4~12 min,20%~25% A;12~14 min,25%~46% A;14~26 min,46%~100% A;26~28 min,100% A;28~29 min,100%~5% A;29~30 min,5% A)。通过Q-TOF-MS/MS 定性分析洗脱液中酚类物质的种类,质谱条件为:电喷雾离子源(ESI),正负离子模式扫描,喷雾电压为5500/-4400 V,正、负离子源温度分别为500、450 ℃,去簇电压为60 V/-60 V,气帘气25 psi,雾化气50 psi,辅助加热气50 psi,离子扫描范围为m/z 50~1000,累积时间为10 ms,碰撞能量为20~50 eV,通过IDA模式获得质谱数据。通过分析MS/MS 离子碎片,并结合数据库(MassBank、Respect、GNPS)与相关文献报道,鉴定提取物中酚类物质的种类。
1.3 数据处理
实验结果采用SPSS Statistics 17.0 软件进行统计分析,采用Design expert 8.0.6 软件进行回归分析。数据用平均值±标准误差(Mean±SD)表示,采用单因素方差分析(One-way analysis of variance,ANOVA)中Duncan 多重比较分析组间差异性。
2 结果与分析
2.1 最适低共熔溶剂选择
本实验以ChCl 为HBA,以有机酸、糖、胺和多元醇为HBDs,按不同的摩尔比合成了8 种不同类型的DESs。所制备的DESs 在室温下均呈透明液体状,考虑到DESs 的高粘度,在进行多酚的提取时所使用的DESs 含水量为20%(v/v)。不同种类DESs对板栗壳多酚得率如图1 所示。
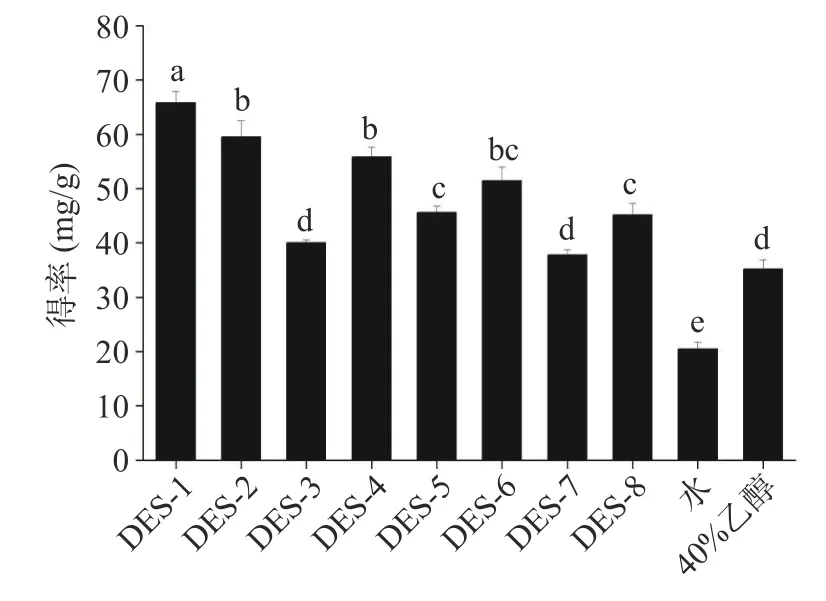
图1 不同溶剂对板栗壳多酚得率的影响Fig.1 Effect of different solvents on the extraction yield of phenolic compounds from chestnut shells
在8 种DESs 中,氯化胆碱:草酸=1:1 合成的DES-1 提取效果最好,为65.8±2.1 mg/g。可能原因是依据相似相溶原理,极性较强的DESs 适用于提取较强极性化合物,而极性较弱的DESs 适用于提取弱极性化合物[6],与胺基、糖基以及多元醇基DESs 相比,草酸基DESs 的极性更强,更适宜于提取多酚这种极性较强的化合物;此外,羧酸基DESs 的酸性环境更有利于维持多酚的结构不被破坏[19],从而增大总酚得率。值得注意的是,DES-1 的总酚得率显著高于水和40%乙醇(P<0.05),分别是水和40%乙醇的3.2 和1.8倍,可能是由于DES-1 能与多酚之间形成更强的氢键作用[8],从而促进提取,这与之前的报道相一致[20-21]。这些结果表明DES-UAE 法是一种较好的从板栗壳中提取多酚的方法。因此,选择氯化胆碱:草酸=1:1 制备的DES-1 用于后续提取工艺的优化。
2.2 DES-1 的FTIR 表征
对氯化胆碱、草酸以及制备的DES-1 进行了FTIR光谱表征,以证实氯化胆碱与草酸之间存在氢键作用,因为氢键是DESs 具有较高增溶能力的重要原因。氯化胆碱、草酸与DES-1 的红外谱图如图2 所示。
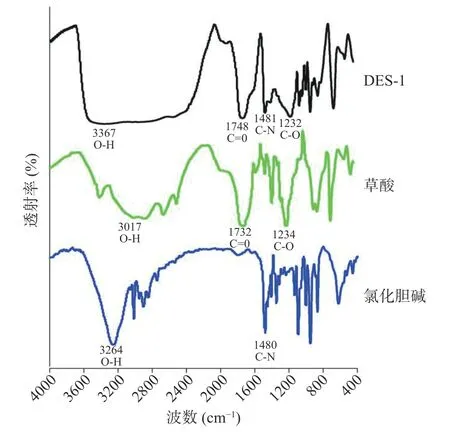
图2 氯化胆碱、草酸以及DES-1 的红外谱图Fig.2 Infrared spectra of choline chloride,oxalic acid and DES-1
由谱图可知:对于氯化胆碱,3264 cm-1处的特征峰为O-H 伸缩振动,1480 cm-1处的特征峰为CN 伸缩振动[22]。对于草酸,O-H 伸缩振动表现为以3017 cm-1为中心的宽谱带,是由于草酸C=O 和OH 基团之间形成了分子间氢键[23];1732 cm-1处特征峰为C=O 伸缩振动;1234 cm-1处的特征峰为C-O伸缩振动。与氯化胆碱的氢键区域相比,DES-1 氢键区域的峰形发生改变,由原来的尖峰变为宽谱带,表明在合成DES-1 时,ChCl 和草酸之间形成氢键。此外,在DES-1 光谱中观察到ChCl 和草酸的特征峰,表明ChCl 的C-N、草酸的C-N 键在反应过程中保持稳定。以上结果表明成功合成了DES,且氯化胆碱与草酸之间存在氢键相互作用。
2.3 单因素实验
2.3.1 水分含量的影响 DESs 可与水互溶,水的加入会改变DESs 的理化性质,尤其改变DESs 的黏度与极性。当前研究表明,水的加入可能促进或抑制DESs 的提取性能[24]。因此,探究水分含量对总酚得率的影响是必要的。由图3 可知,在无水条件下,总酚得率最低,当水分含量增加到30%时,总酚得率随水分含量的增加而增大,在含水量为30%时总酚得率达到最大,主要原因可能是水分的加入会明显降低DESs 的粘度。Huang 等[25]研究发现,在氯化胆碱:丙三醇=1:1 制成的DES 中加入5%(w/w)的水时,体系黏度可降低20%;加入20%的水时,体系黏度可降低至1/80。除此之外,研究表明,适当降低黏度可以有效提高传质速率,促进提取物的溶出,增大总酚得率[26]。然而,进一步增加含水量至50%,总酚得率随着水分含量的增加而减少,可能原因是加入过量的水分会减弱甚至破坏HBD 和HBA 之间的氢键相互作用,进而破坏DESs 的超分子结构,使得有效溶剂DESs 的含量降低,导致总酚得率降低。因此,选用水分含量20%、30%、40%进行后续优化试验。
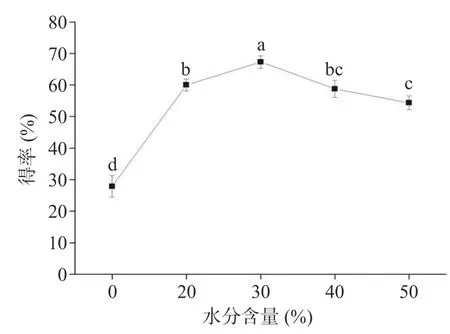
图3 水分含量对得率的影响Fig.3 Effect of water content on the yield
2.3.2 液固比的影响 液固比是萃取过程中不可缺少的因素。如图4 所示,当液固比从20:1 mL/g 增加到40:1 mL/g 时,总酚得率随液固比的增加而增加,可能是因为提取溶剂较少时,板栗壳原料与提取溶剂的接触不足,导致提取不充分[6]。随着液固比的增加,提取溶剂体积增加而充分浸提,从而提高总酚得率。当液固比继续增加时,总酚得率随液固比的增加而降低,这可能是由于液固比过大,加入过多的溶剂会消耗超声波一定的能量,导致总酚得率下降[27]。因此,选用液固比30:1、40:1、50:1 mL/g 进行后续优化试验。
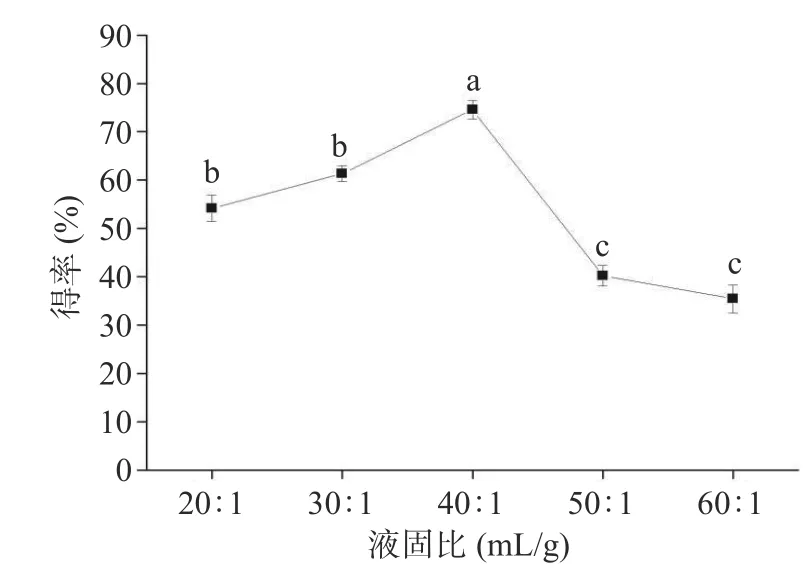
图4 液固比对得率的影响Fig.4 Effect of liquid-solid ratio on the yield
2.3.3 超声波功率的影响 如图5 可知,当超声波功率从200 W 增加到350 W 时,总酚得率随超声功率的增加而增加,这可能因为增大功率加强了超声波的破壁效果,促进了内容物的释放。当继续增加超声波功率至450 W 时,总酚得率随超声波功率的增大呈现明显降低的趋势,可能原因是,超声功率过大,产生的热效应会破坏部分多酚,使得总酚得率降低[28]。因此,选用超声波功率300、350、400 W 进行后续优化试验。

图5 超声波功率对得率的影响Fig.5 Effect of ultrasonic power on the yield
2.3.4 超声波时间的影响 超声波的处理时间也是影响提取效率的重要因素。由图6 可知,在10 min以内,随着时间的延长,总酚得率升高,但进一步延长处理时间时,提取效率增加的幅度较小。10 min 的提取时间足够将大部分的多酚从板栗壳基质材料中提取出来,而过长的时间处理又会使得时间和经济成本增加且提升的效果不显著(P>0.05),因此选择超声波处理10 min 进行后续实验。
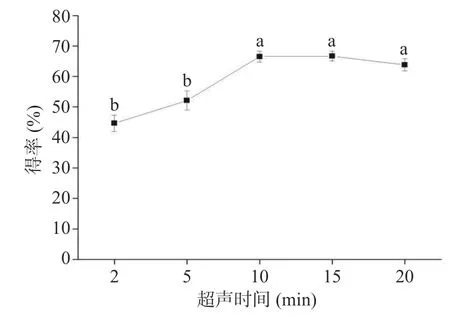
图6 提取时间对得率的影响Fig.6 Effect of extraction time on the yield
2.4 响应面结果分析
2.4.1 模型显著性分析 在单因素实验的基础上,采用响应面分析的BBD(三因素三水平)设计对多酚的提取工艺进行优化,得到最佳工艺条件,进一步得出预测值并建立回归模型。实验条件以及结果如表3所示,方差分析的结果和回归模型如表4 所示。
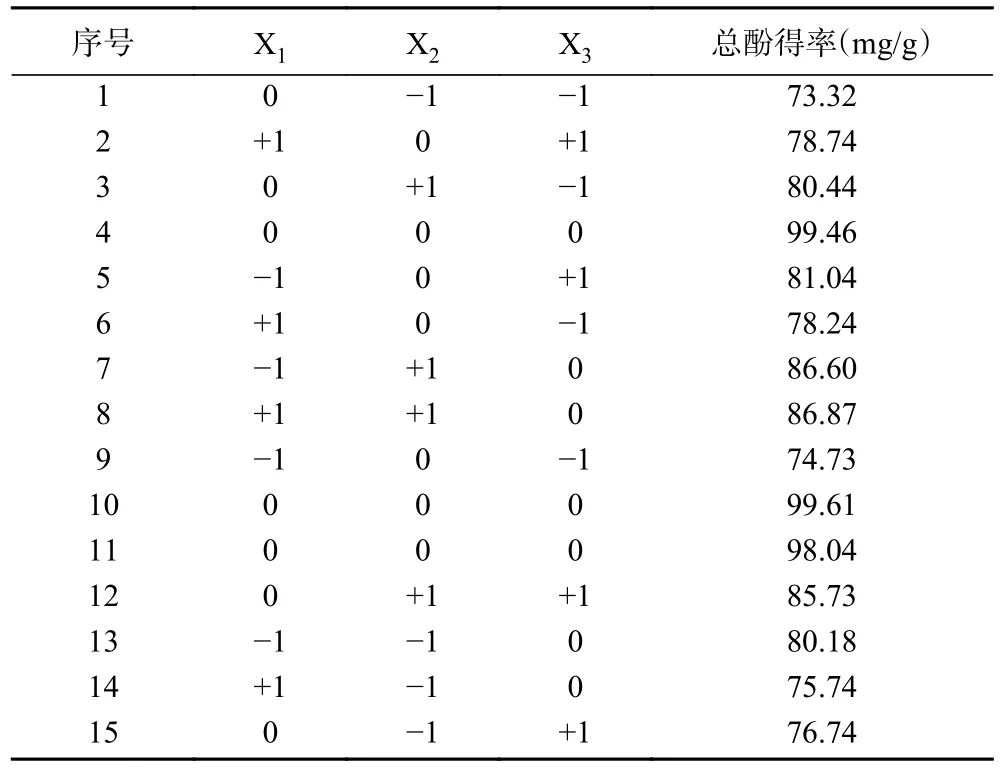
表3 Box-Behnken 响应面试验设计与结果Table 3 Design and results of Box-Behnken response surface experiment
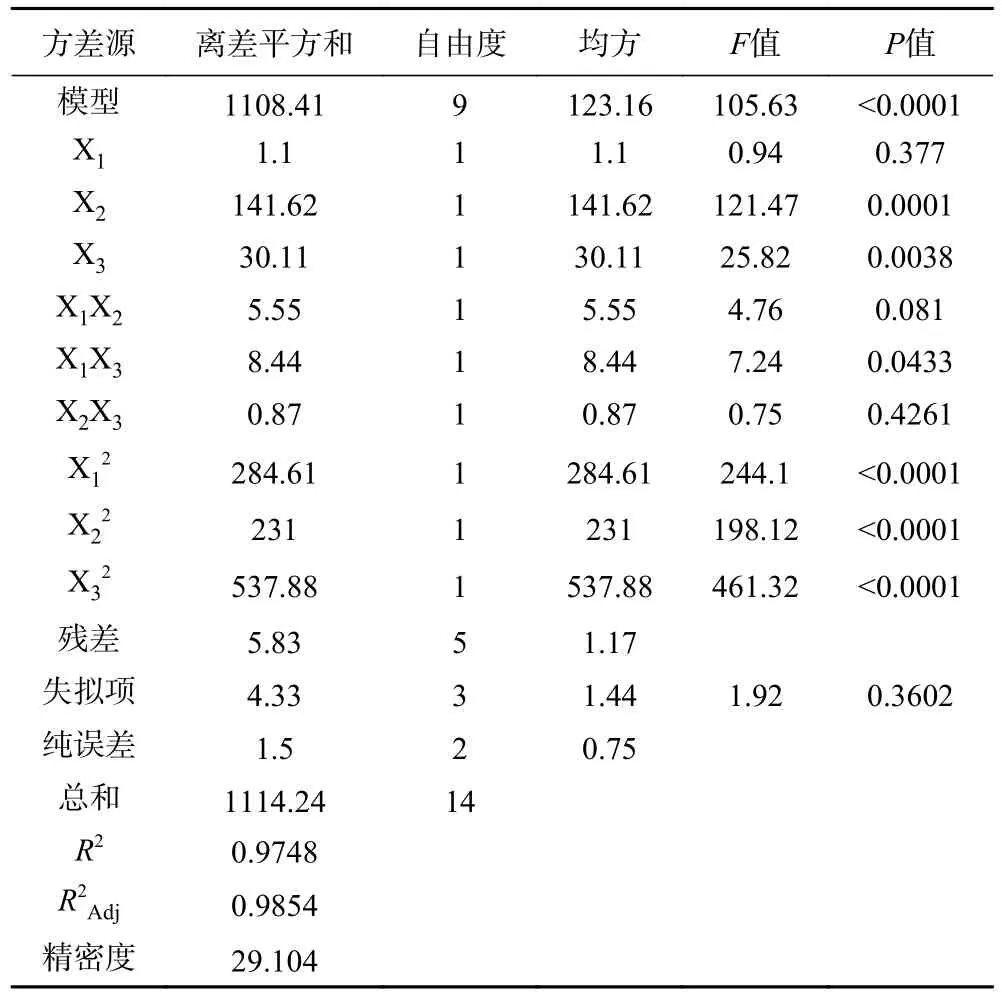
表4 回归模型方差分析Table 4 ANOVA for response surface regression mode.
采用F检验和P值对模型的显著性进行评价。较高的F值(105.63)和较低的P值(<0.0001)表明回归模型显著,因此认为该模型适合预测多酚的提取。模型失拟项P值为0.3602,大于0.05,不具有显著性差异。回归系数(R2=0.9748)、回归模型的调整系数(R2Adj=0.9854)和精密度(29.104)共同表明模型具有较高的精度和可靠性,表明预测值与实验值之间具有很高的相关性[29]。与此同时,一次项X2、X3以及平方项X21、X22和X23均影响极显著(P<0.01),交互项X1X3影响显著(P<0.05)。综上结果表明,该模型能充分且准确反映板栗壳总酚得率与自变量之间的真实关系。
得到描述模型的二阶多项式方程如下:
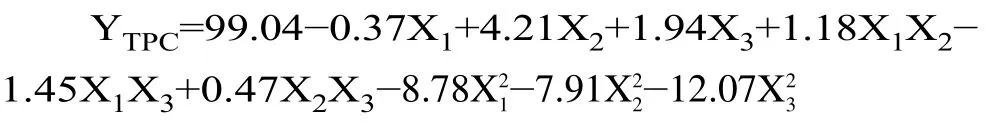
2.4.2 交互作用分析 3D 响应曲面图和热图可以直观反映超声波功率、液固比和水分含量对多酚总酚得率的交互作用显著程度[30]。如图7 所示,在3D 图中,曲面的坡度越大,越靠近曲面顶端颜色越深,表明两个变量之间的交互作用越显著。在热图中,等高线形状越接近圆形则交互作用越不显著,越接近椭圆则交互作用越显著。因此,结合表4 可知,只有超声波功率和水分含量的交互作用具有显著性影响,其余均不显著。
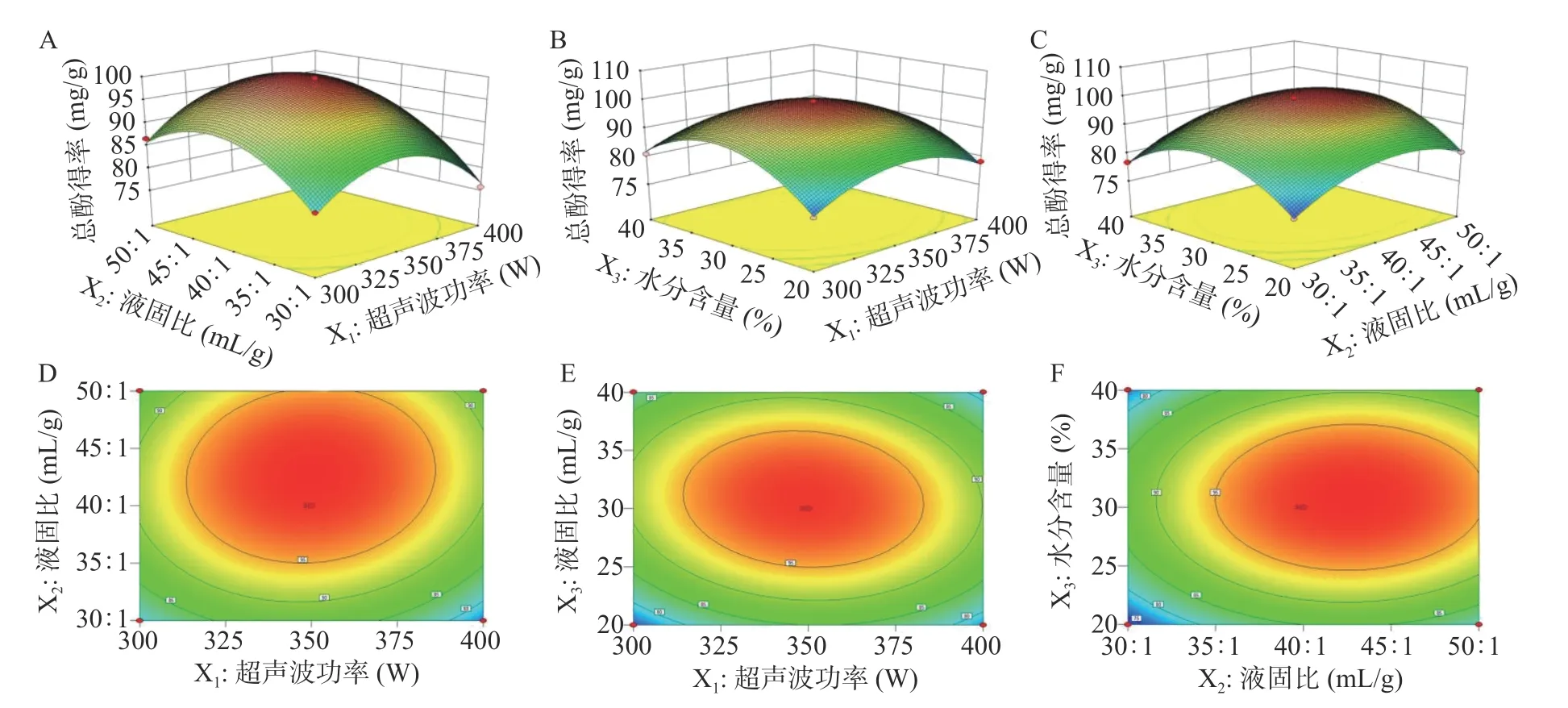
图7 3D 响应曲面图和热图Fig.7 3D response surface diagram and heat diagram
2.4.3 响应面优化和模型验证 经过响应面优化确定了多酚的最佳提取条件为:超声波功率348.11 W、液固比42.47:1 mL/g、水分含量32.29%,总酚得率为99.44 mg/g,为了实验的方便以及仪器的精确度,将最优条件调整为:超声波功率348 W、液固比42:1 mL/g、水分含量32%,实验重复3 次。在此最优条件下,实测总酚得率为99.66±2.63 mg/g,实验值与预测值相接近(误差3.34%<5%),验证了该模型对多酚的提取具有良好的预测能力。
2.5 大孔吸附树脂纯化
因为DESs 具有较高的水混溶性和极低的挥发性,所以从DESs 萃取物中回收萃取的目标化合物回收困难[25]。大孔吸附树脂法具有吸附速度快、吸附量大、耗能少、可重复使用等优点,在提取物纯化领域中应用较广泛。通过比较得出3 种不同极性树脂的回收性能结果,如表5 所示,AB-8 树脂的多酚回收率最高,达到97.92%±1.78%,因此认为AB-8 树脂是从DESs 提取物中回收多酚的理想树脂。相比AB-8,D-101 和NKA-9 树脂的回收率较低,分别为85.12%±2.07%和86.14%±3.55%。当树脂的极性与目标化合物的极性接近时,就会表现出较强的吸附能力。本实验AB-8 树脂属于弱极性树脂,极性可能与多酚的极性最类似,有利于最大程度表现出对多酚的强吸附性能[8]。因此,采用AB-8 大孔吸附树脂可以简便且高效地从DESs 粗提物中回收多酚。

表5 不同大孔吸附树脂对板栗壳多酚的回收率Table 5 Recoveries of polyphenols from chestnut shells by different macroporous resins
2.6 UHPLC-ESI-Q-TOF-MS/MS 分析
本实验通过UHPLC-Q-TOF-MS/MS 初步鉴定了13 种酚类化合物。所鉴定的酚类化合物的质谱数据及相关信息如图8 和表6 所示。通过与数据库以及相关文献相对比,共鉴定出两类酚类化合物:黄酮类(或类黄酮衍生物)和酚酸类。黄酮类化合物(或类黄酮衍生物)包括槲皮素-3-O-葡萄糖苷[31]、异鼠李素-3-O-半乳糖苷[31]、原花青素二聚体[32]、花青素[32]、花旗松素[32]、儿茶素[32]、橙皮苷[33]、异鼠李素[34]、百里香酚-β-D-葡萄糖苷、棕矢车菊素、表儿茶素没食子酸酯和黄芩苷4 ' -甲基醚,相比之下,只鉴定出一种酚酸(对羟基苯甲酸)。其中,原花青素二聚体和儿茶素具有较大的峰面积。这些结果进一步证实了UAE 辅助DESs 萃取法是一种有效的提取酚类化合物的方法。
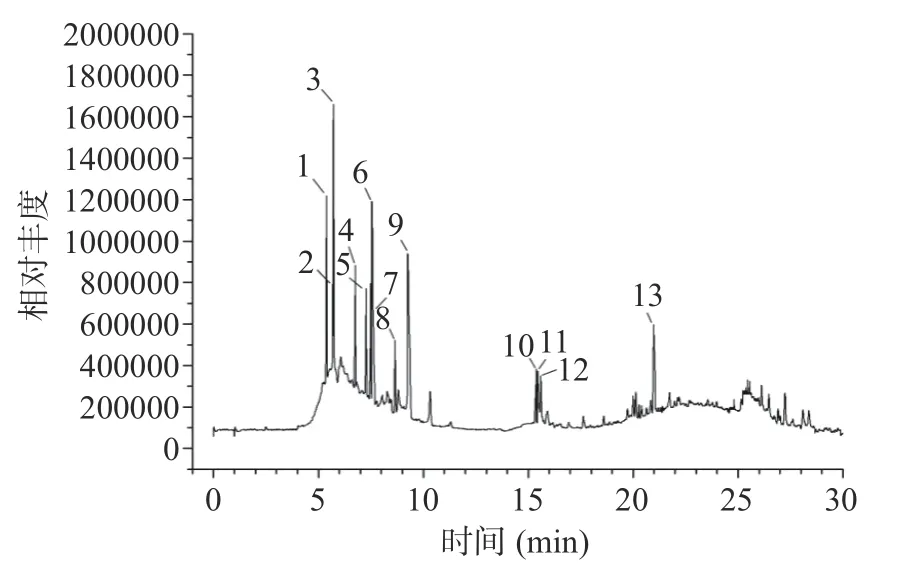
图8 板栗壳多酚的总离子流图Fig.8 Total ion current chromatograms of phenolic compounds from chestnut shells
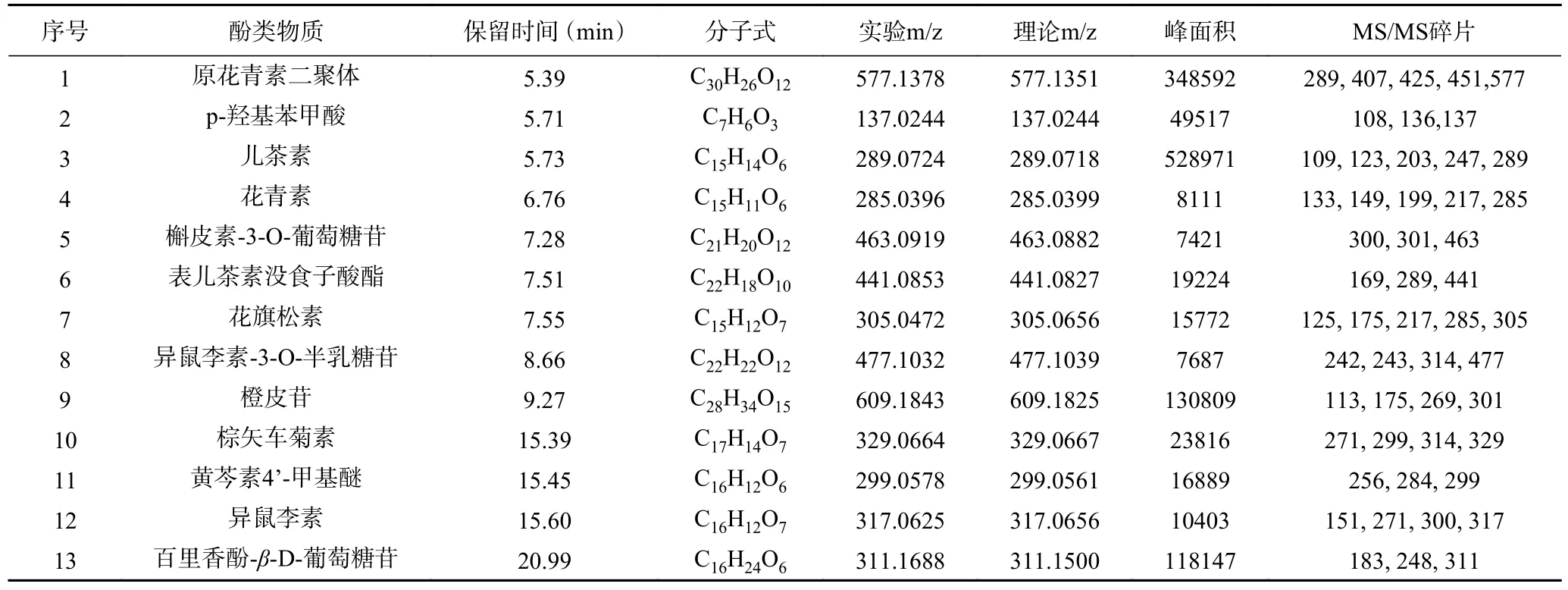
表6 UHPLC-ESI-Q-TOF-MS/MS 酚类物质鉴定结果Table 6 UHPLC-ESI-Q-TOF-MS/MS identification results of phenolic compounds
3 结论
本文采用低共熔溶剂-超声波辅助提取板栗壳废弃物中的多酚,以氯化胆碱-草酸(摩尔比为1:1)合成的DES-1 为最佳提取溶剂,FTIR 表征氯化胆碱和草酸之间氢键的形成。采用单因素实验和响应面分析进行提取工艺优化,将得到的提取物进行大孔吸附树脂回收,同时进行酚类物质的鉴定。优化的最佳提取工艺条件为:超声波功率348 W、液固比42:1 mL/g、水分含量32%,在此最优条件下总酚得率为99.66±2.63 mg/g,AB-8 大孔吸附树脂多酚回收率达到97.92%±1.78%,并初步鉴定出儿茶素、原花青素二聚体等13 种酚类物质。DESs 提取板栗壳多酚的效果明显高于传统溶剂(水和乙醇),为板栗壳多酚的绿色高效提取、创造更高经济价值提供了理论依据。但本实验仅对提取条件进行优化并进行多酚成分鉴定,未来还需要对各种酚类物质进行准确定量、分离纯化以及生物活性验证等。
