3种小分子拮抗剂对骨关节炎软骨细胞的作用*
2022-08-16王坤王旭施政良宁梓文何任杰董开颜李彦林
王坤,王旭,施政良,宁梓文,何任杰,董开颜,李彦林
(昆明医科大学第一附属医院运动医学科,云南昆明 650031)
骨关节炎(Osteoarthritis,OA)是一种世界范围内的老年性常见疾病,目前约有2.5 亿人受OA 的困扰,是老年人致残的主要原因之一[1]。迄今尚无药物可使OA 的病理进程逆转或停止,不能从根本上治愈,致使许多终末期OA 患者不得不通过手术治疗来恢复关节功能和消除疼痛。因此,发现一种安全、有效的抗OA 药物是科学界长期研究的热点与目的。基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)是一种8 kD 趋化因子,其通过与趋化因子受体4(C-X-C chemokine receptor type 4,CXCR4)结合而发挥作用。近年来,研究发现SDF-1/CXCR4 信号通路在OA 患者软骨退变的病理进程中起关键性作用[2-3],CXCR4 拮抗剂通过阻断SDF-1/CXCR4 信号通路而防止OA 患者关节软骨退变[4],CXCR4 拮抗剂由于具有显著的延缓关节软骨退变作用而有望成为一种抗OA 药物。目前研究较多的CXCR4 拮抗剂主要有TN14003、T140 及AMD3100,但关于这3 种小分子拮抗剂的对比研究甚少。本研究通过对这3 种小分子拮抗剂的比较,旨在找到一种高效、安全的OA 治疗药物。前期实验研究[5-6]表明,CXCR4 拮抗剂(T140、AMD3100)均具有延缓关节软骨退变的实验疗效,但T140 生物稳定性欠佳,而AMD3100 是一种部分拮抗剂,其拮抗效率低于T140[7]。TN14003 是T140 的衍生物,是一种CXCR4受体安全、有效、稳定的完全拮抗剂,目前主要用于抗肿瘤、抗人类免疫缺陷病毒(HIV)等方面的研究[8],但应用于OA 方面研究较少。Ⅱ型胶原(CollagenⅡ, ColⅡ)是由软骨细胞分泌并构成关节软骨的主要基质,研究认为软骨细胞内ColⅡ的降解往往与OA 病理进程有关,ColⅡ是量化OA 退变程度和研究抗OA 药物疗效的主要观察指标。本研究深入比较TN14003、T140、AMD3100 靶向阻断SDF-1/CXCR4 信号通路对人OA 软骨细胞ColⅡ的影响,为探寻高效的OA 靶向治疗药物奠定研究基础。
1 材料与方法
1.1 人OA软骨组织标本获取
收集昆明医科大学第一附属医院2016年1月—2017年1月行膝关节置换术患者截骨后留下的骨表面软骨组织标本(改良Mankin 评分为0 分或1 分)。收集标准:采用中华医学会骨科学分会制订的《骨关节炎诊治指南(2007 版)》的膝骨关节炎诊断标准[9],以此标准为参考纳入OA 患者。排除标准:化脓性关节炎、创伤性骨关节炎、痛风性关节炎、类风湿性关节炎等其他类型关节炎。本研究经医院医学伦理委员会批准,软骨组织标本的采集均获得患者知情同意。
1.2 主要实验试剂与仪器
本实验在昆明医科大学生物医学工程研究中心完成。TN14003 冻干粉、T140 冻干粉(北京中科亚光生物科技有限公司),AMD3100 冻干粉、SDF-1 冻干粉(美国PeproTech 公司),特级胎牛血清(美国Sigma 公司),Trizol Reagent 总RNA 提取试剂盒[天根生化科技(北京)有限公司],PrimeScript®RT Reagent Kit 试剂盒、Premix Ex TaqTMⅡ试剂盒(中国大连TaKaRa 公司),BCA 蛋白浓度测定试剂盒[天根生化科技(北京)有限公司],自动温控细胞培养箱(美国赛默飞世尔科技公司),PCR 仪(美国Bio-Rad公司)。
1.3 人OA软骨细胞培养及实验分组
无菌条件下将人OA 软骨组织块切成1 mm3的碎块,采用胰酶联合Ⅱ型胶原酶两步消化法体外培养OA 原代软骨细胞,用甲苯胺蓝染色鉴定。当培养瓶内原代软骨细胞长满约95%时用胰酶消化并传代,经过第1 次传代后为P1 代OA 软骨细胞。由于OA 软骨细胞多次传代后容易衰老并失去软骨细胞生物学特性,因此本实验选用P1 代OA 软骨细胞作为实验细胞。将P1 代OA 软骨细胞随机分成A 组、B 组、C 组、D 组,其中,A 组(TN14003 组)1 000 nmol/L TN14003 和100 ng/mL SDF-1; B 组(T140 组)内含有1 000 nmol/L T140 和100 ng/mL SDF-1;C 组(AMD3100 组)浓度为1 000 nmol/L AMD3100 和100 ng/mL SDF-1;D 组(SDF-1 组)仅有100 ng/mL SDF-1。各小分子拮抗剂浓度参考TN14003 等小分子拮抗剂的药理特性及笔者前期研究进行[4]。
1.4 实验方法
A 组、B 组、C 组分别预先加入1 000 nmol/L 的TN14003、T140 及AMD3100 拮抗剂1 h,然后4 组同时加入100 ng/mL 的SDF-1,放入37℃、5%二氧化碳恒温培养箱中培养。4 组细胞每隔4 d 换液1 次,每组细胞培养基为含15%胎牛血清及双抗(100 u/mL青霉素+0.1 mg/mL 链霉素)的高糖DMEM 培养基。
1.4.1 qRT-PCR检测4 组细胞在加药干预培养第2 天、第4 天时进行qRT-PCR 检测,按以下步骤进行,并重复3 次。Trizol 提取OA 软骨细胞总RNA,RNA 变性电泳观察18 s、28 s 条带,用紫外分光光度计分别在波长为260 nm 和280 nm 处检测吸光度,260/280 nm 吸光度比值为1.8~2.0。取该比值区间的RNA 进行后续实验。待检测RNA 纯度和浓度符合上述标准后,参照Prime Script®RT Reagent Kit 试剂盒说明书进行逆转录反应。根据引物设计原则,使用Primers Express Software 软件设计各基因引物,委托安徽通用生物公司合成各基因引物。实验过程参照Premix Ex TaqTMⅡ试剂盒说明书操作,扩增反应条件:95℃预变性15 min,95℃变性10 s,60℃退火30 s,60℃延伸30 s,共40 个循环。以GAPDH 为内参对照,计算目的基因ColⅡmRNA相对表达量(2-ΔΔCt)。引物序列见表1。

表1 qRT-PCR引物序列
1.4.2 Western blotting 检测4 组细胞在加药干预培养第2 天、第4 天时用磷酸盐缓冲液(PBS)洗3 次后进行Western blotting 检测。首先用RIPA 裂解液提取各组软骨细胞总蛋白,然后用BCA 法测定总蛋白浓度,计算上样缓冲液中总蛋白含量并使各组总蛋白水平相等。在浓缩胶上进行SDS-PAGE 电泳30 min 至样本到分离胶上,继续用分离胶将样本蛋白质进行分离,然后电转移至PVDF 膜进行抗原抗体杂交反应。将转膜后的PVDF 膜浸入5%的脱脂奶粉室温下封闭1 h,用TBST 缓冲液洗涤后加入一抗(鼠抗人ColⅡ单克隆抗体,1∶2 000)并旋转摇动4℃过夜,再次用TBST 洗涤后加二抗(羊抗鼠IgG,1∶5 000)并室温下孵育2 h。在暗室内加入免疫印迹化学发光试剂曝光显影,图像分析软件(Image J)进行目标蛋白和β-actin 的光密度测定,用目标条带与β-actin 光密度比值反映蛋白相对表达量。
1.4.3 ColⅡ免疫组织化学染色在6 孔板内预先放置无菌盖玻片,每孔内加入0.5×105个/mL 的细胞悬液2 mL 进行细胞爬片,2 d 后用PBS 洗2 次,再加入药物进行干预,在培养至第10 天时收集细胞爬片进行ColⅡ免疫组织化学染色。具体染色步骤如下:首先将细胞爬片用4%多聚甲醛室温下固定以便于保存细胞形态,然后用0.5% Triton 室温穿孔利于染色,接下来用甲醇+30% H2O2溶液(50∶1)室温下避光封闭及5%山羊血清(BSA)室温下封闭以阻断非特异位点,加入5%BSA 稀释的一抗(兔抗人ColⅡ单克隆抗体,1∶100)和生物素化二抗(羊抗兔IgG)进行抗原抗体反应,最后用DAB 染色液室温下显色,苏木精复染细胞核,经脱水、透明及封固处理后,倒置光学显微镜下观察,细胞内呈棕褐色为阳性染色。
1.5 统计学方法
数据分析采用SPSS 25.0 统计软件。计量资料以均数±标准差(±s)表示,多组比较用重复测量设计的方差分析,进一步两两比较用SNK-q法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组软骨细胞ColⅡmRNA 相对表达量的比较
A 组、B 组、C 组、D 组软骨细胞在第2 天、第4 天时ColⅡmRNA 相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间软骨细胞ColⅡmRNA 相对表达量有差异(F=37.080,P=0.000);②4 组软骨细胞ColⅡmRNA 相对表达量有差异(F=587.799,P=0.000);③4 组软骨细胞ColⅡmRNA 相对表达量变化趋势有差异(F=4.290,P=0.044)。进一步行两两比较,A 组软骨细胞ColⅡmRNA 相对表达量高于B 组、C 组、D 组(P<0.05),且C 组低于B 组(P<0.05),D 组低于C 组(P<0.05);随着时间延长,各组软骨细胞ColⅡmRNA 相对表达量逐步减弱(P<0.05),A 组减弱程度相对较小。见表2。
表2 各组软骨细胞ColⅡmRNA相对表达量的比较 (±s)

表2 各组软骨细胞ColⅡmRNA相对表达量的比较 (±s)
注:①与B组比较,P<0.05;②与C组比较,P<0.05;③与D组比较,P<0.05;④与第2天比较,P<0.05。
第4天1.25±0.17①②③④0.62±0.03②③④0.37±0.04③④0.04±0.03④组别A组B组C组D组第2天1.35±0.09①②③1.08±0.06②③0.53±0.03③0.24±0.02
2.2 各组软骨细胞ColⅡ蛋白相对表达量的比较
A 组、B 组、C 组、D 组软骨细胞第2 天、第4 天ColⅡ蛋白相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间软骨细胞ColⅡ蛋白相对表达量有差异(F=669.597,P=0.000);②4 组软骨细胞Col Ⅱ蛋白相对表达量有差异(F=122.315,P=0.000);③4 组软骨细胞ColⅡ蛋白相对表达量变化趋势有差异(F=47.708,P=0.000)。进一步行两两比较,A 组软骨细胞第2 天时ColⅡ蛋白相对表达量高于B 组、C 组、D 组(P<0.05),且C 组、D 组低于B 组(P<0.05);A 组软骨细胞第4 天时ColⅡ蛋白相对表达量高于B、C、D 组(P<0.05),且C 组低于B 组(P<0.05),D 组低于C 组(P<0.05);随着时间延长,各组软骨细胞ColⅡ蛋白相对表达量减弱(P<0.05)。见表3。
表3 各组软骨细胞ColⅡ蛋白相对表达量的比较(±s)
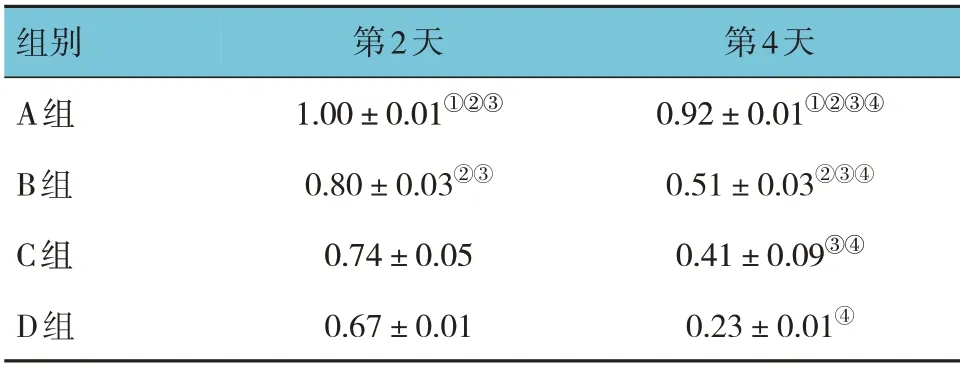
表3 各组软骨细胞ColⅡ蛋白相对表达量的比较(±s)
注:①与B组比较,P<0.05;②与C组比较,P<0.05;③与D组比较,P<0.05;④与第2天比较,P<0.05。
组别A组B组C组D组第2天1.00±0.01①②③0.80±0.03②③0.74±0.05 0.67±0.01第4天0.92±0.01①②③④0.51±0.03②③④0.41±0.09③④0.23±0.01④
A 组、B 组、C 组、D 组软骨细胞第2 天和第4 天ColⅡ蛋白相对表达量经灰度分析,结果显示:同一时间点,A 组软骨细胞中ColⅡ灰度最深,B 组、C 组、D 组依次变浅;随着培养时间延长,各组软骨电泳条带的灰度也呈变浅趋势。见图1。
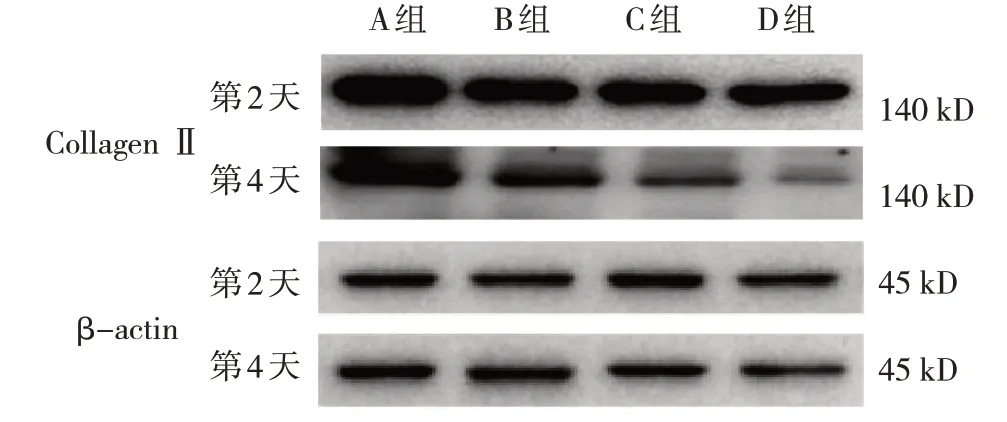
图1 各组软骨细胞ColⅡ蛋白电泳图
2.3 ColⅡ免疫组织化学染色结果
A 组、B 组、C 组、D 组软骨细胞加药干预培养至第10 天时进行免疫组织化学染色后发现,A 组内细胞核周围胞质内棕褐色染色最深,B 组次之,C 组及D 组染色较浅(见图2)。说明加药干预培养至第10 天时,A 组软骨细胞内ColⅡ蛋白含量最高。
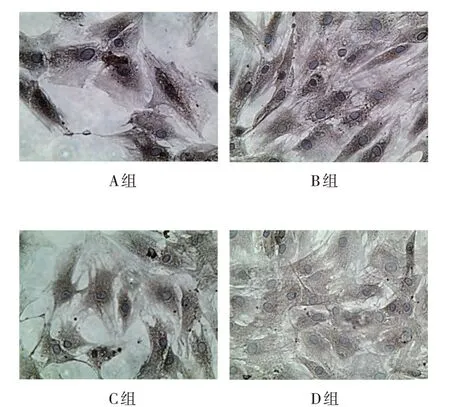
图2 各组软骨细胞ColⅡ免疫组织化学染色结果(×400)
3 讨论
OA 是常见的慢性致残性疾病,目前尚无一种有效的药物可以根治OA,只能针对性给予对症治疗[10-11]。目前临床上较多的是采取关节腔注射玻璃酸钠等对症治疗[12],我国每年用于治疗OA 的费用高达数亿元。因此,找到一种能延缓OA 甚至根治OA 的药物是临床急需解决的问题。
OA 的主要病理改变为软骨退行性改变。软骨细胞是软骨组织中唯一的细胞,可以合成并分泌ColⅡ,其生物学特征的变化与OA 的发生发展密切相关[13]。软骨细胞对软骨的正常结构与功能发挥着重要作用,软骨细胞合成及分泌ColⅡ异常在OA 的发生过程中起到重要的作用。软骨细胞中ColⅡ的含量变化直接关系到软骨组织的退变情况,所以ColⅡ成为OA 实验研究的主要观测指标。因此,为了初步验证TN14003、T140 及AMD3100 在延缓关节软骨退变方面的疗效,本研究主要观察这3 种小分子药物对人OA 软骨细胞ColⅡ的影响。
SDF-1 在OA 患者膝关节液中含量明显高于正常膝关节液中的含量,SDF-1 含量与OA 的严重程度呈正相关,甚至发现SDF-1 与软骨下骨硬化有关[14]。在膝关节中,CXCR4 是SDF-1 的特异性受体,两者结合后通过启动SDF-1/CXCR4 信号通路而引起软骨退变等一系列生物学反应[2,15]。因此,目前认为SDF-1/CXCR4 信号通路在OA 的发生发展过程中起关键作用。
CXCR4 拮抗剂可以有效阻断SDF-1/CXCR4 信号通路进而延缓关节软骨退变,部分CXCR4 拮抗剂已被用于防治OA 的研究中,其中研究较多的有AMD3100 和T140[5-7]。有研究[7]证明,AMD3100 是一种结合紧密且可以缓慢可逆的小分子非肽类CXCR4 拮抗剂,具有弱激动剂的部分作用,其阻断效率不完全,属于CXCR4 不完全拮抗剂。T140是CXCR4 受体的小分子肽类完全拮抗剂,相对于AMD3100 而言,其拮抗效率更高,特异性更强,但稳定性稍差[7]。TN14003 是T140 的衍生物,也是含有14 个氨基酸的小分子多肽,通过将T140 的羟基端氨基化等修饰后,TN14003 拮抗效率较T140 有所提高,稳定性好且细胞毒性低[8]。从这3 种小分子拮抗剂的拮抗效率来看,TN14003 显然高于其他2 个拮抗剂,这从本实验结果中也可以得到验证。
本研究中,笔者将TN14003、T140、AMD3100分别对应A 组、B 组及C 组,D 组作为对照组。由于OA 患者关节液中存在较高浓度的SDF-1,因此笔者在4 组培养基中均加入了SDF-1,以观察这3 种小分子拮抗剂阻断SDF-1/CXCR4 信号通路后的情况。通过qRT-PCR 检测各组软骨细胞ColⅡmRNA相对表达量后发现,随着培养时间延长,ColⅡmRNA 相对表达量逐渐下降,估计与SDF-1 持续作用于软骨细胞引起软骨细胞减少基质的合成有关。同时还发现,A 组中ColⅡmRNA 相对表达量均高于其他组,B 组、C 组、D 组中ColⅡmRNA 相对表达量依次递减,说明TN14003 可以更好地抵抗SDF-1 对软骨细胞ColⅡmRNA 的影响,T140 稍逊色于TN4003 而优于AMD3100。Western blotting 检测发现,A 组软骨细胞内ColⅡ蛋白相对表达量随着干预时间延长而逐渐减少,A 组细胞内ColⅡ蛋白相对表达量均高于B 组、C 组、D 组,说明TN14003较T140 及AMD3100 而言,能更好地拮抗SDF-1 对软骨细胞中ColⅡ蛋白的降解,进而能更好地延缓软骨的退变。最后通过免疫组织化学染色鉴定4 组软骨细胞中Col Ⅱ的表达,体外给予TN14003、T140 及AMD3100 干预培养至第10 天时,A 组中ColⅡ染色最深,B 组次之,而C 组和D 组染色最浅。说明100 ng/mL 的SDF-1 可以促进软骨细胞内ColⅡ的降解,而TN14003、T140 及AMD3100 可以延缓SDF-1 引起的OA 软骨细胞ColⅡ的降解,同时发现TN14003 的延缓效应也是最佳的,这与笔者前期的动物实验趋势是一致的[16]。
因此,可以这样认为,TN14003 在缓解人OA软骨关节退变优于T140 及AMD3100。 但是,TN14003 作为一种多肽类小分子拮抗剂,药物的稳定性、毒性等问题也是将来需要考虑及观察的问题,后期还需要进一步实验进行验证甚至改进,期待不久的将来临床上能用上一种高效、安全的延缓OA 靶向治疗药物。
