肥胖儿童血清microRNA-27a、PPAR-γ与胰岛素抵抗的相关性研究*
2022-08-16寇永妹陈新春谷小娜杨振朋孙国华
寇永妹,陈新春,谷小娜,杨振朋,孙国华
(唐山市人民医院儿内科,河北唐山 063001)
肥胖是指机体脂肪局部含量和/或总含量增多或分布异常的状态。近年来随着生活水平的提高和生活方式的改变,我国儿童肥胖患病率迅速上升,数据显示,1985年—2014年我国≥7 岁儿童肥胖率从0.5%上升至7.3%,预计2020年儿童肥胖率将达到22.3%[1-2]。肥胖不仅严重影响儿童生长发育,还是一种独立的慢性代谢性疾病,与胰岛素抵抗(insulin resistance,IR)密切相关,是2 型糖尿病、非酒精性脂肪肝、代谢综合征等慢性疾病的重要危险因素,并会增加成年期慢性疾病的风险[3-4]。IR 发病机制复杂,microRNA(miRNA)是一类非编码RNA 分子,能降解靶基因和/或抑制靶基因翻译,在IR 中发挥重要作用[5]。microRNA-27a(miR-27a)是一种与肥胖相关的miRNA,既往研究报道miR-27a 在肥胖患者血清中表达上调,其过表达可导致骨骼肌对葡萄糖消耗和摄取能力的降低[6-7]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)是胰岛素敏感性的重要调控因子,能入核调控具备PPAR 特异性反应元件的下游基因,维持血糖稳态,该基因缺失将导致IR[8]。研究[9]显示,PPAR-γ 为miR-27a参与代谢的关键靶基因。目前关于miR-27a 和PPAR-γ 与肥胖儿童IR 的关系鲜有报道,本研究旨在分析肥胖儿童血清miR-27a、PPAR-γ 与IR 的相关性,以期为改善肥胖儿童IR 提供指导。
1 资料与方法
1.1 一般资料
选取2020年1月—2021年7月唐山市人民医院104 例肥胖儿童为肥胖组。其中,男性64 例,女性40 例;年龄7~14 岁,平均(10.25±2.11)岁。纳入标准:①肥胖符合《中国儿童和青少年肥胖症外科治疗指南(2019 版)》[10]相关定义:体质量指数(BMI)>生长标准曲线的第95 百分位数;②年龄≤14 岁;③临床资料完整,具备良好依从性;④儿童家长或监护人知情研究并签署同意书。排除标准:①药物、激素等其他原因引起的继发性肥胖者;②合并先天性疾病者;③合并甲状腺疾病者;④合并心、肝、肾等重要脏器损害者;⑤合并急慢性感染者;⑥血液系统异常者。另选取同期本院体检的63 名健康儿童为对照组。其中,男性38 例,女性25 例;年龄7~14 岁,平均(10.17±2.08)岁。两组性别、年龄比较,差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准。
1.2 方法
收集所有儿童身高和体重资料,计算BMI=体重(kg)/身高(m2)。并采集肥胖儿童和正常儿童空腹肘静脉血,3 000 r/min 离心10 min,半径8 cm,取上清分为2 份,置于-80℃冰箱中待检。
其中一份采用葡萄糖氧化酶法测定空腹血糖(fasting blood glucose,FBG),75 g 口服葡萄糖耐量试验检测空腹胰岛素(fasting insulin,FINS),稳态模型胰岛素抵抗指数(HOMA-IR)=FBG (mmol/L) ×FINS (mIU/L)/22.5。AU5800 全自动生化分析仪(美国贝克曼库尔特公司) 检测总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂 蛋 白 胆 固 醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。Multiskan FC酶标仪[赛默飞世尔科技(中国)有限公司]检测血清脂联素、瘦素、抵抗素、内脂素、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子- α(tumor necrosis factor-α,TNF-α)水平,试剂盒均购自上海酶研生物科技有限公司。另一份采用Trizol 试剂盒(上海梵态生物科技有限公司)提取血清总RNA,Narodrop 分光光度计[赛默飞世尔科技(中国)有限公司]验证cDNA 浓度及纯度,OD260/OD280 为1.8~2.0,TaKaRa 试剂盒(北京宝日医生物技术有限公司)转录合成cDNA,使用qRT-PCR 仪(上海闳龙生物科技有限公司)和qRT-PCR 试剂盒(上海联迈生物工程有限公司)进行qRT-PCR 扩增。miR-27a 正向引物:5'-TGCGCTTCACAGTGGCTAAGT-3',反向引物:5'-CCAGTGCAGGGTCCGAGGTATT-3';内参U6 正向引物:5'-CGCTTCGGCAGCACATATAC-3',反向引物: 5'-AAATATGGAACGCTTCACGA-3';PPAR-γ 正向引物:5'-CTGGCCTCCCTGATGAATAA-3',反向引物:5'-CGCAGGTTTTTGAGGAACTC-3';内参GAPDH 正向引物:5'-TGTGTCCGTCGTGGATC TGA-3',反向引物:5'-CCTGCTTCACCACCTTCTTG AT-3'。10 μL 反应体系:5.0 μL SYBR Premix Ex Taq;0.2 μL 引物;0.2 μL ROX 参考染料;1.0 μL cDNA 模板;3.4 μL 经DEPC 处理水。反应条件:95℃预变性90 s 循环1 次,95℃变性30 s、63℃退火30 s、72℃延伸15 s 循环40 次,制备熔解曲线。反应结束后得到各反应管Ct,采用2-ΔΔCt法计算血清miR-27a mRNA、PPAR-γ mRNA 相对表达量。
1.3 统计学方法
数据分析采用SPSS 26.0 统计软件。计量资料以均数±标准差(±s)或中位数和四分位数[M(P25,P75)]表示,比较用t检验或秩和检验;计数资料以例(%)表示,比较用χ2检验;相关分析用Pearson 或Spearman 法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组BMI、脂代谢指标、细胞因子水平比较
两组BMI、脂代谢指标(除FBG 外)、细胞因子水平比较,差异有统计学意义(P<0.05),肥胖组BMI、FINS、HOMA-IR、TC、TG、LDL-C、瘦素、抵抗素、内脂素、IL-6、TNF-α、miR-27a mRNA 高于对照组,HDL-C、脂联素、PPAR-γ mRNA 低于对照组。两组FBG 比较,差异无统计学意义(P<0.05)。见表1。
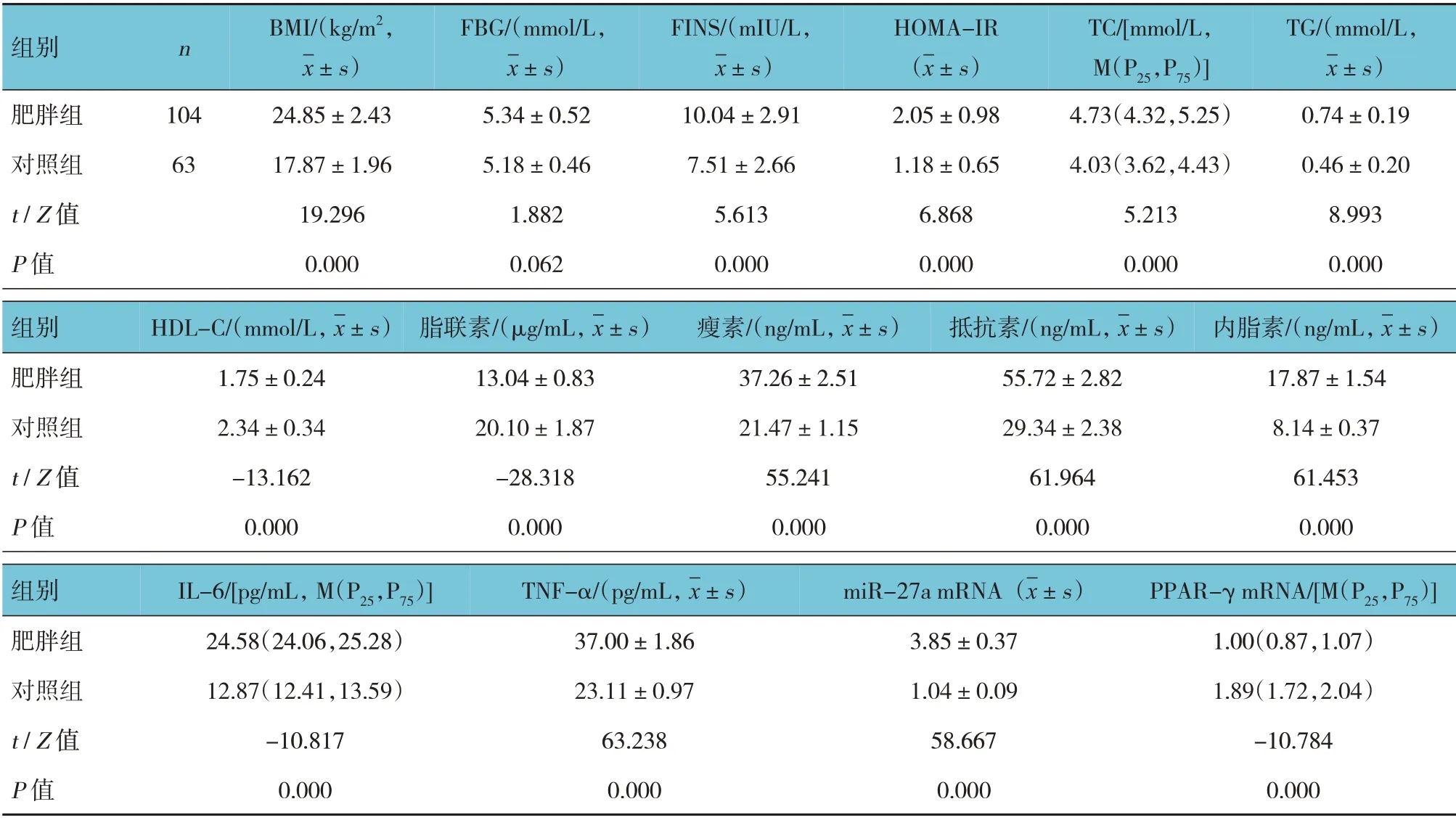
表1 肥胖组与对照组BMI、代谢指标、细胞因子水平比较
2.2 血清miR-27a mRNA、PPAR-γ mRNA 与BMI、脂代谢指标、细胞因子的相关性
Pearson/Spearman 相关性分析显示,肥胖儿童血清miR-27a mRNA 与BMI、 FINS、 HOMA-IR、TC、TG、LDL-C、瘦素、抵抗素、内脂素、IL-6、TNF- α 呈正相关(r/rs=0.607、 0.362、 0.466、0.435、0.542、0.450、0.546、0.558、0.437、0.633和0.559,均P<0.05),与HDL-C、脂联素、PPAR-γ mRNA 呈负相关(r/rs=-0.686、-0.607 和-0.727,均P<0.05);肥胖儿童血清PPAR-γ mRNA 与BMI、FINS、HOMA-IR、TC、TG、LDL-C、瘦素、抵抗素、内脂素、IL-6、TNF-α 呈负相关(r=-0.513、-0.328、-0.437、-0.340、-0.434、-0.411、-0.537、-0.514、-0.428、-0.547 和-0.509,均P<0.05),与HDL-C、脂联素呈正相关(r=0.599 和0.527,P<0.05)。见表2。

表2 miR-27a mRNA、PPAR-γ mRNA与BMI、脂代谢指标、细胞因子的相关性
2.3 HOMA-IR 与血清脂代谢指标、细胞因子的相关性
肥胖儿童HOMA-IR 与TC、TG、LDL-C、瘦素、抵抗素、内脂素、IL-6、TNF-α 呈正相关(r/rs=0.167、0.168、0.259、0.442、0.426、0.372、0.438和0.441,均P<0.05),与HDL-C、脂联素呈负相关(r=-0.240 和-0.378,均P<0.05)。见表3。
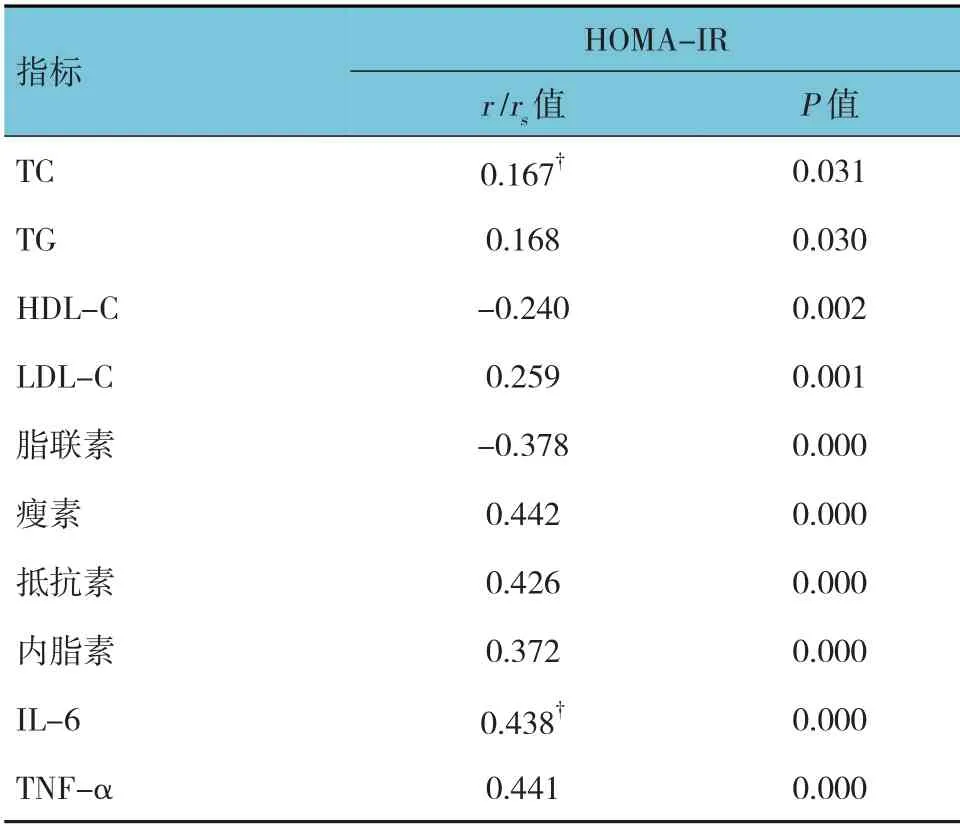
表3 HOMA-IR与脂代谢指标、细胞因子的相关性
3 讨论
儿童肥胖是由遗传因素、环境因素等共同作用导致的一种独立的慢性代谢性疾病,目前儿童肥胖形势日益严峻,但相关干预和治疗却存在诸多挑战,尚无充分证据证实外科手术减肥适用于肥胖儿童,其可能影响儿童的生长发育,而饮食和行为干预又很难达到显著减肥效果,因此有必要进一步探索儿童肥胖相关机制。IR 为肥胖儿童常见代谢异常因素之一,实质为机体对能量过剩的一种代偿反应机制,当机体储存过多能量而肥胖时,胰岛素不能发挥正常效应,对葡萄糖摄取和利用效率降低,机体代偿性分泌过多胰岛素以维持血糖稳定,是肥胖儿童心血管疾病发生的主要原因[11-12]。研究肥胖儿童IR 机制对降低体重和心血管疾病风险具有重要意义。
miRNA 是一类长度约22 个核苷酸的高度保守的内源性非编码小分子单链非编码RNA,能与靶mRNA 的3'非翻译端相互作用,降解靶mRNA 或翻译抑制,参与包括IR 等多种病理生理过程[13]。miR-27a 定位于人染色体19p13.12,在脂肪组织中高度表达,能作为负向调控剂促进脂肪细胞分化和脂质堆积,而脂肪过度积聚为肥胖者机体能量失衡的主要表现,因此miR-27a 被认为是肥胖相关miRNA[6-7]。本研究结果显示,相比对照组,肥胖组血清miR-27a mRNA 相对表达量明显升高,说明miR-27a 参与肥胖发生,分析原因与miR-27a 高表达参与脂肪过度积聚有关。同时本研究结果显示,相比对照组,肥胖组FINS 和HOMA-IR 显著升高,说明本组肥胖儿童存在明显的IR,但两组FBG 水平比较无差异,分析原因与肥胖儿童胰岛素功能虽然受损,但还是能缓慢分泌胰岛素降低血糖有关。作为肥胖相关miRNA,大量研究也报道了miR-27a 与IR 的关系,如YU 等[15]研究显示,骨骼肌细胞中miR-27a 过表达可引起骨骼肌对葡萄糖消耗和摄取能力的降低,导致骨骼肌IR。骨骼肌是胰岛素刺激葡萄糖吸收的主要效应器官,在维持机体血糖稳态中发挥重要调节作用,miR-27a 过表达能引起骨骼肌IR 提示miR-27a 参与IR 过程。本研究结果显示,肥胖儿童血清miR-27a 与FINS、HOMA-IR 呈正相关,说明肥胖儿童血清miR-27a升高与IR 发生有关。脂肪组织是一个代谢和免疫功能活跃的器官,能特异性分泌大量具备活性的TC、TG、HDL-C、LDL-C、脂联素、瘦素、抵抗素、内脂素等脂肪因子,以及IL-6、TNF-α 等前炎症因子。肥胖状态下脂肪细胞体积变大和脂肪组织血流量异常等可引起脂肪因子和前炎症因子异常表达,前炎症因子能直接抑制胰岛素信号传导导致IR,脂肪因子代谢紊乱可导致大量脂肪堆积于肌肉、肝脏、β 细胞,引起胰岛细胞功能障碍和IR[16-17]。本研究结果显示,与对照组相比,肥胖组TC、TG、LDL-C、瘦素、抵抗素、内脂素、IL-6、TNF-α 水平升高,而HDL-C、脂联素水平降低,说明肥胖儿童存在明显脂代谢异常和炎症反应,与既往报道一致[18]。相关性分析表明HOMA-IR 与脂代谢异常和炎症反应相关,说明miR-27a mRNA高表达可能通过脂代谢异常和炎症反应参与肥胖儿童IR。
PPAR-γ 是一种核激素受体因子,具备转录激活和转录抑制的作用,初始研究认为其仅能调控脂肪细胞分化,在脂质裂解和代谢中发挥重要作用,近年研究表明,PPAR-γ 还能通过调控葡萄糖转运蛋白4、胰岛素受体底物等改善IR,同时PPAR-γ 也能通过控制脂肪组织分泌脂肪因子和前炎症因子改善胰岛素敏感性[8]。本研究结果显示,相比对照组,肥胖组血清PPAR-γ mRNA 相对表达量明显降低,说明PPAR-γ 参与肥胖发生,分析原因与PPAR-γ 参与脂质裂解和代谢有关,PPAR-γ表达降低会抑制其裂解和代谢脂质作用,导致脂肪过度积聚引起肥胖。结果还显示,肥胖儿童血清PPAR-γ 与FINS、HOMA-IR 呈负相关,说明肥胖儿童血清PPAR-γ 表达降低与IR 发生有关,与既往报道一致[8]。相关性分析也说明PPAR-γ mRNA 相对表达量降低可能通过脂代谢异常和炎症反应参与肥胖儿童IR。生物信息学预测结果表明,miR-27a 可结合PPAR-γ mRNA 的3'非翻译端,抑制PPAR-γ mRNA 表达,近年多项研究通过荧光报告素酶实验也证实miR-27a 能靶向抑制PPAR-γ mRNA 表达,从而发挥其生物学作用,如DENG 等[19]在绵羊脂肪生成研究中发现,过表达miR-27a 能通过下调PPAR-γ 促进脂肪细胞分化和聚集。CHEN等[20]在小鼠肥胖和脂肪细胞IR 模型研究中发现,过表达miR-27a 能通过下调PPAR-γ 降低脂肪细胞对葡萄糖的摄取和利用,并下调胰岛素敏感性。本研究结果也显示,肥胖儿童血清miR-27a mRNA与PPAR-γmRNA 呈负相关,因此可推测肥胖儿童血清miR-27a mRNA 高表达可能通过抑制PPAR-γ mRNA 表达导致IR,但该结论还需进一步实验验证。
综上所述,肥胖儿童血清miR-27a mRNA 高表达、PPAR-γ mRNA 低表达,两者与IR 密切相关。但本研究样本量较少,关于miR-27a 和PPAR-γ 参与肥胖儿童IR 的机制有待研究验证,后续研究将进一步探讨二者与肥胖儿童预后的关系。
