长链非编码RNA 在胰腺癌吉西他滨耐药研究中的作用
2022-08-16郭晨博毛玉宁张延英汪永锋师长宏
郭晨博毛玉宁张延英汪永锋∗师长宏∗
(1.甘肃中医药大学,兰州 730030;2.空军军医大学实验动物中心,西安 710032;3.延安大学医学院,陕西 延安 716000)
胰腺癌(pancreatic cancer,PC)是全球危害最严重的恶性肿瘤之一,其发病率和死亡率分别位于恶性肿瘤的第七位和第六位。 手术切除仍是PC 患者唯一可能治愈的手段,但由于PC 早期缺乏临床症状和体征,直到晚期才被发现,导致手术效果不佳[1]。 虽然近几年免疫疗法在PC 治疗方面取得了一定的进展,但化疗仍然是PC 治疗的主要手段[2]。吉西他滨(gemcitabine,GEM)是治疗PC 的一线化疗药物,由于长期使用GEM 容易产生耐药性,导致其治疗效果不佳[3]。 因此深入研究GEM 产生耐药的原因和机制对PC 的治疗具有重要的意义。
文献报道胰腺癌吉西他滨耐药与细胞自噬、肿瘤细胞干性、 上皮- 间充质转化(epithelialmesenchymal transition,EMT) 等多种肿瘤表型密切相关[4]。 胰腺癌吉西他滨耐药具体的调控机制并不明确,明确其机制有助于改善吉西他滨的治疗效果。 长 链 非 编 码 RNA (long non-coding RNA,lncRNA)具有调控细胞自噬、肿瘤细胞干性、上皮-间充质转化( epithelial-mesenchymal transition,EMT)、细胞凋亡等多种生物学途径,研究表明lncRNA 可通过以上途径调控肿瘤细胞耐药[5]。 本文对lncRNAs 在胰腺癌耐药中的作用进行归纳总结,以期为临床提高GEM 敏感性提供理论基础,为探索新的干预靶点提供思路。
1 lncRNA
长链非编码RNA (long non-coding RNA,lncRNA)是一种大小超过200 bp 的非编码RNA,异常表达的lncRNA 与肿瘤的发生、发展密切相关,lncRNA 可以通过与DNA、RNA 以及蛋白质相互作用,调节蛋白质/RNA 稳定性[6]。 lncRNA 调节细胞生物学活动取决于其在细胞中的定位:在细胞核中lncRNA 通过染色质相互作用和重塑来调节转录程序,并通过支架建立核室的空间组织。 例如:lncRNA 作为诱饵调控蛋白与DNA 或其他蛋白的结合[7]。 lncRNA-生长停滞特异性转录物5(growth arrest-specific transcript 5, GAS5)充当诱饵,使效应蛋白与受体蛋白结合,从而使肿瘤转移和耐药[8];lncRNA 浆 细 胞 瘤 多 样 异 位 基 因(plasmacytomavariant translocation 1, PVT1)中含有几个基因内增强子,能通过调节MYC 癌基因启动子的转录,抑制MYC 癌基因的表达,从而调控肿瘤的发展与耐药[8]。 在细胞质中,lncRNA 的功能是介导信号转导途径、翻译程序和基因表达的转录后调控。 例 如: lncRNA-HOX 转录 反 义 RNA (HOX transcription antisense intergenic RNA,HOTAIR) 可以海绵化miRNA,消除lncRNA HOTAIR 对癌基因的促进作用,使肿瘤耐药[9];lncRNA ANRIL 通过染色质修饰复合物调节顺式和反式基因,以及影响microRNA 信号网络调控肿瘤的发展[10];lncRNA 作为竞争性内源RNA(ceRNAs), 可以隔离miRNA,从而阻止其靶向mRNA 的抑制,lncRNA SNHG14 被发现作为miRNA 的竞争性内源RNA,调节癌症中癌基因的表达从而调控肿瘤的发展[11];长基因间非蛋白编码RNA (reprogramming regulator, linc-ROR)首次在诱导多能干细胞(iPSCs) 中被发现,受到肿瘤多能因子的影响,从而促进肿瘤的发展[12]。 Linc-DYNC2H1-4 主要位于胞浆中,可以海绵化靶向miRNA,以恢复EMT 和CSC 相关基因的表达[13]。lncRNA 通过多种方式在表观遗传、转录、转录后、翻译和翻译后水平发挥调控作用,影响耐药性的产生,可能成为多种癌症诊断的新标记物和治疗的重要靶点。
2 lncRNA 通过调节细胞自噬调控胰腺癌吉西他滨耐药
自噬是细胞质成分在细胞内降解的一种机制,在应激条件下维持细胞内稳态。 在肿瘤中,自噬具有抑制肿瘤和支持肿瘤进展的双重作用,它参与耐药的发展,使肿瘤细胞不受化疗药物的影响,也可杀死不活跃的肿瘤细胞,因此自噬在肿瘤耐药中起到了关键作用[14]。 研究表明,胰腺癌吉西他滨耐药和自噬有着非常密切的关系,而lncRNA 在自噬调控中至关重要,通过调节自噬相关lncRNA 可恢复胰腺癌吉西他滨的敏感性[15]。 lncRNA 调节自噬的具体机制可以分为3 类:(1)lncRNA 充当竞争性内源RNA(competitive endogenous RNA,ceRNA)结合miRNA 以调节miRNA 表达,从而影响自噬进程;(2)lncRNA 通过影响自噬相关基因的表达;(3)lncRNA 通过Wnt/β-catenin 途径抑制自噬介导的细胞凋亡[16]。 构建胰腺癌吉西他滨耐药细胞株,是研究lncRNA 在胰腺癌吉西他滨耐药中作用的基础。Wang 等[17]探究lncRNA ANRIL 在胰腺癌吉西他滨耐药中的机制发现lncRNA ANRIL 通过靶向miR-181a,激活HMGB1 诱导的细胞自噬,从而增强胰腺癌细胞对吉西他滨的耐药。 Zhang 等[18]通过体外实验发现lncRNA SNHG14 通过分泌miR-101 激活胰腺癌细胞自噬增强吉西他滨耐药性。 Zhou 等[19]通过体外实验发现lncRNA PVT1 通过激活Wnt/βcatenin 和调节miR-6195p/Pygo2 以及miR-619-5p/ATG14 轴的自噬途径,从而促进胰腺癌对吉西他滨的耐药性;在体内CDX 模型中验证了lncRNA PVT1在胰腺癌吉西他滨耐药中的作用。 Li 等[20]在体外实验中发现linc-ROR 通过miR-124/PTBP1/PKM2轴诱导自噬使胰腺癌细胞对吉西他滨产生耐药;再利用PDX 模型验证了linc-ROR 在胰腺癌吉西他滨耐药中的作用。
肿瘤耐药细胞通过调节自噬增加对化疗的抵抗力,自噬在胰腺癌吉西他滨耐药中发挥着重要的作用,但目前自噬调控的机制并不明确,这给临床通过抑制自噬增加胰腺癌吉西他滨敏感性的研究带来了困扰。 已有报道称lncRNA PVT1 是一种致癌基因,作为ceRNA 或分子海绵负调控miRNA 调节自噬促进了肿瘤的发展和化疗药物耐药,lncRNA PVT1 可能通过诱导自噬调节胰腺癌吉西他滨耐药[21]。 在未来研究中lncRNA PVT1 可能成为治疗胰腺癌吉西他滨耐药的新靶点[22]。
3 lncRNA 通过调节肿瘤细胞干性调控胰腺癌吉西他滨耐药
肿瘤干细胞(cancer stem cells,CSCs) 是肿瘤细胞的一个亚群,可以驱动肿瘤的发生与复发,CSCs是肿瘤发生的来源,也是肿瘤化疗耐药的原因之一。 CSCs 对化疗和放疗均有抵抗作用,放化疗后残留的CSCs 能够促进肿瘤复发和对放化疗产生抵抗[23]。 研究发现,PC 在经过吉西他滨治疗后,胰腺癌细胞内CSCs 的含量显著增加。 lncRNAs 是CSCs的关键调控因子,能够促进肿瘤耐药[24]。 在膀胱癌中lncRNAs 通过增加CSCs 在肿瘤中的比例使化疗药物产生耐药[25]。 综上所述lncRNA、CSCs 和耐药这3 者可能有着密切的关系。 Liu 等[26]采用胰腺癌细胞株PANC-1、ASPC-1、CAPAN-2、SW19990,通过实验发现lncRNA GAS5 能逆转CSCs 介导的吉西他滨耐药。 Wang 等[27]构建胰腺癌PANC-1 吉西他滨耐药细胞株,通过实验发现吉西他滨通过诱导lncRNA HOTAIR 表达进而诱导胰腺癌干细胞耐药。Gao 等[28]分别建立了人胰腺癌BxPC-3-Gem 耐药细胞和PDX 模型,体内外实验发现linc-DYNC2H1-4通过分泌miR-145 促进CSCs 使胰腺癌吉西他滨耐药。 LncRNA 不止是可以通过促进肿瘤细胞干性促进肿瘤细胞产生耐药,部分lncRNA 也可通过调节肿瘤细胞干性逆转耐药。 Yoshida 等[29]建立BxPC3耐药株CDX 模型,通过实验发现lncRNA PVT1 通过调控胰腺癌细胞中CSCs 的含量逆转胰腺癌细胞对吉西他滨的耐药性。
综上所述,CSCs 与胰腺癌吉西他滨耐药有着密切的联系,研究CSCs 与吉西他滨耐药的关系,可为临床上治疗胰腺癌吉西他滨耐药提供新的思路和方法。 目前,在乳腺癌耐药中,通过调控CSCs 信号通路的药物已进入临床试验阶段[30]。 已有研究证明lncRNA PVT1 可在体外和体内增强肝CSC 能力,主要通过稳定核仁蛋白NOP2 介导肝细胞获得干细胞样特性,研究发现lncRNA PVT1 具有调节肿瘤细胞干性的作用[31],lncRNA PVT1 通过调节肿瘤细胞干性调控胰腺癌吉西他滨耐药,可能为以后临床上肿瘤干性程度高的胰腺癌治疗提供了潜在的靶点。
4 lncRNA 通过调节EMT 调控胰腺癌吉西他滨耐药
上皮细胞-间充质细胞转变(EMT)是一种使细胞和细胞粘附复合物松散并增强细胞的转移和侵袭特性的胚胎程序。 肿瘤细胞需要经历这个转变过程而实现转移,同时使肿瘤细胞获得更强的侵袭性以及对细胞凋亡的抵抗性[32]。 研究发现吉西他滨耐药细胞表现出更强的侵袭性,这有可能和肿瘤耐药之后发生EMT 相 关[33]。 lncRNA 可 通 过 内 源 性 竞 争miRNA,调控与EMT 相关的一些转录因子的表达,进而影响EMT 进程[34]。 如在胆囊癌中,lncRNA 通过调控EMT,促进胆管肿瘤细胞吉西他滨耐药[35]。 在胰腺癌中,Liu 等[26]分别使用胰腺癌细胞株PANC-1、ASPC-1、CAPAN-2、SW19990 进行体外实验,发现lncRNA GAS5 通过靶向miR-221/SOCS3 逆转EMT 介导的胰腺癌吉西他滨耐药。 Gao 等[28]建立人胰腺癌BxPC-3-Gem 耐药细胞和肿瘤异种移植模型,发现linc-DYNC2H1-4 通过分泌miR-145 促进胰腺癌细胞EMT 使胰腺癌吉西他滨耐药。
对比肿瘤细胞和肿瘤耐药细胞发现肿瘤耐药细胞表现出了更强的侵袭性,这有可能和EMT 有关。 LncRNA 具有调控EMT 的作用,需要找出调控EMT 的关键lncRNA,研究表明lncRNA GAS5 是调节EMT 的关键分子,lncRNA GAS5 可作为miRNA或剪切因子的诱饵,通过靶向结合miRNA 而负性调控miRNA 下游靶基因的表达调控EMT[36],这可能为临床上治疗EMT 程度高的胰腺癌吉西他滨耐药提供新的靶点。
5 总结与展望
胰腺癌被称为“癌王”,5 年内生存率极低,化疗预后差,准确评估患者状况是胰腺癌患者治疗最重要的环节,因此找到胰腺癌吉西他滨耐药的生物标志物有着重要的意义。 目前lncRNA 表达对患者预后的研究发现癌组织和血清中的lncRNA 与癌旁组织有着明显的差异,而癌组织和血清中的lncRNA表达呈正相关,再通过生存曲线分析血清中lncRNA表达与癌症患者预后的关系。 因此,将以上lncRNA进行分析对比,以期寻找到胰腺癌吉西他滨耐药的预后标志物。 近几年测定患者唾液中lncRNA 水平并探讨其作为胰腺癌的早期生物学指标的价值取得了令人满意的成果,提示我们可以从患者体液,如唾液、尿液、血液等标本获取lncRNA,从而提高其临床应用的可行性[37]。
研究表明胰腺癌吉西他滨耐药与lncRNA 关系密切,不同的lncRNA 通过不同的途径发挥各自的作用(见表1)。 大多数lncRNA 在胰腺癌吉西他滨耐药中上调,通过直接或间接的调节相关基因的表达影响胰腺癌吉西他滨耐药。 其中也有单个lncRNA 通过调节多个表型发挥作用,例如:lncRNA PVT1 可以通过调节自噬和CSCs 促使胰腺癌吉西他滨耐药,lncRNA GAS5 也可通过调节CSCs 和自噬促进胰腺癌吉西他滨耐药。 通过揭示不同lncRNA 在胰腺癌吉西他滨耐药中的具体作用机制,可为临床治疗胰腺癌吉西他滨耐药带来新的靶向药物。 比如lncRNA H19 的靶向药物BC-819(DTAH19),目前正在进行包括PC 在内的人类恶性肿瘤的临床试验[38]。 目前临床上PC 早期生物标志物的缺乏和获得性耐药是PC 治疗的难点,因此,迫切需要寻找一种新的肿瘤生物标志物和治疗靶点来进行早期诊断和治疗。 未来应大量开展胰腺癌动物模型实验,进一步深入研究lncRNA 的潜在机制,发现具有肿瘤耐药后特异性表达的lncRNA,基于特定lncRNA 的表达情况对化疗药物的效果进行评判,这将是未来临床上治疗PC 所要突破的重点问题。 综上所述,发现lncRNA PVT1 可以调控多个表型调节胰腺癌吉西他滨耐药,并在不同的胰腺癌吉西他滨耐药细胞株得到了验证。 期望在未来,基于lncRNA PVT1 在胰腺癌吉西他滨耐药中的研究可以在临床上取得重要的突破。
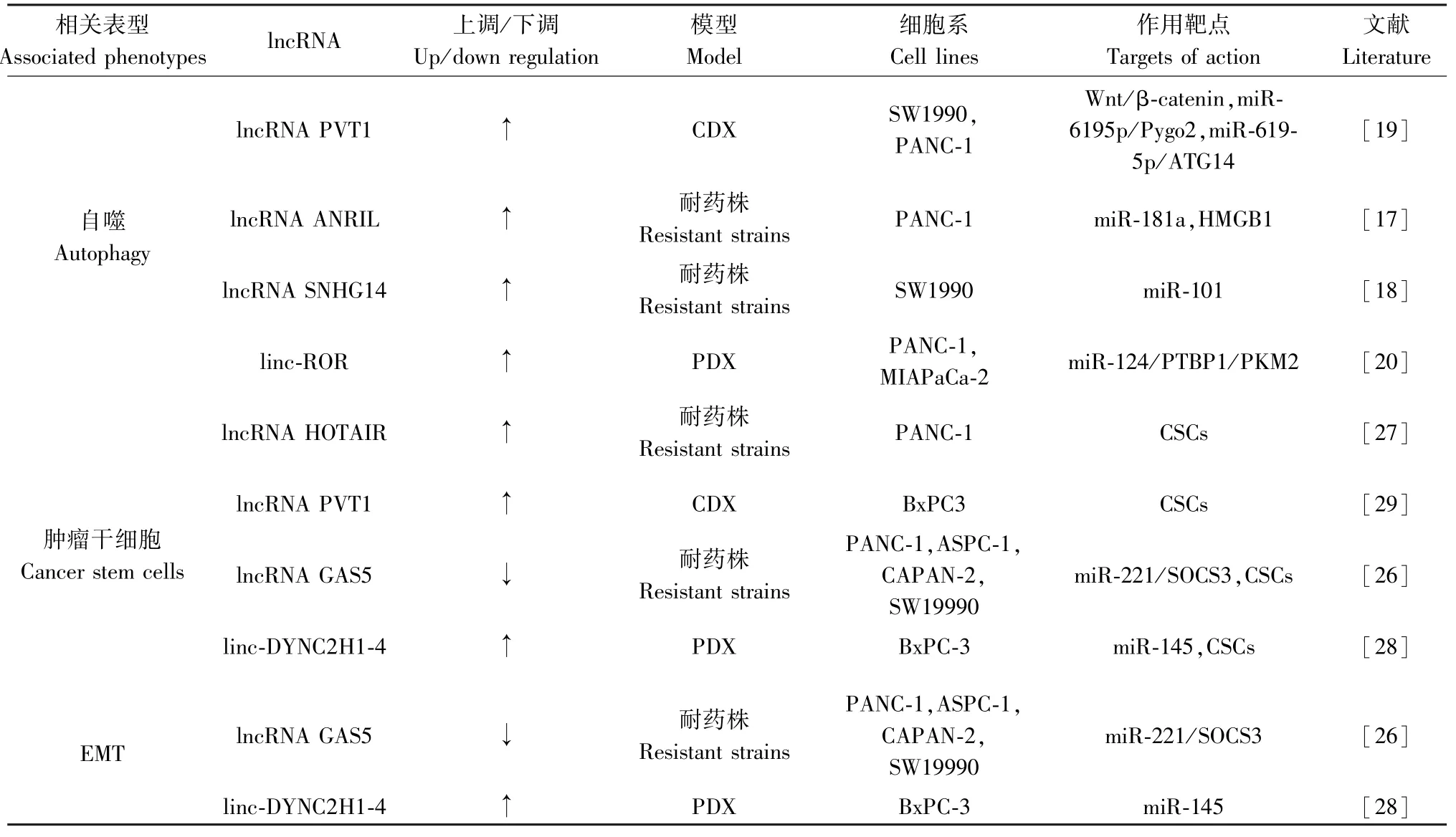
表1 lncRNA 在胰腺癌吉西他滨耐药中的作用机制Table 1 The mechanism of lncrna in gemcitabine resistance of pancreatic cancer
