槲皮素通过Pink1/Parkin 信号通路减轻阿霉素心肌损伤的作用机制研究
2022-08-16红王少玮谢文静周俊蒋书云刘金成杨剑金
郭 红王少玮谢文静周 俊蒋书云刘金成杨 剑金 屏
(空军军医大学西京医院心血管外科,西安 710032)
阿霉素(doxorubicin,Dox)是一种有效的蒽环类抗生素,可用于治疗白血病、淋巴瘤和多种实体肿瘤[1],但其剂量依赖性的心脏毒副作用限制了Dox的临床应用[2]。 Dox 引起的心脏毒性是一种复杂的包括线粒体氧化应激在内的多因素过程,主要表现为线粒体功能被抑制,进而导致心肌细胞损伤[3]。
线粒体约占心肌细胞体积30%以上,以满足心脏持续的能量需求[4]。 线粒体质量控制是调控线粒体大小、形态及生物活性等的重要调控机制[5-6],当受损的线粒体不能恢复到健康状态时,线粒体自噬(mitophagy)便成为细胞凋亡和坏死之前移除受损的线粒体并维持细胞活力的最后保障[7]。 其中丝氨酸/苏氨酸激酶1(Pink1)及E3 连接酶Parkin介导的线粒体自噬在Dox 诱导心肌毒性线粒体功能障碍的消除中起关键作用[8],然而其机制尚待进一步阐明。
槲皮素(Quercetin, Que)属于一种黄酮类化合物,存在于多种蔬菜食品包括苹果、红茶、绿茶、洋葱、红酒、红葡萄、柑橘类水果、樱桃、不同浆果如覆盆子、越橘和蔓越莓、花椰菜和其他多叶绿色蔬菜中[9]。 在植物中由苯丙氨酸经苯丙烷途径产生,具有抗癌、抗糖尿病、抗炎和抗氧化(清除自由基)等多种生物学功能[10-11]。 有研究证实,Que 可通过酸水解法及酶转化法等方法进行分离提纯,并通过绘制标准溶液曲线,以紫外分光光度计法进行浓度测定[12]。 此外,Que 对于心血管疾病具有重要的预防和治疗效果[13],如Que 对Dox 诱导的心脏毒性的保护作用[14],然而其对心肌细胞的保护作用是否通过Pink1/Parkin 依赖的线粒体自噬未见报道。
本研究拟建立Dox 诱导的小鼠及nmCMs 细胞毒性模型[15],验证Pink1/Parkin 依赖的线粒体自噬在Que 缓解Dox 心肌毒性中的具体作用机制。
1 材料和方法
1.1 实验动物
所有的实验方案均经第四(空军)军医大学实验动物中心福利与伦理委员会的批准(20200445),并按照美国国立卫生研究院实验动物使用指南实施。 本研究中使用SPF 级,8 周龄,体重为20~22 g 的雄性C57BL/6J 小鼠,共计40只;1~3 d(1.5~2 g)大小的C57BL/6J 乳鼠(SPF级),共计50 只。 均由空军军医大学动物实验中心饲养并提供[SCXK(陕)2019-001][SYXK(陕)2019-001],在研究中均遵循3R 原则。
1.2 主要试剂与仪器
Que 标准品(货号:SQ8030) 及Que(货号:Q8010)均购买自Solarbio 公司(中国);CCK-8 细胞毒性检测试剂盒购自南京建成生物工程研究所(货号:G021-1);DOX 购自Tocris 公司(Bristol,英国,货号:2252);辣根过氧化物酶标记的山羊抗兔(货号:ZB2301)、山羊抗鼠(货号:ZB-2305)二抗购自北京中山金桥生物技术有限公司;胎牛血清(货号:16010159)、双抗(货号:15140163)、DMEM 培养基(货号:11965092) (美国)、GAPDH 抗体(货号:51332)、Pink1(货号:46421)、Parkin(货号:4211)、P62(货号:23214)、LC3(货号:4108)及Beclin1(货号:3495)购自CST 公司(美国);线粒体自噬激动剂SB-203580(货号:HY-10256)及线粒体自噬抑制剂3-Methyladenine (3 MA) (货号:HY-19312) 购自MedChemExpress (MCE,美国);Pierce 原代心肌细胞分离试剂盒(thermo fisher scientific,美国);线粒体分离试剂盒(abcam,美国);蛋白酶抑制剂(南京建成,中国);Bradford 试剂盒(Pierce Biotechnology,美国)。 Olympus 荧光显微镜(Olympus,日本);Image Lab(Bio-Rad 公司,美国);SpectraMax M5 分光光度计(美国)。
1.3 实验方法
1.3.1 小鼠在体实验与原代心肌模型建立及实验分组
将Dox 以磷酸盐缓冲液(phosphate buffer saline, PBS)溶解后制成10 mmol/L 储备液。 实验动物随机分为如下4 组:(1)对照组(Con):实验小鼠以正常饮食喂养。 (2)槲皮素处理组(Que):小鼠以50 mg/kg Que 灌胃处理1 周[16]。 (3)阿霉素组(Dox):小鼠隔天以3 mg/kg 剂量腹腔注射Dox,持续2 周。 (4)阿霉素-槲皮素组(Dox-Que):小鼠以50 mg/kg Que 灌胃处理1 周,随后隔天以3 mg/kg剂量腹腔注射Dox,持续2 周。 所有药物处理结束后饲养4 周。 离体实验将分离的乳鼠心肌原代细胞(nmCMs)细胞以随机数字表法随机组,药物处理情况如下:(1)对照组(Vehicle):nmCMs 细胞未作任何处理。 (2)槲皮素组(Que):nmCMs 细胞分别以10 μmol/L 或20 μmol/L Que 预处理22 h。 (3)阿霉素组(Dox):nmCMs 细胞以10 μmol/L Dox 及DMSO 稀释液共同处理24 h[17]。 (4)阿霉素-槲皮素组(Dox-Que):nmCMs 细胞以20 μmol/L Que 预处理22 h[18],再以10 μmol/L Dox 及DMSO 稀释液共同处理24 h。 (5)阿霉素-槲皮素-线粒体自噬激动剂组(Dox-Que-SB):nmCMs 细胞以20 μmol/L Que 预处理22 h,再以10 μmol/L Dox 及10 μmol/L SB 共同处理24 h。 (6)阿霉素-线粒体自噬激动剂组(Dox-SB):nmCMs 细胞以10 μmol/L Dox 及10 μmol/L SB 共同处理24 h。 (7)阿霉素+3-甲基腺嘌呤组(Dox-3 MA),nmCMs 细胞以10 μmol/L Dox 处理16 h 随后以5 mmol/L 3 MA 共同处理8 h[19]。(8)线粒体自噬激动剂组(SB):nmCMs 细胞以10 μmol/L SB 处理24 h。
1.3.2 乳鼠心肌原代细胞分离培养
采用Pierce 原代心肌细胞分离试剂盒分离1~3 d 大小的C57BL/6J 小鼠心肌原代细胞[20]。 新生小鼠心脏解剖后,立即与心肌细胞分离酶1 和酶2在37℃孵育30~35 min,Hanks 平衡盐溶液洗涤两次,然后转移至DMEM 高糖培养基中。 将分离的乳鼠心肌细胞置于培养皿中,37℃,5% CO2孵育,剩余的组织以相同的方法处理,直到没有残留。 混合细胞悬液,收集非贴壁细胞并计数,随后将细胞转移至10%胎牛血清(fetal bovine serum,FBS)、青霉素(100 U/mL)和链霉素(100 μg/mL)的DMEM 中。以进行下一步实验。
1.3.3 成鼠心肌组织及nmCMs 细胞线粒体分离
使用线粒体分离试剂盒分离成年小鼠心肌组织及nmCMs 线粒体。 所有程序都按照操作说明进行。 剪碎心肌组织,nmCMs 用预冷的PBS 缓冲液清洗。 在3000 r/min 的转速下,将上清液转移到新管中。 在12377 r/min 的转速下再次离心,收集含有胞浆蛋白的上清液。 然后将含有线粒体的颗粒在添加蛋白酶抑制剂混合物的分离缓冲液中清洗,并在12377 r/min 的转速下收集以供进一步使用。
1.3.4 线粒体膜电位(mitochondrial membrane petential,MMP)检测
利用阳离子荧光染料JC-1 对线粒体膜电位进行检测。 用药物处理后,将细胞与JC-1 工作液在37℃,避光孵育30 min,随后以PBS 清洗3 次,再以SpectraMax M5(美国)分光光度计读取数值。 数据以药物处理组与对照组的比值表示。
1.3.5 Western blot 检测
使用预冷的RIPA 裂解缓冲液处理nmCMs 细胞。 采用Bradford assay 试剂盒测定蛋白质含量。将处理后的细胞分别收集提取细胞总蛋白,以SDSPAGE 凝胶电泳分离蛋白样本,随后转移至PVDF膜,之后以5 g/100 mL 脱脂牛奶在室温下孵育2 h,再加入相应的一抗抗体于4℃孵育过夜。 TBST 清洗3 次,每次10 min,与兔二抗孵育2 h。 再次清洗后用化学发光系统进行检测,蛋白定量分析使用Image Lab 软件(Bio-Rad)。
1.3.6 ATP 水平检测
按照操作说明分离nmCMs 细胞线粒体后,随后以ATP 检测试剂盒检测线粒体内ATP 含量。
1.3.7 细胞活力检测
将分离的nmCMs 接种于96 孔板,接种浓度为5×103个/孔,以前述方法分别进行处理后,避光向各孔中加入10 μL CCK-8 溶液,37℃孵育90 min 后在450 nm 波长下测量OD 值。 细胞活力以药物组细胞OD 与Con 组细胞OD 分别减去空白OD 值后的比值表示。
1.3.8 组织病理学分析
小鼠麻醉后,去除心脏并以PBS 冲洗,随后将心脏组织于4%多聚甲醛中固定3 d,再以石蜡包埋后切 成 3 μmol/L 切 片, 苏 木 精 伊 红 染 色(hematoxylin and eosin,HE),并以Masson’s 三色染色法评估心肌纤维化程度。 染色结果以Image J 软件定量后分析。
1.4 统计学方法
所有值均以平均数±标准误差(±s¯x)表示。实验组之间的差异是通过单向或双向ANOVA 分析确定,然后进行Tukey post hoc 检验。t检验用于组间单因素比较。P<0.05 认为差异具有统计学意义。
2 结果
2.1 Que 对Dox 处理后心肌形态学改变及对ROS生成、MMP 及线粒体ATP 含量的影响
心脏组织的组织病理学检查显示,Con 组和Que 治疗组小鼠的心肌形态和肌原纤维正常(图1A、1B)。 在Dox 处理的心脏切片中观察到肌原纤维变性和破坏。 Que 处理显著改善了Dox 诱导的这些损伤。 Masson’s 三色染色的进一步研究显示,与正常对照组相比,Dox 处理显著诱导心肌纤维化,而用Que 治疗的心肌纤维化在Dox 处理的心脏组织中被显著抑制(图1A~1C)。 心肌纤维化定量分析显示Que 能显著降低Dox 诱导的心肌纤维化(P<0.05)。 如图1D,相对于Con 组,Dox 可显著增加心肌组织的ROS 生成,Que 预处理可降低ROS 生成量(P<0.05),而Que 单独处理未见对ROS 生成有显著改变。 对不同处理条件的小鼠心肌组织检测发现,Dox 处理相对于Con 组,可显著降低MMP 含量及线粒体ATP 生成量(P<0.05),这种降低的趋势可被Que 预处理逆转(P<0.05)(图1E~1F)。
2.2 Que 对线粒体自噬关键蛋白表达的调节作用
对不同处理组线粒体自噬标志蛋白的检测发现,如图2 所示,Dox 处理相对于Con 组,可显著增加Pink1/Parkin 依赖的线粒体自噬及标志蛋白Beclin1 及LC3II 的表达而降低P62 蛋白表达量(P<0.05),以促进线粒体自噬的激活,Que 可通过抑制Pink1/Parkin 依赖的线粒体自噬的激活Pink1/Parkin 依赖的线粒体自噬(P<0.05),保护小鼠心肌组织抵抗Dox 引起的细胞毒性。
2.3 Que/SB 对nmCMs 细胞活力及LDH 活性的影响
如图3A 所示,10 μmol/L Dox 处理6 h 可见细胞活力较未加入Dox 或Que 组显著降低,加入20 μmol/L 预处理后,可显著增加细胞活力以逆转Dox引起的细胞毒性损伤(P<0.05),而Que 单独处理未见对nmCMs 细胞有显著影响。 通过对不同处理组细胞培养上清液的检测发现(图3B),Dox 可引起LDH 浓度的显著增加,加入20 μmol/L Que 后LDH浓度较单独加入Dox 后显著降低(P<0.05),但这种降低趋势并未随Que 浓度增加而改变。 此外,SB 单独处理并未改变nmCMs 细胞活力(图3C)。
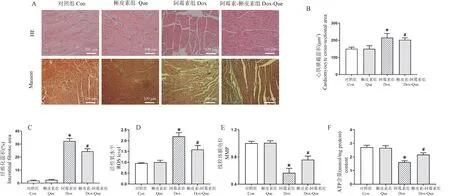
注:A:Que 对Dox 诱导的心肌组织形态及纤维化的影响。 上侧表示HE 染色,下侧表示Masson 染色;B:心肌细胞横截面积;C:心脏纤维化区域;D:ROS 水平;E:线粒体膜电位;F:ATP 含量。 与对照组相比, ∗P<0.05;与槲皮素组相比, #P<0.05。图1 Que 可显著减轻Dox 引起的心肌纤维化,降低ROS 生成与上调MMP、ATP 含量(n=5)Note.A, Effects of Que on cardiac morphology and fibrosis in Dox-induced cardiomyopathy.The upper panel represents images with HE staining, the lower panel indicates cardiac fibrosis with Masson’s trichrome staining.B, Cardiomyocyte cross-sectional area.C, Cardiac fibrosis area.D, ROS level.E, MMP production.F, ATP content.Compared with Con group, ∗ P<0.05.Compared with Dox group, # P<0.05.Figure 1 Que treatment significantly attenuates Dox-induced cardiotoxicity, reducing ROS level and increasing MMP and ATP content
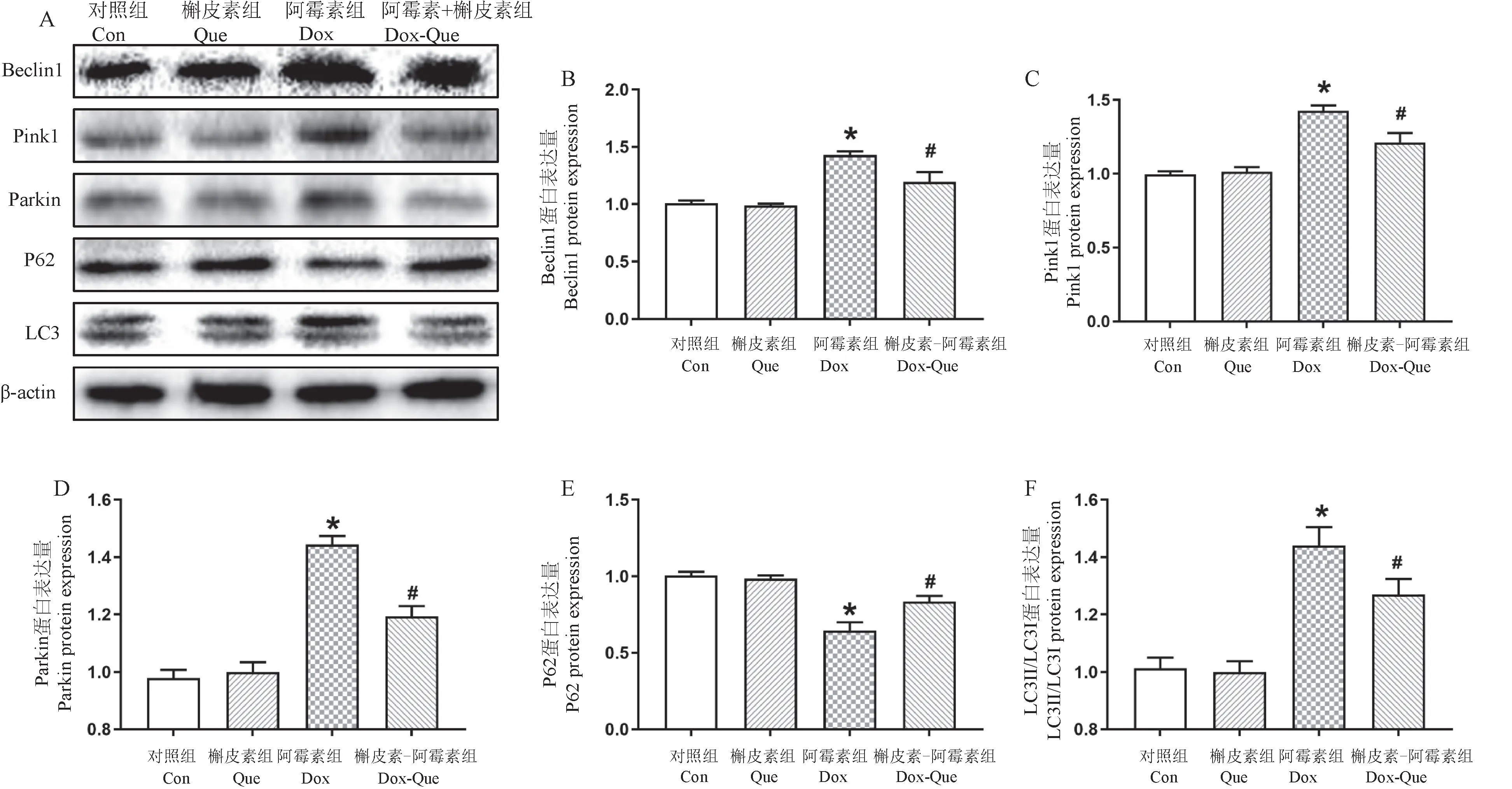
注:A:用Western blot 对不同组的代表性蛋白图像进行分析;B~F:Beclin1、Pink1、Parkin、P62 和LC3 的表达。 与对照组相比, ∗P<0.05;与槲皮素组相比, #P<0.05。图2 Que 对心肌组织中线粒体自噬标志蛋白表达的影响(n=3~5)Note.A, Representative protein images by Western blot from different groups.B~F, Expression of Beclin1, Pink1, Parkin, P62 and LC3.Compared with Con group,∗ P<0.05.Compared with Dox group, # P<0.05.Figure 2 Que alleviates mitophagy marker protein expression in myocardial
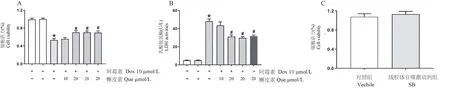
注:A:Dox 和Que 对细胞活力的影响;B:Dox 和Que 对LDH 活性的影响;C:SB(SB-203580)对细胞活力的影响。 与对照组相比, ∗P<0.05;与槲皮素组相比, #P<0.05。图3 Dox、Que 及SB 对细胞活力与LDH 的影响(n=3~5)Note.A, The effective of Dox and Que on cell viability.B, The effective of Dox and Que on LDH activity.C, The effective of SB on cell viability.Compared with Vechile group,∗P<0.05.Compared with Dox group, # P<0.05.Figure 3 Effect of Que, Dox and SB on cell viability and LDH activity
2.4 Que/SB 对Dox 诱导下nmCMs 细胞ROS 生成、MMP 及线粒体ATP 生成量的影响
如图4A 所示,相对于Dox 组,Que 预处理可显著降低LDH 含量(P<0.05),而SB 加入则部分抵消了Que 对LDH 活性的抑制作用(P<0.05)。 如图4B 所示,与Dox 组相比较,Que 预处理可显著降低线粒体ROS 生成,而SB 则降低了Que 对ROS 生成的抑制作用(P<0.05),单独加入SB 未见对Dox 处理细胞线粒体ROS 生成有显著改变。
此外(图4C、4D),对不同条件下细胞MMP 及ATP 含量的检测发现,Que 预处理可显著增加nmCMs 细胞MMP 及ATP 生成(P<0.05),而SB 可部分抵消Que 对MMP 及ATP 生成的促进作用(P<0.05)。 SB 对Dox 处理的nmCMs 细胞MMP 及ATP生成则未见改变。
2.5 Pink1/Parkin 依赖的线粒体自噬对Dox 引起的心肌细胞毒性具有重要的调节作用
如图5 所示,nmCMs 细胞分别以Dox、Que 或SB 处理后,对线粒体自噬相关蛋白的检测发现,Dox可通过激活Pink1/Parkin 介导的线粒体自噬,诱导细胞损伤,以Que 预处理则可部分抵消Dox 诱导的细胞毒性,这种保护作用是通过抑制线粒体自噬的激活而实现的。 而SB 则通过促进Pink1/Parkin 的激活,进而显著逆转Que 对Dox 诱导的细胞毒性的保护作用。 此外,通过线粒体自噬抑制剂3 MA 处理nmCMs 细胞后发现,Que 及3 MA 均可显著抑制Dox 诱导的线粒体自噬,降低心肌细胞损伤(图6)。提示Que 抵抗Dox 诱导的细胞毒性是通过Pink1/Parkin 依赖的线粒体自噬实现的。
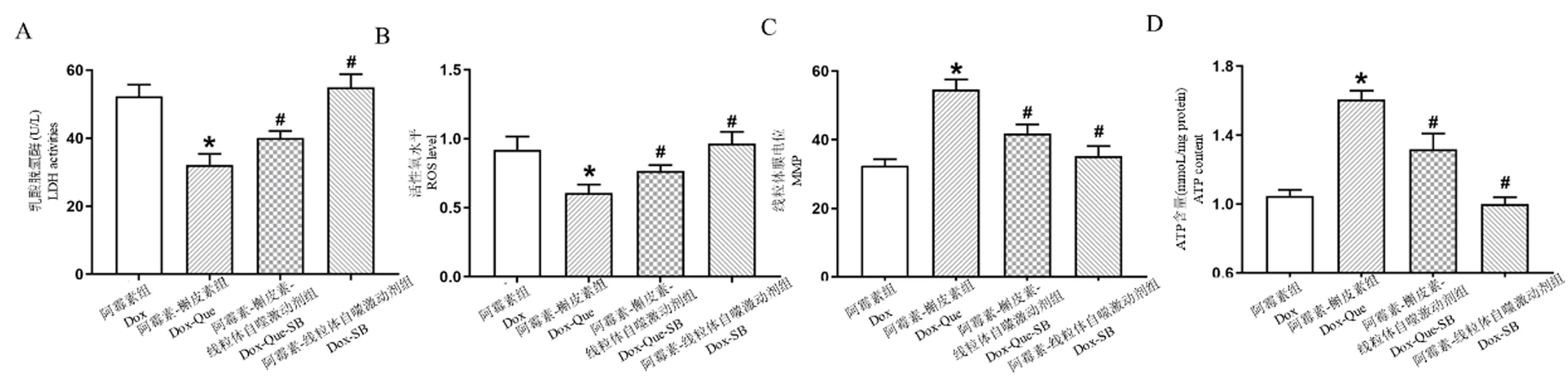
注:A:乳酸脱氢酶活性;B:ROS 水平;C:线粒体膜电位产生;D:ATP 含量。 与阿霉素组相比, ∗P<0.05;与阿霉素-槲皮素组相比, #P<0.05。图4 Que 通过调节LDH、ROS、MMP 及ATP 含量抵抗Dox 诱导的心肌细胞损伤(n=3~5)Note.A, LDH activities.B, ROS level.C, MMP production.D, ATP content.Compared with Dox group,∗ P<0.05.Compared with Dox-Que group, # P<0.05.Figure 4 Que protected nmCMs against Dox-induced cardiomyocytes injury via regulating LDH level, ROS level, MMP and ATP content

注:A:用Western blot 对不同组的代表性蛋白图像进行分析;B~F:Beclin1、Pink1、Parkin、P62 和LC3 的表达。 与阿霉素组相比, ∗P<0.05;与阿霉素-槲皮素组相比, #P<0.05。图5 Que 通过抑制Pink1/Parkin 介导的线粒体自噬,缓解Dox 诱导的心肌细胞损伤(n=3~5)Note.A, Representative protein images by Western blot from different groups.B~F, Expression of Beclin1, Pink1, Parkin, P62 and LC3.Compared with Dox group, ∗P<0.05.Compared with Dox-Que group, # P<0.05.Figure 5 Que protects mitochondrial hemostasis by inhibiting Pink1/Parkin-dependent mitophagy against Dox-induced cardiotoxicity
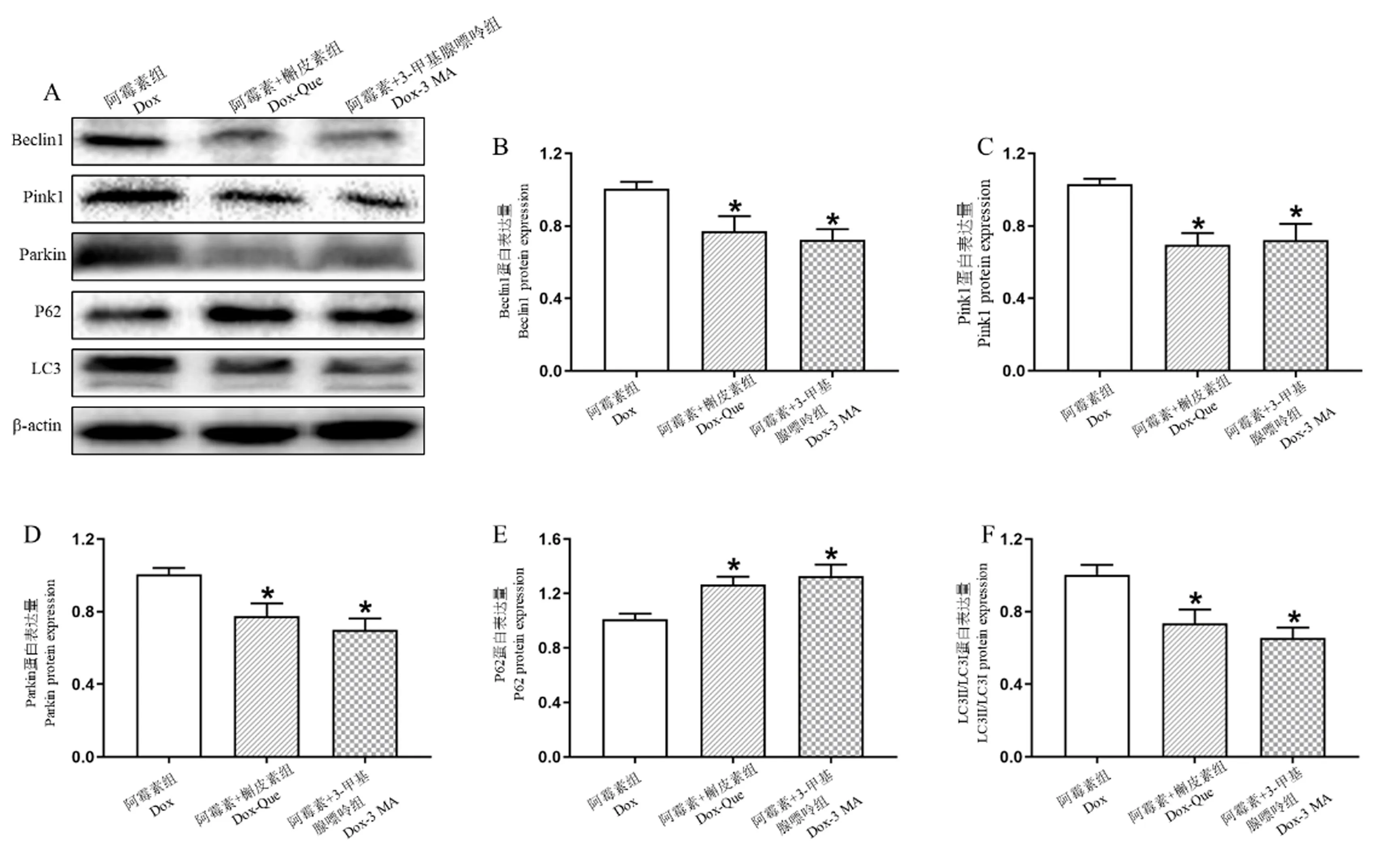
注:A:用Western blot 对不同组的代表性蛋白图像进行分析;B~F:Beclin1、Pink1、Parkin、P62 和LC3 的表达。 与阿霉素组相比,∗P<0.05。图6 Que 及3 MA 均可显著抑制Pink1/Parkin 介导的线粒体自噬,缓解Dox 诱导的心肌细胞损伤(n=3~5)Note.A, Representative protein images by Western blot from different groups.B ~ F, Expression of Beclin1, Pink1, Parkin, P62 and LC3.Compared with Dox group,∗ P<0.05.Figure 6 Que and 3 MA significantly inhibited Pink1/Parkin-dependent mitophagy against Dox-induced cardiotoxicity
3 讨论
本研究通过对小鼠及分离的nmCMs 细胞建立Dox 损伤模型后发现,Que 可保护小鼠心肌组织nmCMs 细胞并降低Dox 对细胞的毒性作用,降低纤维化,其作用机制主要是通过抑制Pink1/Parkin 介导的线粒体自噬与降低线粒体ROS 产生,及促进ATP 合成量的增加来实现的。 我们的研究结果证实,Pink1/Parkin 介导的线粒体自噬有助于Que 保护小鼠心脏功能并抵抗Dox 诱导的心肌毒性,从而为临床用药提供部分理论参考。
Dox 诱导的心肌毒性主要机制之一便与线粒体功能障碍有关,导致细胞内ROS 增加和氧化应激。线粒体是细胞暴露于Dox 后受损最严重的细胞内细胞器,其内膜中Dox 积累的重要因素之一是与心磷脂的高亲和力结合有关,后者已知可维持线粒体的结构、功能、能量代谢和细胞存活[21]。 我们的研究证实,Dox 诱导可显著降低心肌组织/细胞ATP 含量及增加线粒体ROS 生成,而Que 预处理可通过增加线粒体ATP 生成及降低ROS 生成抵抗Dox 诱导的细胞毒性,降低心肌纤维化程度。
线粒体自噬是一个进化上保守的细胞进程,能去除功能失调或多余的线粒体,以维持线粒体功能稳态[22]。 Pink1 是2001 年发现的一种丝氨酸/苏氨酸激酶,在其N 端含有一个线粒体靶向序列(mitochondrial targeting sequence, MTS),在跨膜结构域(transmembrane domain, TMD)旁边还存在一个外部线粒体定位信号( outer mitochondrial localization signal, OMS)。 Parkin 是1998 年发现的一种E3 泛素化连接酶,细胞功能正常时,由于线粒体内吞、蛋白酶切割和蛋白酶体降解,Pink1 持续维持在低水平,在细胞损伤时Pink1 则积累于线粒体外膜并从胞浆中招募Parkin 于线粒体,从而激活线粒体自噬[23]。 Pink1 依赖的线粒体自噬在细胞重编程过程中防止线粒体蓄积起关键作用[24]。 且线粒体质量控制对于心脏功能调节及防止疾病损伤和发展至关重要。 如在心肌梗死后,Parkin 介导的线粒体自噬对心脏具有保护作用,缺乏Parkin 的小鼠对心肌梗死更敏感,并且心脏中线粒体功能异常。另一项研究表明,Pink1/Parkin 途径的激活可调节线粒体自噬,抵抗脓毒症导致的心功能损伤[24]。 此外,Pink/Parkin 介导的线粒体自噬异常与Dox 诱导的心肌细胞毒性显著相关[8]。 因此,线粒体自噬的调节对心脏功能的维持具有重要作用。 我们的研究证实,Dox 诱导可显著激活线粒体自噬,即上调线粒体自噬标志蛋白Pink1、Parkin、及LC3II 的表达而抑制P62 蛋白活性,Que 预处理则显著降低Pink1、Parkin、及LC3II 的表达与增加P62 的蛋白表达量,提示Pink1/Parkin 介导的线粒体自噬在Que 抵抗Dox 诱导的线粒体损伤中有非常重要的作用。
Que 是一种天然的多酚化合物,在饮食中含量丰富。 Que 已被证明对人体具有许多有益的作用,包括在心血管系统如心脏的缺血再灌注(ischemic reperfusion, I/R)损伤中具有重要的保护作用[16,25]。Que 对蒽环类药物诱导的心脏毒性或其他类型的心脏疾病的保护作用主要通过其抗氧化、抗炎作用实现的[26]。 且已被众多的研究证实,在对啮齿动物的研究中发现,在给与Dox 前5~7 d 口服Que,可显著缓解前者引起的心肌毒性进而预防心功能损伤[9]。在对SD 大鼠接受为期2 周的Dox 治疗中发现,在化疗前15 d 并在化疗期间同时每日给予高剂量Que,可显著降低血清肌酸激酶同工酶(CK-MB)和乳酸脱氢酶(LDH)水平以,以改善Dox 引起的心功能损伤[14]。 我们的研究表明,Que 预处理可以降低Dox 诱导的ROS 生成增加及促进线粒体ATP 生成。此外,Que 的心肌保护作用被证实与缓解线粒体功能损伤具有重要相关性[18]。 我们在研究中发现,Dox 可诱导心肌组织/细胞线粒体自噬相关蛋白Pink1、Parkin 及LC3 的激活与P62 活性降低,Que预处理后可部分缓解Dox 损伤状态下,Pink1/Parkin依赖的线粒体自噬的激活,保护线粒体功能免受Dox 诱导的细胞毒性损伤,而这种保护作用可被线粒体自噬激活剂SB 而抵消。
我们的研究结果证实,Que 对Dox 诱导的心肌毒性具有保护作用。 其潜在的保护作用机制是通过抑制Pink1/Parkin 依赖的线粒体自噬实现的。SB 处理可部分抵消Que 的保护作用。 且3 MA 与Que 处理均可显著降低心肌细胞线粒体自噬。 因此,Pink1/Parkin 介导的线粒体自噬可能为Dox 诱导的心肌毒性的潜在治疗靶点。 此外,由于Que 来源广泛且易于获得,对Que 的心肌保护作用进行深入研究,有望成为减轻抗癌药物Dox 引起的心肌毒性的重要治疗策略。
