酸枣仁-五味子配伍对抗焦虑作用的影响及指标成分的肠吸收特性研究
2022-08-16刘金凤王晓玫李佳园魏晓嘉王雨青于佳禾金重先王春国石晋丽
刘金凤,王晓玫#,李佳园,杨 雪,魏晓嘉,王雨青,吕 研,于佳禾,金重先,王春国,石晋丽*
酸枣仁-五味子配伍对抗焦虑作用的影响及指标成分的肠吸收特性研究
刘金凤1,王晓玫1#,李佳园1,杨 雪1,魏晓嘉1,王雨青1,吕 研1,于佳禾1,金重先1,王春国2*,石晋丽1*
1. 北京中医药大学中药学院,北京 102488 2. 北京中医药大学中医药研究院,北京 102488
研究酸枣仁-五味子配伍前后的抗焦虑药效变化及指标成分斯皮诺素、五味子醇甲在焦虑模型大鼠小肠中的吸收特性变化。采用空瓶应激(empty bottle stress,EBS)和孤养结合束缚应激(restraint stress,RS)2种焦虑大鼠模型,通过旷场和高架十字迷宫实验评价酸枣仁-五味子配伍前后的抗焦虑药效;大鼠离体外翻肠囊实验和在体单向肠灌流实验结合HPLC法,测定配伍前后酸枣仁中斯皮诺素和五味子中五味子醇甲在焦虑模型大鼠十二指肠、空肠、回肠及整个小肠段的吸收情况。行为学实验表明酸枣仁、五味子均能减少焦虑模型大鼠的焦虑样行为,二者配伍后焦虑样行为的减少更为显著。在外翻肠囊实验中,五味子醇甲的吸收量比斯皮诺素约高1个数量级;配伍后斯皮诺素的吸收量下降,而五味子醇甲吸收量明显增加,表现在十二指肠、空肠和总吸收量的增加,并且其在空肠和回肠中的稳定性增加。在肠灌流实验中,给药30 min内,斯皮诺素基本完全吸收,但在酸枣仁单用时可能出现外排,配伍后外排减弱;给药1 h内,五味子醇甲基本完全吸收,未表现外排;配伍后斯皮诺素和五味子醇甲的吸收速率常数(a)和表观渗透系数(app)均保持较高水平。酸枣仁-五味子配伍后抗焦虑药效有所增强;配伍增加了斯皮诺素的溶出,减少了其外排,但降低了其吸收;配伍促进了五味子醇甲的吸收,增加了其在空肠和回肠的稳定性。从肠吸收屏障网络的角度揭示酸枣仁、五味子抗焦虑药效的发挥与其中的药效成分斯皮诺素、五味子醇甲在小肠保持良好的吸收密不可分,酸枣仁与五味子配伍后抗焦虑作用的增强可能与提高五味子醇甲在空肠和回肠的稳定性、增加五味子醇甲的吸收有关,这一结论为临床用药提供了科学依据。
肠吸收;焦虑症;斯皮诺素;五味子醇甲;酸枣仁;五味子;配伍
焦虑症(anxiety disorder)是一种以焦虑情绪为主的神经疾病,以持续性的焦虑、紧张、惊恐不安等情绪为表现,并伴有自主神经紊乱、肌肉紧张以及运动不安等症状[1]。世界卫生组织(WHO)的调查结果显示,我国焦虑症的12个月患病率为3.0%,终生患病率为4.8%[2];对于特定人群(如冠心病患者、临考学生等),患病比例可达10%以上[1]。苯二氮䓬类药物(如地西泮)和5-羟色胺再摄取抑制剂(如丁螺环酮)为现阶段临床常用药物,此类药物虽疗效显著,但常见成瘾性,并易引起头痛、胃肠功能紊乱等不良反应[3]。而中药治疗焦虑症具有效用显著、价格低廉、不良反应小等优势,如复方抗焦虑胶囊[4]、柴胡疏肝散[5]、石菖蒲[6]等。因而,从临床常见中药中筛选抗焦虑药物具有重要意义。
药对理论形成并脱胎于《神农本草经》[7],酸枣仁与五味子合用能补心气、安心神[8],用于治疗失眠、健忘、焦虑等。其中,酸枣仁(,SZR)来源于鼠李科植物酸枣Mill. var.(Bunge) Hu ex H. F. Chou的干燥成熟种子[9],药用历史悠久,具有养心补肝、宁心安神、敛汗、生津的功效,属药食同源中药,主要含黄酮、三萜皂苷、生物碱等成分。五味子(,WWZ)是木兰科植物五味子(Turcz.) Baill. 的干燥成熟果实[9],具有收敛固涩、益气生津、补肾宁心的功效,主要含木脂素、挥发油、降三萜等成分,在我国的应用地域贯穿南北,服务于人口众多的满族[10]、蒙古族[11]、瑶族[12],不仅是常见的中药,也是常用的民族药。
酸枣仁-五味子在临床上常相须为用,配伍比例以1∶1和2∶1为主[7]。课题组前期研究发现,炒酸枣仁-醋五味子2∶1配伍时,具有显著的抗焦虑作用[13]。斯皮诺素是酸枣仁的质控指标之一[9],为黄酮碳苷,主要通过调节γ-氨基丁酸A型受体(gamma- aminobutyric acid type A receptor,GABAAR)及5-羟色胺1A型受体(5-hydroxytryptamine 1A receptor,5-HT1AR)发挥抗焦虑作用[14]。五味子醇甲是五味子的质控指标[9],属木脂素,可对抗咖啡因、苯丙胺对自主活动的兴奋作用,抑制小鼠由电刺激或长期单居引起的激怒行为;有广泛的中枢抑制作用,并有安定药的作用特点[15]。酸枣仁-五味子(5∶1)配伍前后斯皮诺素[16]和五味子醇甲[17]的吸收、消除情况已有报道,但目前尚无对酸枣仁-五味子(2∶1)这一临床常用比例配伍前后在焦虑模型动物中肠吸收特性变化的研究,二者配伍的肠吸收机制尚不明确。
为探究酸枣仁-五味子(2∶1)配伍抗焦虑药效的发挥与特征成分吸收之间的关系,本研究采用已被广泛证实有效的空瓶应激(empty bottle stress,EBS)大鼠焦虑模型和孤养结合束缚应激(restraint stress,RS)大鼠焦虑模型[18-21],从躯体、社会和心理3个方面[22]进行焦虑的诱导。选择重复性好、操作简便、能避免个体差异[23]的离体外翻肠囊实验和能准确反映大鼠给药后体内吸收情况的在体单向肠灌流实验,考察酸枣仁-五味子(2∶1)配伍对斯皮诺素和五味子醇甲在十二指肠、空肠、回肠及小肠总的吸收量、吸收速率常数(absorption rate constanta)和表观渗透系数(apparent permeability coefficient,app)的影响,从肠吸收屏障网络[24]的角度揭示酸枣仁-五味子(2∶1)配伍后抗焦虑药效增强的机制,为临床用药提供理论和实验依据。
1 材料
1.1 实验动物
SPF级7周龄SD雄性大鼠,体质量150~170 g,购自斯贝福(北京)生物技术有限公司,动物许可证号为SCXK(京)2016-0002。大鼠饲养于北京中医药大学良乡校区SPF级动物房,环境温度(20~22)℃,湿度40%~60%,12 h光暗周期(8: 20~20: 20光照),明暗节律12 h/12 h。实验前给予大鼠不受限制的标准饲料和洁净饮用水,自主活动。动物实验操作人员具有国家实验动物从业人员上岗证(1119103100128),遵守国际实验动物伦理学要求,实验方案经北京中医药大学伦理委员会批准(编号BUCM-4-2021032201-1027)。
1.2 药物
炒酸枣仁(批号20191022,产自河北邢台,简称酸枣仁),醋五味子(批号20190601,产自辽宁,简称五味子),均购于河北安国药材市场,经北京中医药大学石晋丽教授鉴定,分别为鼠李科植物酸枣Mill. var.(Bunge) Hu ex H. F. Chou的干燥成熟种子、木兰科植物五味子(Turcz.) Baill. 的干燥成熟果实。地西泮(diazepam,DZP),北京益民药业有限公司,规格2.5 mg,批号20180402。
1.3 试剂
碳酸氢钠(批号20170802)、氯化镁(批号20160616)、葡萄糖(批号20170616),均为分析纯,购于北京化学试剂公司;盐酸(批号20180528),分析纯,购于北京化工厂;氯化钠(批号20190507)、氯化钾(批号20190404)、无水磷酸二氢钠(批号20190419)、无水氯化钙(批号20180402),均为分析纯,购于国药集团化学试剂有限公司;0.9%氯化钠注射液(石家庄四药有限公司,批号2009222009);乙腈、甲醇(色谱纯,Fisher公司);纯净水(杭州娃哈哈集团有限公司);斯皮诺素对照品(批号wkq16053003;经测定质量分数为99.442%)、五味子醇甲对照品(批号wkq16051301,经测定质量分数为99.668%)均购于四川省维克奇生物科技有限公司。
1.4 仪器
大鼠束缚装置(不锈钢大鼠固定器),购自创博环球(北京)生物科技有限公司;大鼠旷场、大鼠高架十字迷宫装置(位于北京中医药大学中医学院科研中心行为学实验室,软件:EthoVision XT 9,荷兰Noldus公司)。FE-20型pH计、ME104E型电子分析天平(梅特勒-托利多仪器有限公司);KQ-100E型超声波清洗器(昆山市超声波仪器有限公司);H1650型台式高速离心机(长沙湘仪离心机仪器有限公司);HH-4型数显恒温水浴锅(江苏杰瑞尔电器有效公司);RE3000A型旋转蒸发仪(上海亚荣生化仪器厂);BT100-1F型蠕动泵(保定兰格恒流泵有限公司);冷冻干燥机(北京博医康实验仪器有限公司);VORTEX-5型旋涡混合器(海门市其林贝尔仪器制造有限公司);LC-20A型高效液相色谱仪(岛津公司);ZORBAX-Aq C18液相色谱柱(250 mm×4.6 mm,5 μm),Agilent公司。
2 方法
2.1 实验药液的制备
2.1.1 提取物的制备 分别对30 g酸枣仁、30 g五味子、20 g酸枣仁与10 g五味子配伍进行提取。先分别以8倍量80%乙醇浸泡30 min,回流提取1 h,趁热抽滤;再以10倍量水回流提取1 h,趁热抽滤,合并2次滤液,浓缩,烘干,分别得到酸枣仁、五味子及酸枣仁-五味子提取物,计算出膏率。
2.1.2 给药混悬液的制备 以去离子水分别溶解酸枣仁、五味子、酸枣仁-五味子提取物,配制酸枣仁(0.2 g/mL)、五味子(0.1 g/mL)、酸枣仁-五味子(0.3 g/mL)混悬液(均按生药量计),同法配制地西泮(0.2 mg/mL)混悬液,用于大鼠ig给药。
2.1.3 对照品溶液的制备 以10%乙腈水溶液分别配制1 mg/mL的斯皮诺素、五味子醇甲对照品母液;并分别稀释成质量浓度0.5~30 μg/mL、10~600 μg/mL的线性梯度考察溶液;再配制成含斯皮诺素和五味子醇甲分别为10、200 μg/mL的混合对照溶液,用于HPLC分析。
2.1.4 Krebs-Ringer缓冲液(K-R液)的制备 精密称取NaCl 7.80 g、KCl 0.35 g、NaHCO31.37 g、NaH2PO40.32 g、MgCl20.02 g,溶于500 mL去离子水中;另精密称取CaCl20.37 g溶于500 mL去离子水中;将二者充分混匀,用盐酸调节pH至7.4,于4 ℃密封冷藏。临用前加入葡萄糖1.4 g,即得K-R液。
2.1.5 肠吸收供试液的制备 以K-R液为溶剂,分别加入适量酸枣仁、五味子、酸枣仁-五味子提取物,分别超声20 min,离心(4000 r/min,5 min),取上清液,得到酸枣仁、五味子、酸枣仁-五味子肠吸收实验供试液,采用HPLC法测定指标成分的含量,该供试液用于后续的离体外翻肠囊实验和在体单向肠灌流实验。
2.2 焦虑大鼠模型制备及给药后焦虑行为测试
2.2.1 EBS大鼠焦虑模型的建立 按文献方法[13]制备EBS大鼠焦虑模型,并进行分组及给药。将36只150~170 g大鼠随机均分为6组(每组6只,离体外翻肠囊实验和在体单向肠灌流实验各3只),分别为对照组、模型组、阳性药(DZP)组、酸枣仁组、五味子组、配伍组,各组大鼠定时喂水训练1周之后进行为期2周的EBS造模,于造模第1~7天,按照阳性药组ig给予DZP 1.0 g/(kg·d),酸枣仁、五味子和配伍组分别ig给予相应提取物1.0、0.5、1.5 g/(kg·d)(均按生药量计)对大鼠给药干预,给药容量为5 mL/kg,对照组和模型组ig等容积的水。除对照组外,各造模大鼠均单笼饲养。
2.2.2 RS大鼠焦虑模型的建立 参考文献方法[13]将造模时间延长至7 d进行RS大鼠焦虑模型的建立、分组及给药。将36只150~170 g大鼠随机均分为6组(每组6只,离体外翻肠囊实验和在体单向肠灌流实验各3只),分别为对照组、模型组、阳性药物(DZP)组、酸枣仁组、五味子组、配伍组;在造模的第3天开始ig给药干预,给药剂量及容量同EBS模型,连续给药5 d以模拟人类在焦虑状态下的主动干预行为。除对照组外,各造模大鼠均单笼饲养。
2.2.3 焦虑行为测试 选择经典的大鼠旷场装置和大鼠高架十字迷宫装置进行EBS和RS大鼠模型给药后焦虑行为测试。大鼠旷场装置基于1个边长1 m的正方形,四壁环绕呈围墙状,高50 cm,顶部敞开,大鼠在其中具有开阔的视野,可完全站立、自由嗅探。大鼠高架十字迷宫装置包括2个开臂与2个闭臂(长度均为50.8 cm)和1个中央平台区(边长10.2 cm的正方形),距地面50 cm。
测试前45 min将大鼠运往测试房间进行适应。将适应后的大鼠逐只放入1个塑料盒中,任其自由探索5 min中后分别放入旷场的中心方格和高架十字迷宫的中央平台处,通过上方摄像头拍摄大鼠5 min内的运动情况。记录大鼠进入旷场中央区(边长60 cm的正方形区域)的次数及停留的时间、进入高架十字迷宫开臂次数与总入臂次数的百分比及在开臂内运动时间与开臂、闭臂内的总时间的百分比。每次测试完成后,清除便溺,喷洒70%酒精并擦干,消除气味对测试的影响。对各组数据进行统计,结果以表示。采用GraphPad Prism 9.2.0软件对数据进行统计。实验结果服从正态分布时,进行单因素方差(One-way Anova)分析,差异有显著性时进行Tukey多重比较分析;<0.05表示统计学差异明显,<0.01表示统计学差异显著。
2.3 液相测定条件及方法学考察
2.3.1 样品前处理方法及色谱条件 采用HPLC法进行样品中各指标成分的含量测定。
(1)样品前处理方法:将肠吸收样品置于−20 ℃预冻后冷冻干燥,以样品冷冻前体积计,每200 μL样品加甲醇500 µL,涡旋混合30 s,冰水浴超声30 min,3000 r/min离心5 min,取上清液,N2吹干,每200 µL样品残渣加10%乙腈水100 µL,涡旋混合30 s,冰水浴超声5 min,用0.22 µm滤膜滤过,即得待测试样品溶液。
(2)色谱条件:A相为0.1%甲酸乙腈溶液;B相为0.1%甲酸水溶液;柱温30 ℃;体积流量1.0 mL/min;进样量10 µL;检测波长254 nm。梯度洗脱:0.01~2.00 min,85% B;2.00~7.00 min,85%~75% B;7.00~17.00 min,75%~15% B;17.00~20.00 min,15% B;20.00~21.00 min,15%~85% B;21.00~30.00 min,85% B。精密量取待测试溶液10 µL注入液相色谱仪,分别计算斯皮诺素、五味子醇甲的浓度。
2.3.2 专属性考察 比较空白溶剂、混合对照溶液、空白肠吸收液、外翻肠囊样品以及肠灌流样品的色谱峰形及色谱峰分离情况。
2.3.3 线性考察 取各对照品的线性梯度考察溶液,分别进样分析,以峰面积对质量浓度进行线性回归。
2.3.4 精密度考察 取混合对照溶液,连续进样6次,计算各色谱峰峰面积RSD。
2.3.5 重复性考察 随机取一外翻肠囊样品和在体单向肠灌流样品,分别平均分装成6份后,按“2.3.1”项下的样品前处理方法分别制得重复性样品6份,分别精密量取10 µL注入液相色谱仪,计算斯皮诺素、五味子醇甲的峰面积RSD。
2.3.6 稳定性考察 分别随机取酸枣仁、五味子、酸枣仁-五味子的十二指肠、空肠、回肠段外翻肠囊样品和在体单向肠灌流样品,按“2.3.1”项下方法制备样品溶液,分别在样品溶液制备0、2、4、8、16、24 h后测定,计算色谱峰峰面积RSD。
2.3.7 定量限考察 稀释对照品溶液,以各成分的信噪比(/)约为10,确定其定量限。
2.3.8 空白加样回收率考察 取空白肠囊吸收样品和0~15 min肠灌流样品各7份,1份供含量测定,另6份样品分别精密加入适量的对照品母液,按“2.3.1”项下操作进行前处理及测定,计算空白加样回收率[(测得量-样品含有量)/加入量],并计算各成分加样回收率的RSD。
2.4 各成分在空白肠囊吸收液中的稳定性考察
参考文献方法[25],收集十二指肠、空肠、回肠段的空白肠囊吸收液。以其为溶剂溶解酸枣仁-五味子提取物,置于密闭容器内,放于37 ℃的水浴中孵育2 h,分别于0、0.5、2 h取样500 µL,进行HPLC检测,根据各成分的峰面积,计算其剩余百分率。
2.5 各成分在空白肠灌流液中的稳定性考察
参考文献方法[26],实验大鼠禁食48 h,收集空白肠灌流液,以其为溶剂分别溶解酸枣仁、五味子、酸枣仁-五味子提取物,置于密闭容器内,放于37 ℃的水浴中孵育2 h,分别于0、0.5、2 h取样500 µL,进行HPLC检测,根据各成分的峰面积,计算其剩余百分率。
2.6 各成分在肠壁的物理吸附性考察
剪下模型大鼠十二指肠、空肠和回肠的肠段各3 cm,将黏膜层翻出,用37 ℃的0.9%氯化钠溶液将肠囊冲洗干净,置于6 mL酸枣仁、五味子、酸枣仁-五味子供试液中,37 ℃孵育2 h,测定成分含量变化。重复测定3次取平均值。
2.7 酸枣仁-五味子配伍前后对焦虑模型大鼠中斯皮诺素和五味子醇甲的肠吸收特性影响
2.7.1 离体外翻肠囊实验样品的制备及测定 取禁食24 h(自由饮水)的大鼠,腹腔麻醉后,沿腹中线、腹白线剪开皮肤与肌肉,暴露胃及十二指肠、空肠、回肠等脏器。①取考察肠段:从距幽门2 cm处向下截取10 cm十二指肠段;距幽门15 cm处开始截取10 cm空肠段;从靠近回盲部回肠端上10 cm处向下截取10 cm回肠段;上述肠段分别置于37 ℃恒温的K-R液中。②冲洗内容物:用37 ℃的K-R液冲洗肠段至无内容物,剥离肠管表面的肠系膜和脂肪。③制肠囊:将自制硅胶套管短端插入肠管1 cm左右用丝线结扎牢,结扎处距肠管插入端0.5 cm;将肠管沿硅胶套管翻转;在套管尾端露出时用K-R液冲洗套管管路;将肠段末端用丝线结扎成囊状,结扎处距肠管末端0.5 cm。④平衡:在肠管中充入37 ℃预热的K-R液3 mL,观察充盈情况并确定无破损,放入浴管中,计时,平衡5 min,同时调节气流约为每秒1个气泡。⑤取样:5 min后将K-R液放出,换成供试液,计时,在换液后的15、30、45、60、90 min(十二指肠、空肠)及120 min(回肠)分别取样,每次0.2 mL,同时补充同体积37 ℃预热的K-R液,并将各个肠段的15~60 min样品分别混匀,作为各肠段的混合样品。⑥记录及保存:取样后将肠管取出,测量肠囊内剩余药液体积()并记录,取出的样品记录体积并置于−20 ℃冷冻保存。
按“2.3.1”项下方法对外翻肠囊样品进行前处理和测定,按公式(1)~(4)计算各成分累积吸收量(µg)。
十二指肠=十二混×0.1 mL×4+十二90 min×0.1 mL×(+0.2 mL)/0.2 mL (1)
空肠=空混×0.1 mL×4+空90 min×0.1 mL×(+0.2 mL)/0.2 mL (2)
回肠=回混×0.1 mL×5+回120 min×0.1 mL×(+0.2 mL)/0.2 mL (3)
小肠累计=十二指肠+空肠+回肠 (4)
为肠囊内剩余药液体积;十二混、十二90 min、空混、空90 min、回混、回120 min分别为十二指肠混合样品、十二指肠90 min样品、空肠混合样品、空肠90 min样品、回肠混合样品、回肠120 min样品中考察化合物的质量浓度(µg/mL)
2.7.2 在体单向肠灌流实验样品的制备及测定 ①麻醉:取禁食48 h(自由饮水)的大鼠,腹腔麻醉,置于37 ℃恒温环境下。②插管:沿腹中线剪开皮肤与肌肉,暴露大鼠腹腔,寻找实验所需肠段,即十二指肠(幽门2 cm处)至回肠末端(回肠-盲肠连接处上行10 cm处)。于相应位置剪切(避开血管),于十二指肠处插管并结扎、固定,以乳胶管插入回肠末端切口处以导出灌流液。将十二指肠处插管连接蠕动泵,用37 ℃的0.9%氯化钠溶液冲洗肠内容物,随时滴加37 ℃的0.9%氯化钠溶液以保温保湿。③平衡:将灌流液进、出端高度调至一致,调整肠道摆放位置,使灌流液持续流通。以1 mL/min的体积流量灌流肠管10 min后,再调整体积流量为0.2 mL/min继续平衡20 min。④收集灌流液:平衡完毕,以已称定质量的1号供液瓶迅速换下平衡用药瓶,出液端以已知质量的1ʹ号配对小瓶接液,每隔15 min迅速依次更换已称定质量的供液小瓶和接液小瓶,称质量,计算灌入和收集的供试液质量,分别记为in与out;分别于第15、30、45、60 min收集灌流液,记录体积,置于−20 ℃冻存。⑤测量:实验结束后,将大鼠处死,剪下肠段,测量长度(),剪开部分肠段,测量肠管周长以得到肠管半径()。⑥密度()测定:分别从已称定质量的供液小瓶和接液小瓶各移出500 µL供试液和收集液,称质量(称定质量后将液体移回原瓶),2次称质量差即为500 µL供试液和收集液各自的质量,根据计算灌入和收集的供试液密度(in、out),再计算in与out。
按“2.3.1”项下方法对在体单向肠灌流样品进行前处理和测定,按公式(5)~(7)分别计算各成分的峰面积比值、吸收速率常数a(min−1)和表观渗透系数app(cm/min)。每组3个生物学重复样本,a和app结果以表示。
峰面积比值=out/in(5)
a=(1-out/in×out/in)×/(π2) (6)
app=−×ln(out/in×out/in)/(π2) (7)
in和out分别为经HPLC测得的每15 min灌流进出药液中对应指标成分的峰面积;为肠段的长度(cm);为肠段的内半径(cm);为灌流速度(mL/min);in和out分别为进出药液中对应指标成分的质量浓度(g/mL);in与out分别为每15 min灌流入肠的供试液体积和灌流出肠的供试液体积(mL)
3 结果
3.1 各提取物出膏率及配伍对指标成分溶出的影响
酸枣仁、五味子、酸枣仁-五味子提取物的平均出膏率(由同一批药材分别提取20次计算得到)分别为11.60%、32.10%和17.08%。
经HPLC测定,肠吸收实验中的酸枣仁供试液中含斯皮诺素9.19 µg/mL,五味子供试液中含五味子醇甲295.59 µg/mL,酸枣仁-五味子供试液中含斯皮诺素17.02 µg/mL、五味子醇甲268.74 µg/mL。液相测定结果可见,斯皮诺素在配伍后供试液中的含量与配伍前相比,提高了约1倍,说明配伍能增加斯皮诺素的溶出。
3.2 酸枣仁-五味子配伍前后对焦虑模型大鼠焦虑行为的影响
3.2.1 旷场实验结果 如图1所示,与对照组相比,EBS和RS模型大鼠均表现出焦虑样行为,体现在进入旷场中央区的次数和停留时间减少(<0.05、0.01)。
在EBS和RS模型下,与模型组相比,阳性药组大鼠进入中央区的次数和停留时间明显增加(<0.05、0.01),说明阳性药干预并改善了模型大鼠的焦虑状态。除阳性药组外,各给药组大鼠进入中央区的次数和在中央区停留的时间与模型组相比,均有不同程度的增加,其中,配伍组较模型组增加最多(<0.05)。EBS和RS焦虑模型大鼠的旷场实验结果一致,证实了酸枣仁、五味子单用及配伍给药后能不同程度地改善焦虑模型大鼠的焦虑状态,且配伍后改善焦虑状态的趋势更为明显(<0.05)。
3.2.2 高架十字迷宫实验结果 如图2所示,与对照组相比,EBS和RS模型大鼠均表现出焦虑样行为,体现在进入开臂的次数和时间百分比降低(<0.05、0.01)。与模型组相比,阳性药组大鼠进入开臂的次数和时间百分比均增加(<0.05、0.01),说明阳性药干预改善了模型大鼠的焦虑状态。
在EBS和RS焦虑模型下,各给药组大鼠与模型组相比,进入开臂的次数均明显增加(<0.05、0.01),说明酸枣仁、五味子单用及配伍给药均能改善焦虑模型大鼠的焦虑表现;各给药组大鼠与模型组相比,进入开臂时间百分比有不同程度增加,并且配伍后相对于配伍前增加更多,其中,EBS模型下的配伍组大鼠进入开臂时间百分比与模型组相比有明显增加(<0.05)。
EBS和RS焦虑模型的高架十字迷宫实验结果基本一致,表明酸枣仁、五味子单用及配伍给药后能不同程度地改善焦虑模型大鼠的焦虑状态,并且在EBS模型下,配伍后改善焦虑状态的趋势更为明显(<0.05、0.01)。
以上行为学数据表明,酸枣仁、五味子配伍后较配伍前更能增加大鼠进入旷场中央区的次数和时间,以及进入开臂的时间。说明酸枣仁、五味子配伍后较配伍前更能改善焦虑模型大鼠的焦虑状态,更好地发挥抗焦虑药效。
3.3 HPLC方法学考察结果
专属性考察结果表明斯皮诺素与五味子醇甲分离良好,无溶剂干扰(图3)。精密度和重复性考察结果斯皮诺素、五味子醇甲的峰面积RSD均小于2.0%,说明精密度和重复性符合要求。线性关系考察结果分别为斯皮诺素回归方程=39 338-19 770,2=0.999,线性范围为0.5~30 μg/mL;五味子醇甲回归方程=9 984.3-94 449,2=0.999,线性范围为10~600 μg/mL。斯皮诺素、五味子醇甲的定量限分别为0.24、0.05 μg/mL。空白加样回收率实验结果表明,斯皮诺素和五味子醇甲在各个样品中的加样回收率范围为91.81%~115.34%,RSD分别为0.05%、0.04%、0.93%和0.33%,回收率符合80%~120%标准,RSD均小于2%,结果符合要求。
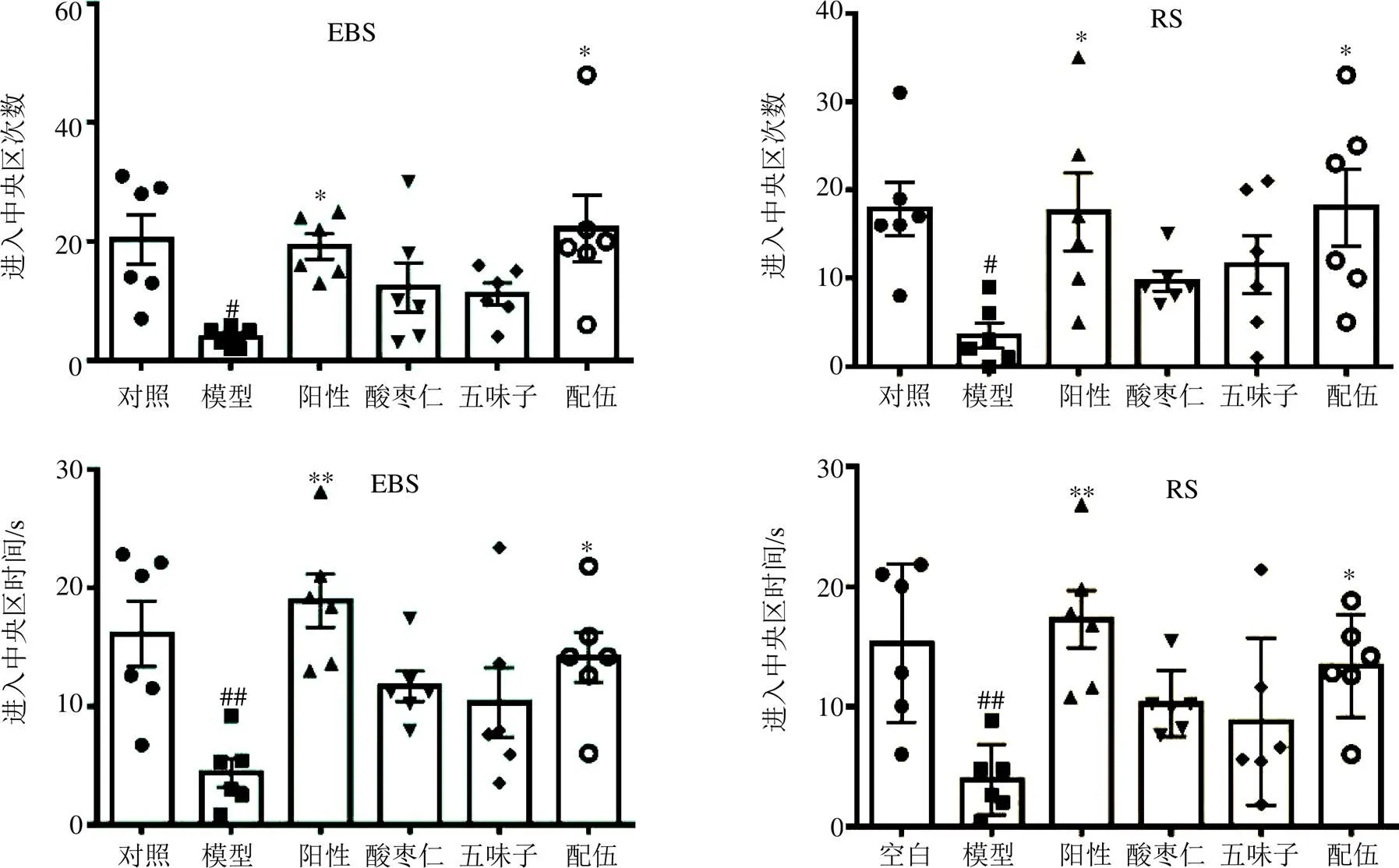
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01
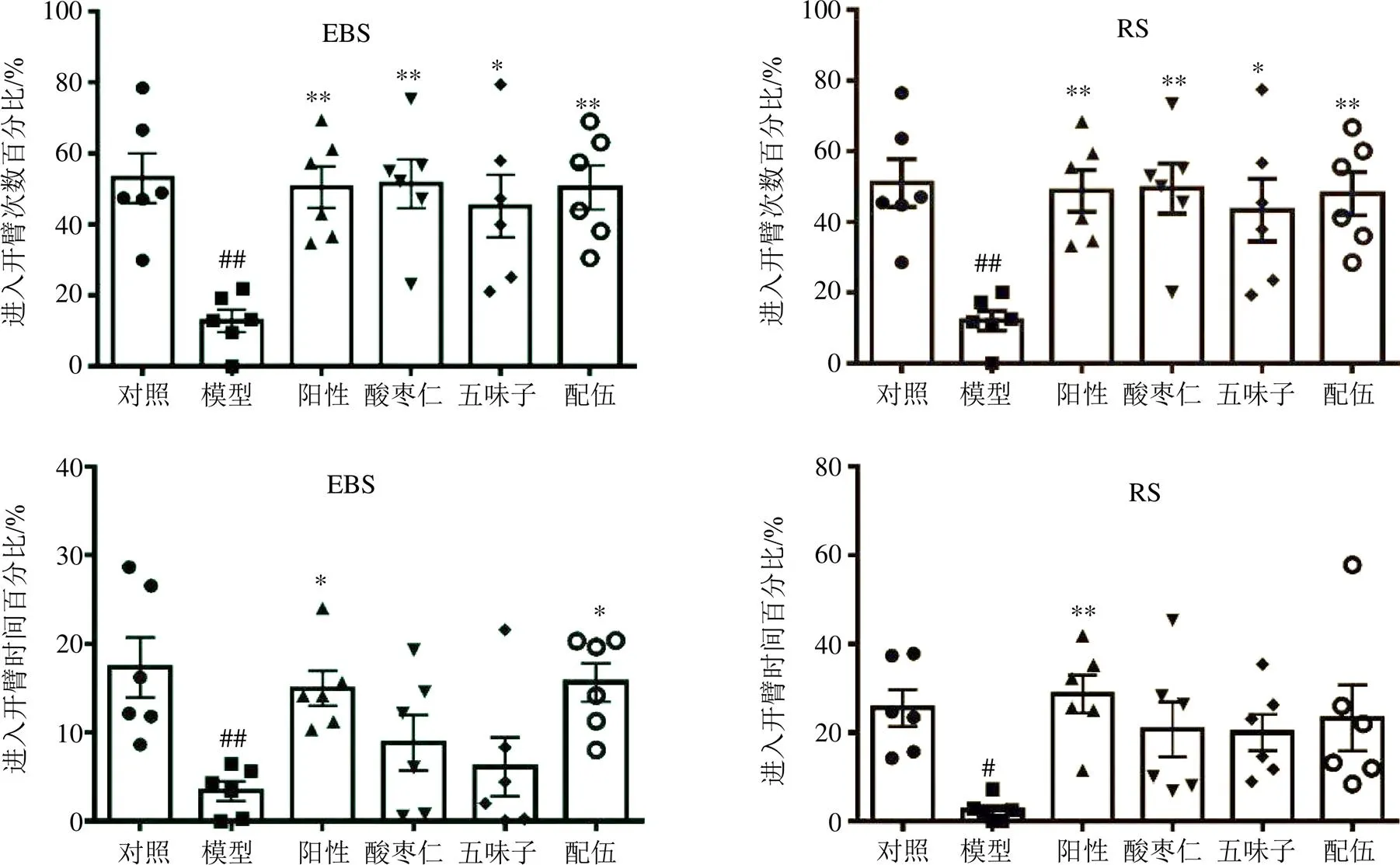
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01

图3 空白溶剂(A)、空白肠吸收液(B)、混合对照品(C)、酸枣仁外翻肠囊样品(D)、五味子外翻肠囊样品(E)、酸枣仁-五味子外翻肠囊样品(F) 的HPLC图谱
外翻肠囊样品稳定性考察结果(表1)表明,配伍前后各肠段样品中的斯皮诺素在24 h内均有较高的稳定性(含量变化比不超过5.49%,峰面积RSD不超过2.15%);配伍前后五味子醇甲在十二指肠中均稳定(含量变化比不超过1.00%,RSD不超过0.38%),但配伍前五味子醇甲在空肠和回肠样品中24 h内不稳定,含量变化比分别为−14.36%、27.41%,峰面积RSD已超过7.94%,而配伍后稳定性显著提高(含量变化比降低至2.54%,RSD降低至0.95%)。在体单向肠灌流样品稳定性考察结果显示,斯皮诺素和五味子醇甲在配伍前后均有较高的稳定性(含量变化比不超过4.52%,RSD不超过1.47%)。
表1 斯皮诺素、五味子醇甲的稳定性考察结果
Table 1 Stability of spinosin and schisandrin
化合物配伍情况含量变化比/%峰面积RSD/% 十二指肠(外翻肠囊)空肠(外翻肠囊)回肠(外翻肠囊)总肠段(肠灌流)十二指肠(外翻肠囊)空肠(外翻肠囊)回肠(外翻肠囊)总肠段(肠灌流) 斯皮诺素配伍前1.792.565.494.520.630.872.151.47 配伍后5.382.640.581.651.911.020.950.96 五味子醇甲配伍前1.00−14.3627.412.180.327.948.890.86 配伍后1.002.54−0.760.910.380.950.450.76
含量变化比=(24 h含量-0 h含量)/ 0 h含量
3.4 各成分在空白肠囊吸收液中的稳定性考察结果
在十二指肠、空肠和回肠样品中,斯皮诺素孵育0.5、2 h的剩余率为89.83%~106.13%,五味子醇甲孵育0.5、2 h的剩余率为92.59%~96.18%;在空白肠囊吸收液中孵育2 h,考察化合物的损失及误差范围约在10%以内,稳定性尚可。
3.5 各成分在空白肠灌流液中的稳定性考察结果
酸枣仁提取物和酸枣仁-五味子提取物中的斯皮诺素分别经空白肠灌流液溶解、孵育0.5、2 h的剩余率为99.26%~99.80%;五味子提取物和酸枣仁-五味子提取物中的五味子醇甲分别经空白肠灌流液溶解、孵育0.5、2 h的剩余率为99.51%~100.96%;在空白肠灌流液中孵育2 h,考察化合物的损失及误差范围约在1%以内,稳定性较高。
3.6 各成分在肠壁的物理吸附性考察结果
斯皮诺素和五味子醇甲在肠壁的物理吸附性考察结果如表2所示。影响吸附后与吸附前含量比值(简称比值)的因素包括2方面:①肠壁对该成分的物理吸附作用;②肠壁对供试液中水分的吸收作用。首先,酸枣仁单用时,斯皮诺素在回肠的吸附比值为98.30%,在其他肠段均高于100%,说明酸枣仁单用时,斯皮诺素在回肠肠壁有略微的吸附,在其他肠段吸附作用不明显。五味子单用时,五味子醇甲在十二指肠、空肠和回肠的比值分别为74.80%、102.61%和89.35%,说明五味子单用时,十二指肠和回肠对五味子醇甲有较强的吸附作用,且十二指肠的吸附更甚,空肠对其没有明显的吸附作用。配伍后,肠壁对斯皮诺素和五味子醇甲的吸附作用可能减弱(各肠段比值均高于配伍前),或更多地表现为对供试液中水分的吸收,进而导致供试液浓缩,使比值增加,高于100%。综上,配伍可能降低十二指肠对五味子醇甲、回肠对斯皮诺素和五味子醇甲的物理吸附作用,也可能提高各肠段对供试液中水分的吸收。
表2 斯皮诺素、五味子醇甲在肠壁的物理吸附性考察结果
Table 2 Physical adsorption of spinosin and schisandrin on intestinal inner wall
肠段斯皮诺素吸附比值/%五味子醇甲吸附比值/% 酸枣仁单用配伍后五味子单用配伍后 十二指肠109.64 111.05 74.80 113.26 空肠102.04 113.85 102.61 111.95 回肠98.30 103.68 89.35 103.64
3.7 酸枣仁-五味子配伍前后对焦虑模型大鼠中斯皮诺素和五味子醇甲的肠吸收特性的影响
3.7.1 斯皮诺素和五味子醇甲在离体外翻肠囊实验中的结果 酸枣仁-五味子配伍前后给药对EBS和RS模型大鼠离体外翻肠囊实验中斯皮诺素和五味子醇甲的肠吸收特性影响如表3所示。可以看出,五味子醇甲的吸收量比斯皮诺素整体约高1个数量级;在EBS和RS模型下,配伍前的斯皮诺素和五味子醇甲在回肠肠段吸收量均高于其他肠段;配伍后,二者在各肠段的吸收量相当,其中,斯皮诺素在回肠肠段的吸收量略低于其他两肠段。
表3 酸枣仁-五味子配伍对斯皮诺素、五味子醇甲在离体外翻肠囊实验中吸收量的影响()
Table 3 Effects of Ziziphi Spinosae Semen and Schisandrae Chinensis Fructus compatibility on absorption of spinosin and schisandrin in in vitro everted gut sac experiment ()
成分组别Q十二指肠/µgQ空肠/µgQ回肠/µgQ小肠累计/µg 斯皮诺素EBS-酸枣仁 18.29±0.03 17.71±0.14 27.83±0.40 63.83±0.56 EBS-配伍 8.69±0.16 8.84±0.17 7.42±0.14 24.95±0.44 RS-酸枣仁 9.82±0.05 6.67±0.06 10.19±0.09 26.68±0.12 RS-配伍 8.08±0.11 7.85±0.12 6.83±0.09 22.76±0.25 五味子醇甲EBS-五味子 98.90±0.43111.30±0.17211.90±3.46422.11±3.55 EBS-配伍178.26±3.19142.96±2.47146.18±2.14467.40±6.77 RS-五味子 55.01±0.36 50.81±0.13118.75±0.48224.57±0.75 RS-配伍161.34±2.17165.80±2.61119.24±1.28446.38±4.72
在离体外翻肠囊实验中,酸枣仁、五味子配伍后斯皮诺素和五味子醇甲的肠吸收量变化情况如表4所示。配伍后,除RS模型的空肠肠段外,斯皮诺素在两模型下的各肠段的吸收量均降低,EBS模型下总吸收量降低38.88 µg,RS模型下总吸收量降低3.92 µg。配伍后,五味子醇甲在两模型下的小肠总吸收量较配伍前均有所增加,事实上,除回肠段外,五味子醇甲的吸收量均增加,EBS模型下总吸收量增加45.29 µg,RS模型下总吸收量增加221.81 µg,约增加1倍。以上结果说明配伍降低了斯皮诺素的吸收,但促进了五味子醇甲在十二指肠和空肠的吸收。从数值来看,配伍促进五味子醇甲增加的吸收量大于斯皮诺素降低的吸收量,尤其在RS模型下,五味子醇甲的吸收增加量(221.81 µg)远大于斯皮诺素的吸收降低量(3.92 µg)。
变化量=配伍后-配伍前
3.7.2 斯皮诺素在在体单向肠灌流实验中的结果 酸枣仁-五味子配伍前后给药,对EBS和RS模型大鼠在体单向肠灌流实验中斯皮诺素的肠吸收特性如表5所示。峰面积比值越小,表明吸收越好;a值越大,表明吸收越快;app是衡量物质渗透性的参数,通常该参数的数值越大,表明物质越易于渗透即易于吸收,有研究者[27]认为当app大于4×10−4cm/min时,说明该物质有较好的吸收。,
表4 酸枣仁-五味子配伍后斯皮诺素、五味子醇甲在离体外翻肠囊实验中吸收量的变化
Table 4 Changes in absorption of spinosin and schisandrin after compatibility of Ziziphi Spinosae Semen and Schisandrae Chinensis Fructus in in vitro everted gut sac experiment
成分动物模型Q变化量/µg 十二指肠空肠回肠小肠 斯皮诺素EBS−9.60−8.87−20.41−38.88 RS−1.741.18−3.36−3.92 五味子醇甲EBS79.3631.66−65.7245.29 RS106.33114.990.49221.81
表5 焦虑模型大鼠在体单向肠灌流实验中酸枣仁-五味子配伍对斯皮诺素吸收特性的影响()
Table 5 Effects of Ziziphi Spinosae Semen and Schisandrae Chinensis Fructus compatibility on absorption of spinosin in in vivo single-pass intestinal perfusion experiment of anxiety model rats ()
样品考察时段/min峰面积比值/%Ka/(×10−3min−1)Papp/(×10−3 cm·min−1) EBS-酸枣仁 0~15 0.8819.40±0.474.69±0.55 15~30 0.8420.00±0.486.21±0.10 30~45 8.8320.00±0.275.85±0.78 45~60 34.0617.40±1.563.39±0.73 EBS-配伍 0~15 0.0020.50±0.097.91±0.78 15~30 0.0020.60±0.078.35±0.98 30~45 33.8518.60±1.214.28±0.91 45~60 86.5514.10±2.162.07±0.55 RS-酸枣仁 0~15 0.8019.60±0.334.91±0.53 15~30 1.8619.70±0.315.16±0.64 30~45 63.3511.70±4.831.85±0.88 45~60 128.03−7.24±9.44−1.98±0.78 RS-配伍 0~15 0.0020.50±0.087.92±0.77 15~30 4.9720.40±0.127.26±0.84 30~45 21.8417.80±1.923.96±0.11 45~60 42.5415.20±1.872.40±0.57
在EBS和RS焦虑大鼠模型下,灌流的前2个时段(0~30 min)中,配伍前后斯皮诺素的峰面积比值均不高于4.97%,说明供试液中的斯皮诺素近完全吸收,随着灌流过程的推进(30~60 min),峰面积比值逐渐增加,甚至达到128.03%,样品吸收逐渐减弱,甚至出现了外排现象。在30~60 min时段内,在EBS模型下,配伍后斯皮诺素的峰面积比值明显大于配伍前,说明配伍后斯皮诺素的吸收降低,此结果与离体外翻肠囊实验的结果一致;而在RS模型下,配伍后斯皮诺素的峰面积比值降低,其变化趋势与之相反,原因有待进一步讨论。
在EBS和RS焦虑大鼠模型下,斯皮诺素在配伍前后的绝大部分吸收时段(RS-酸枣仁的45~60 min时段除外)的a均不低于11.70×10−3/min,app均不低于1.85×10−3cm/min,表明斯皮诺素在两模型下的吸收速率较快,且吸收良好[27]。在0~30 min时段,配伍后,两焦虑模型下斯皮诺素的a和app均有升高趋势,说明配伍可能促进斯皮诺素的初始(0~30 min)吸收。而在30~60 min时段,在EBS模型下,配伍后斯皮诺素的a和app均有不同程度降低,说明配伍后斯皮诺素的吸收降低;而在RS模型下,斯皮诺素的a和app均明显升高,其变化趋势与之相反,原因有待进一步讨论。值得注意的是,酸枣仁单独给药(RS-酸枣仁)至45~60 min时,峰面积比值大于100%,a和app均呈负值,说明此时机体对斯皮诺素的处理以外排为主,且这种外排现象在配伍后(RS-配伍)得到改善。
以上现象表明,在肠吸收初期(0~30 min),配伍给药可能促进斯皮诺素的吸收,但在后期(30~60 min),配伍可能导致其吸收降低;除此之外,配伍还能减轻小肠对斯皮诺素的外排作用。
3.7.3 五味子醇甲在在体单向肠灌流实验中的结果 酸枣仁-五味子配伍前后给药,对EBS和RS模型大鼠在体单向肠灌流实验中五味子醇甲的肠吸收特性结果如表6所示。在EBS和RS焦虑大鼠模型中,配伍前后供试液中的五味子醇甲在灌流的全过程近完全吸收(峰面积比值极小),并且随着灌流过程的推进,样品吸收没有减弱的趋势(峰面积比值没有明显增加,均小于1%),持续保持较高的吸收;各个吸收时段的a均不低于0.013 50/min,app均大于5.75×10−3cm/min,表明五味子醇甲在两模型下的吸收速率较快,且吸收良好[27]。并且配伍给药后,两模型下五味子醇甲在各时段的a和app均不同程度升高,说明配伍可能促进五味子醇甲的吸收。其中,EBS模型下五味子单独给药(EBS-五味子)组的a有较大的标准误差,此现象可能与灌流前后灌流液体积、密度的变化及小肠长度的差异有关,而肠道对水分的交换和利用或许是以上差异在大鼠体内的表现形式。以上现象表明,五味子醇甲在配伍前后均保持较高水平的吸收,且配伍能促进五味子醇甲的吸收。
表6 焦虑模型大鼠在体单向肠灌流实验中酸枣仁-五味子配伍对五味子醇甲肠吸收特性的影响()
Table 6 Effects of Ziziphi Spinosae Semen and Schisandrae Chinensis Fructus compatibility on absorption of schisandrin in in vivo single-pass intestinal perfusion experiment of anxiety model rats ()
考察样品考察时段/ min峰面积比值/%Ka/(×10−3min−1)Papp/(×10−3 cm·min−1) EBS-五味子 0~15 0.0313.60±6.575.75±0.15 15~30 0.0513.80±6.686.82±0.29 30~45 0.0013.50±6.535.92±0.51 45~60 0.0713.60±6.596.33±0.39 EBS-配伍 0~15 0.1120.50±0.017.56±0.74 15~30 0.1120.50±0.018.01±1.00 30~45 0.0320.30±0.307.74±1.60 45~60 0.0020.50±0.077.38±0.44 RS-五味子 0~15 0.1120.10±0.376.52±0.99 15~30 0.0620.30±0.156.62±0.75 30~45 0.1720.10±0.256.41±1.06 45~60 0.6319.90±0.335.76±0.99 RS-配伍 0~15 0.0720.60±0.048.23±0.43 15~30 0.0920.60±0.078.21±0.86 30~45 0.6720.20±0.347.24±1.39 45~60 0.4920.40±0.077.10±0.39
综合肠吸收实验结果显示,配伍前后,斯皮诺素和五味子醇甲的吸收情况均较好,且五味子醇甲的小肠总吸收量远高于斯皮诺素(约高1个数量级);配伍可能促进斯皮诺素的初始吸收(0~30 min),但降低后期(30~60 min)的吸收,并降低斯皮诺素的小肠总吸收量;另外,配伍能减轻酸枣仁中斯皮诺素的外排作用,并促进五味子中五味子醇甲的吸收。以上结果说明酸枣仁、五味子抗焦虑药效的发挥与其药效物质斯皮诺素、五味子醇甲良好的吸收密不可分;配伍后抗焦虑作用的增强可能与促进五味子醇甲的吸收有关。
4 讨论
本研究采用EBS和RS 2种焦虑大鼠模型,通过离体外翻肠囊实验和在体单向肠灌流实验结合HPLC法,分别考察了酸枣仁-五味子药对在配伍前后的指标成分斯皮诺素和五味子醇甲在焦虑模型大鼠中的肠吸收特性。结果表明,酸枣仁-五味子配伍前后,斯皮诺素和五味子醇甲均保持良好的吸收,在此基础上抗焦虑作用得以发挥;配伍虽增加了斯皮诺素的溶出量,减少了小肠对斯皮诺素的外排,但降低了斯皮诺素的吸收。配伍促进了五味子醇甲的吸收,并增加了其在空肠和回肠中的稳定性,因此,本研究认为五味子醇甲是配伍后抗焦虑药效增强的重要物质基础。
4.1 酸枣仁-五味子配伍抗焦虑指标成分的选择
斯皮诺素有广泛的中枢药理作用,如镇静催眠、抗焦虑等[28],研究证实其抗焦虑机制由GABAAR和5-HT1AR调节[14]。除斯皮诺素外,酸枣仁的质控指标还有酸枣仁皂苷A,但其不能透过血脑屏障与GABA受体完全结合[29],经大鼠胃肠代谢后生物利用度非常低(1.32%)[30]。另有研究推测黄酮类成分可能是酸枣仁中的主要抗焦虑成分[31],因此,本研究仅考察了酸枣仁中黄酮类化合物斯皮诺素的肠吸收特性。
五味子醇甲为木脂素类化合物,容易进入细胞内[32],可增加大鼠纹状体及下丘脑多巴胺含量,发挥中枢抑制作用[33],具有雌激素活性[34],有利于避免因雌激素缺乏所致的焦虑样行为[35]。除五味子醇甲外,五味子中还含有五味子甲素和乙素,但在道地外产区外的五味子中并未检测到[36]或含量较低[37];其药理活性与抗焦虑作用可能不直接相关,故本研究未将其纳入有效成分进行研究。
4.2 在体单向肠灌流实验中,实验大鼠禁食时间的选择
在体单向肠灌流实验,研究人员首先参考常规禁食时间[38-39],分别尝试禁食12、18、24、36 h,但发现2种焦虑模型大鼠十二指肠处的食糜无法冲洗干净,导致灌流液不能顺畅流出,实验无法进行。并且焦虑模型大鼠暴露腹腔后可见大量分散的脂肪,推测原因是焦虑引起大鼠中脑-边缘多巴胺系统胞外多巴胺浓度减少,导致过量摄食作为补偿[40],因而造成十二指肠处食糜较多。将禁食时间延长至48 h后,大鼠十二指肠及后续肠段的食糜可冲洗干净,因此本实验在满足动物福利最大化的前提下,根据实验需求将大鼠禁食时间调整为48 h。
4.3 在体单向肠灌流实验中,斯皮诺素的外排作用及原因分析
RS模型下的在体单向肠灌流实验30~60 min时段,斯皮诺素在配伍后峰面积比值异常降低、a和app异常升高。观察酸枣仁单独给药30~60 min时段的数据可见,此时斯皮诺素峰面积比值过高(分别为63.35%、128.03%);a和app数值过低,甚至在45~60 min时段出现负值,说明在45~60 min时段,机体对斯皮诺素的处理以外排为主。而在30~45 min时段,推测外排作用已经发生,并导致了上述参数的异常变化。
上述外排作用在配伍后得到改善,分析其原因,斯皮诺素主要在小肠中消化吸收[41],但生物利用度低,其外排现象与P-糖蛋白、多药耐药相关蛋白等均有关[42];五味子中的木脂素既是P-糖蛋白的底物又是其抑制剂[43-44],推测在配伍后,木脂素类成分与P-糖蛋白发生作用,抑制并减轻了斯皮诺素的外排。
4.4 配伍后斯皮诺素、五味子醇甲的肠吸收特性及其与抗焦虑药效增强的关联
配伍后斯皮诺素的吸收降低,对其原因进行分析发现,斯皮诺素和五味子醇甲的肠吸收过程均为主动转运[45-46],主动转运需要细胞膜上的膜蛋白或标志酶作为载体参与到转运过程,但载体数量有限,当需要与载体结合达到转运的成分增多时,成分间的竞争导致其中部分成分不能与载体结合达到转运、吸收。因此,推测配伍后五味子中包括五味子醇甲在内的木脂素类成分与斯皮诺素竞争载体,而五味子醇甲与载体的结合能力更强,因而导致与斯皮诺素结合的载体减少,不能达到有效的转运,因而致其吸收量降低。结合斯皮诺素在配伍前保持较好的吸收及其抗焦虑药效[14,28],提示斯皮诺素可能是酸枣仁中抗焦虑的重要成分,但并非配伍后抗焦虑药效增加的关键成分。
两肠吸收实验结果均证实,配伍促进了五味子中五味子醇甲的吸收,外翻肠囊实验表明配伍主要促进五味子醇甲在十二指肠和空肠的吸收。另外,外翻肠囊样品稳定性考察结果表明,配伍使五味子醇甲在空肠、回肠中的稳定性大幅提高,有研究[17]提示酸枣仁能显著减少五味子醇甲在动物体内的消除,增加其滞留时间。因而推测可能是酸枣仁中的某些化学成分在配伍后与五味子醇甲相互作用,增加了五味子醇甲的稳定性,或抑制其降解,因而在一定程度上促进了其吸收。
肠吸收实验中,虽然斯皮诺素的吸收降低,但五味子醇甲的吸收升高,并且在离体外翻肠囊实验中五味子醇甲总吸收量的增加远大于斯皮诺素的减少。五味子醇甲有广泛中枢抑制作用,并有安定药的作用特点,能抑制小鼠长期单居引起的激怒行为[15]。作为抗焦虑药效指标,五味子醇甲吸收量的大幅增加或许可在一定程度上拮抗斯皮诺素的外排[42,47-49]并弥补其吸收量的降低,进而保证配伍后抗焦虑药效的发挥,乃至增强。因此,本研究认为五味子醇甲或许是促使配伍后抗焦虑药效增强的重要物质基础。另一方面,五味子中的木脂素成分也被研究证实有显著的抗焦虑作用,能显著抑制束缚应激引起的焦虑症[50],因此,配伍后抗焦虑药效的增强也可能与五味子中其他木脂素类成分的吸收变化有关。
已有的研究表明,酸枣仁与五味子合用时,能减慢斯皮诺素的代谢,提高其生物利用度[16];枣仁安神方中的酸枣仁能显著减缓五味子中五味子醇甲的消除,延长其作用时间[17]。本实验结果表明酸枣仁-五味子配伍后,促进了五味子醇甲的吸收,并增加其在小肠中的稳定性。结合五味子醇甲的抗焦虑活性,酸枣仁-五味子配伍进而发挥更好的抗焦虑药效,可能是促进活性成分吸收和延缓其代谢共同作用的结果。
本研究从肠吸收屏障网络的角度,初步揭示了酸枣仁、五味子抗焦虑药效的发挥与其中的药效成分斯皮诺素、五味子醇甲在小肠保持良好的吸收有关;并且酸枣仁-五味子药对配伍后通过增加药效成分五味子醇甲的吸收、提高其稳定性,进而增强了抗焦虑作用。后续可对药效成分的代谢动力学进行研究,更进一步说明其生物利用度改变的原因。
利益冲突 所有作者均声明不存在利益冲突
[1] 朱晓旭, 谢鸣. 焦虑症中医药治疗研究现状 [J]. 北京中医药大学学报, 2002, 25(3): 62-65.
[2] Kessler R C, Aguilar-Gaxiola S, Alonso J,. The global burden of mental disorders: An update from the WHO World Mental Health (WMH) surveys [J]., 2009, 18(1): 23-33.
[3] Shergill S S, Katona C.[M]. Berlin Heidelberg: Springer, 2001: 323.
[4] 吕跃玮, 刘洁, 史淑宁, 等. 复方抗焦虑胶囊对急性应激大鼠的抗焦虑作用及对大鼠脑内ERK/CREB信号通路和BDNF表达的影响 [J]. 中国药理学通报, 2015, 31(11): 1614-1619.
[5] 王莹威, 李亚男, 方慧敏, 等. 柴胡疏肝散加减治疗冠心病合并焦虑症 [J]. 吉林中医药, 2019, 39(8): 1040-1043.
[6] 冯波, 靖慧军, 郭敏娟, 等. 石菖蒲挥发油和水煎液的抗焦虑作用 [J]. 中国实验方剂学杂志, 2014, 20(9): 207-210.
[7] 唐于平, 束晓云, 李伟霞, 等. 药对研究(I): 药对的形成与发展 [J]. 中国中药杂志, 2013, 38(24): 4185-4190.
[8] 白丽婷, 王莹, 高卓林, 等. 五味子酸枣仁软胶囊改善动物睡眠功能的研究 [J]. 特产研究, 2019, 41(3): 44-47.
[9] 中国药典 [S]. 一部. 2020: 68, 382-384.
[10] 门磊, 勾萌, 李春斌, 等. 满族民间常用植物药的化学成分和药理作用研究进展 [J]. 亚太传统医药, 2017, 13(17): 18-22.
[11] 李鹏, 刘艳骄. 蒙医药中有关睡眠药物的文献辑述 [J]. 世界睡眠医学杂志, 2018, 5(1): 35-38.
[12] 芮雯, 岑颖洲, 邢莹莹, 等. 抗肝炎类瑶族药的研究现状 [J]. 广东化工, 2005, 32(3): 65-68.
[13] 刘洁. 基于HPA轴及BDNF-ERK-ECS信号通路探讨酸枣仁—五味子药对的抗焦虑作用及其机制 [D]. 北京: 北京中医药大学, 2018.
[14] Liu J, Zhai W M, Yang Y X,. GABA and 5-HT systems are implicated in the anxiolytic-like effect of spinosin in mice [J]., 2015, 128: 41-49.
[15] 钮心懿, 王维君, 边振甲, 等. 五味子有效成分“醇甲”的中枢神经系统作用 [J]. 药学学报, 1983, 18(6): 416-421.
[16] 高蓉, 李珊, 陈贤金, 等. 配伍对君药酸枣仁中斯皮诺素和阿魏酸的药动学影响 [J]. 中国中药杂志, 2015, 40(16): 3293-3297.
[17] 张丽, 李珊, 赵阿静, 等. 枣仁安神方配伍变化对五味子醇甲及五味子甲素药动学的影响 [J]. 中国医院药学杂志, 2016, 36(19): 1636-1640.
[18] 肖青青, 高静, 柏丁兮, 等. 基于“病证结合”理论探讨广泛性焦虑心阴亏虚证大鼠模型的构建与评价 [J]. 中华中医药学刊, 2019, 37(4): 832-837.
[19] Wang S N, Ding Y S, Ma X J,. Identification of bioactive chemical markers in Zhi Zhu Xiang improving anxiety in rat by fingerprint-efficacy study [J]., 2018, 23(9): 2329.
[20] 张雪. 安神方抗焦虑作用的疗效观察及相关机制研究 [D]. 广州: 南方医科大学, 2012.
[21] 陈轶. 黑果枸杞和白刺的抗焦虑作用及机制探讨 [D]. 北京: 北京中医药大学, 2017.
[22] 林文娟, 王玮雯, 邵枫. 慢性情绪应激对大鼠行为、神经内分泌和免疫反应的影响: 一个新的情绪应激模型 [J]. 科学通报, 2003, 48(9): 926-929.
[23] 王莎, 刘斯琪, 丁鹏敏, 等. 体外模型在中药代谢研究中的应用 [J]. 药学进展, 2020, 44(2): 119-132.
[24] 武晓群, 陈斌, 黄厚才, 等. 基于肠吸收屏障网络的中药成分相互作用与配伍机理研究 [J]. 新中医, 2010, 42(9): 102-105.
[25] 孔小强, 蒋且英, 罗云, 等. 基于外翻肠囊模型的黄芪-附子配伍对附子6种生物碱肠吸收的影响研究 [J]. 中草药, 2017, 48(23): 4928-4934.
[26] 马永贵, 袁龙, 王文清, 等. 在体单向肠灌流模型研究小檗碱磷脂固体分散体的大鼠肠吸收特性 [J]. 中草药, 2017, 48(9): 1820-1824.
[27] Yee S.permeability across Caco-2 cells (colonic) can predict(small intestinal) absorption in man: Fact or myth [J]., 1997, 14(6): 763-766.
[28] 祝凌丽. 斯皮诺素对中枢神经系统药理作用的研究进展 [J]. 包头医学院学报, 2018, 34(6): 120-122.
[29] Chen C Y C. Insights into the Suanzaoren mechanism—From constructing the 3D structure of GABA-A receptor to its binding interaction analysis [J]., 2008, 39(6): 663-671.
[30] Song P P, Zhang Y, Ma G J,. Gastrointestinal absorption and metabolic dynamics of jujuboside A, A saponin derived from the seed of[J]., 2017, 65(38): 8331-8339.
[31] 贺一新, 赵素霞, 崔瑛. 酸枣仁抗焦虑活性物质分析 [J]. 中药材, 2010, 33(2): 229-231.
[32] 李惠连, 季德, 毛春芹, 等. LC-MS测定大鼠血浆中五味子的3个木脂素成分及其药动学研究 [J]. 中国药理学通报, 2013, 29(9): 1313-1317.
[33] 张林魁, 钮心懿. 五味子醇甲对中枢神经系统单胺类递质的影响 [J]. 中国医学科学院学报, 1991, 13(1): 13-16.
[34] Lee D, Kim Y M, Chin Y W,. Schisandrol A exhibits estrogenic activity via estrogen receptor α-dependent signaling pathway in estrogen receptor-positive breast cancer cells [J]., 2021, 13(7): 1082.
[35] 徐永君. 1.妊娠后期暴露过量糖皮质激素所致子代抑郁样行为的机制研究 2.雌激素缺乏所致抑郁样和焦虑样行为的机制研究 [D]. 上海: 第二军医大学, 2016.
[36] 李春水, 郑文媛. 不同产地五味子有效成分的对比研究 [J]. 中药材, 2009, 32(9): 1362-1363.
[37] 尹程程, 杨洋, 赵大庆, 等. 北五味子饮片等级标准及质量评价 [J]. 中成药, 2021, 43(7): 1812-1818.
[38] 杜秋, 狄留庆, 单进军, 等. 在体单向肠灌流模型研究瑞香素的大鼠肠吸收特性 [J]. 药学学报, 2009, 44(8): 922-926.
[39] 许永崧, 韩晓凤, 龚慕辛, 等. 单向在体肠灌流在中药研究中的应用 [J]. 中国实验方剂学杂志, 2016, 22(1): 211-218.
[40] 刘琼珍, 吕文婷, 蔡旻煊, 等. 代谢性疾病对情绪和认知功能的影响及其可能机制研究进展 [J]. 中国药理学与毒理学杂志, 2015, 29(5): 847-858.
[41] 崔瑛, 杨晶晶, 郭敏娟, 等. 基于“病证-效应-生物样本分析”方法的酸枣仁“安神”药性物质及归经的研究 [J]. 世界科学技术—中医药现代化, 2015, 17(3): 569-577.
[42] 宋盼盼. 酸枣仁黄酮跨膜转运及其磷脂复合物自微乳制剂研究 [D]. 天津: 天津商业大学, 2018.
[43] 贝煜. 北五味子总木脂素肠吸收与调控机制研究 [D]. 广州: 广州中医药大学, 2011.
[44] Pan Q R, Lu Q H, Zhang K,. Dibenzocyclooctadiene lingnans: A class of novel inhibitors of P-glycoprotein [J]., 2006, 58(1): 99-106.
[45] Song P P, Xiao S, Zhang Y Q,. Mechanism of the intestinal absorption of six flavonoids fromacross Caco-2 cell monolayer model [J]., 2020, 21(8): 633-645.
[46] 贝煜, 于洋, 黎同明. 大鼠在体肠灌注研究五味子有效成分肠吸收 [J]. 亚太传统医药, 2011, 7(12): 35-38.
[47] 秦小清, 梁宇光, 高洪志, 等. 五味子甲素对K562/ADR、HL60/ADR、MCF-7/ADR多药耐药逆转机制的研究 [J]. 中国药理学通报, 2011, 27(3): 329-334.
[48] Huang M, Jin J, Sun H,. Reversal of P-glycoprotein-mediated multidrug resistance of cancer cells by five schizandrins isolated from the Chinese herb[J]., 2008, 62(6): 1015-1026.
[49] 徐秋玲, 金秀东, 郭冉, 等. 五味子乙素逆转人结肠癌细胞多药耐药性 [J]. 中国食物与营养, 2011, 17(12): 64-66.
[50] Chen W W, He R R, Li Y F ,. Pharmacological studies on the anxiolytic effect of standardizedlignans extract on restraint-stressed mice. [J]., 2011, 18(13):1144-1147.
Effect ofandcompatibility on anti-anxiety activty and intestinal absorption properties of effective components
LIU Jin-feng1, WANG Xiao-mei1, LI Jia-yuan1, YANG Xue1, WEI Xiao-jia1, WANG Yu-qing1, LYU Yan1, YU Jia-he1, JIN Zhong-xian1, WANG Chun-guo2, SHI Jin-li1
1. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China 2. Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 102488, China
To study the changes in anti-anxiety effects and the intestinal absorption properties of the key ingredients (spinosin and schisandrin) in two anxiety rat models, before and after the compatibility of Suanzaoren (, SZR) and Wuweizi (, WWZ) herb pair.Two anxiety rat models which were empty bottle stress (EBS) at the same time isolation and restraint stress (RS) combined with isolation were used to evaluate the anti-anxiety effect of before and after compatibility of SZR and WWZ by open field experiments and elevated cross maze experiments. The absorption of spinosin and schisandrin before and after compatibility of SZR and WWZ in duodenum, jejunum, ileum and the whole small intestine of anxiety model rats were determined by theeverted gutexperiment andsingle-pass intestinal perfusion experiment combined with HPLC.The results of behavioral experiment showed that both SZR and WWZ could reduce the anxiety-like behavior of anxious rats, and the reduction of the anxiety-like behavior was more significant after the compatibility of the two. For theeverted gutexperiment, the absorption of schisandrin was about one order of magnitude higher than that of spinosin. After compatibility, the total absorption of spiniosin showed a downward trend, the absorption of schisandrin increased, which was manifested in the increase of duodenum, jejunum, and total absorption. Meanwhile, the schisandrin had good stability in jejunum and in ileum. For thesingle-pass intestinal perfusion experiment, the absorption of spinosin was fast and completed in 30 min of perfusion. The efflux may occur when SZR used alone. However, after compatibility, this efflux effect was weakened to a certain extent. Schisandrin was also absorbed quickly and completely within 1 h of perfusion, and no efflux effect was observed. And after compatibility, the absorption rate constant (a) and apparent permeability coefficient (app) of spinosin and schisandrin were both increased.The anti-anxiety effect was enhanced after the compatibility of SZR and WWZ. The dissolution of spinosin was increased, the efflux effect of spinosin was reduced, the absorption of spinosin was decreased, and the absorption and the stability of schisandrin in jejunum and ileum were increased after the compatibility of SZR and WWZ. From the perspective of intestinal absorption barrier network, this study revealed that the anti-anxiety effect of SZR and WWZ is closely related to the good absorption of spinosin and schisandrin in small intestine, the enhancement of anti-anxiety effect after the compatibility of SZR and WWZ may be related to the improvement of stability of schisandrin and the increase of absorption of schisandrin. This conclusion provides scientific basis for clinical medication.
intestinal absorption; anxiety disorder; spinosin; schisandrin;;; compatibility
R285
A
0253 - 2670(2022)16 - 5093 - 14
10.7501/j.issn.0253-2670.2022.16.019
2022-02-20
国家“重大新药创制”科技重大专项(2012ZX09102-201-018)
刘金凤(1990—),女,硕士研究生,主要从事中药药效物质基础研究。Tel: 15210691464 E-mail: jinfeng0902049@126.com
石晋丽,博士生导师,教授,主要从事中药药效物质基础与作用机制研究。E-mail: shijl@vip.sina.com
王春国,实验师,主要从事中药药效物质基础研究。E-mail: wangcg1119@126.com
#共同第一作者:王晓玫(1993—),女,硕士研究生,主要从事中药药效物质基础研究。Tel: 17812013713 E-mail: 467115394@qq.com
[责任编辑 潘明佳]
