基于PI3K/Akt信号通路探究当归补血汤干预大鼠实验性脑缺血再灌注损伤的作用机制
2022-08-16刘兴德宋信莉舒万芬张甘纯王洪鑫
石 娅,刘 文, 3*,刘兴德,宋信莉,李 鑫,舒万芬,张甘纯,秦 琴,王洪鑫
基于PI3K/Akt信号通路探究当归补血汤干预大鼠实验性脑缺血再灌注损伤的作用机制
石 娅1, 2,刘 文1, 2, 3*,刘兴德1,宋信莉1, 2,李 鑫1, 2,舒万芬1, 2,张甘纯1, 2,秦 琴1, 2,王洪鑫1, 2
1. 贵州中医药大学,贵州 贵阳 550025 2. 贵州中医药大学药学院,国家苗药工程技术研究中心,贵州中药炮制与制剂工程技术研究中心,贵州 贵阳 550025 3. 贵州医科大学,贵州 贵阳 550025
基于网络药理学结合体内实验探讨当归补血汤对脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)大鼠的干预作用及相关作用机制。通过数据库收集当归补血汤中的活性成分及其治疗CIRI的靶点,构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,并进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;通过Auto Dock软件对关键作用靶点与主要活性成分进行分子对接验证。SD大鼠给予尼莫地平或当归补血汤2周后,采用改良Longa线栓法复制大脑中动脉栓塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型,对神经行为学进行评分,并测定脑组织梗死面积;采用TUNEL染色法测定脑组织细胞凋亡情况;采用苏木素-伊红(HE)染色法考察脑组织病理变化;采用ELISA测定血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)和IL-1β水平;采用qRT-PCR检测脑组织、和mRNA表达;采用Western blotting检测脑组织蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(phosphorylated Akt,p-Akt)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)蛋白表达。筛选出当归补血汤30种活性成分,得到当归补血汤治疗CIRI的靶点467个,核心靶点55个。KEGG通路富集分析表明磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/Akt信号通路是当归补血汤抗CIRI的关键机制之一。分子对接显示,当归补血汤中主要活性成分与核心作用靶点中的Akt1、信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、转录因子AP-1(transcription factor AP-1,JUN)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、细胞肿瘤抗原p53(cellular tumor antigen p53,TP53)、TNF和IL-6等具有较为稳定的结合活性。动物实验结果表明,当归补血汤能够改善CIRI大鼠神经功能损伤(<0.05);减少脑组织梗死面积(<0.05、0.01);减轻脑组织病理损伤;降低脑组织细胞凋亡指数(<0.05、0.01、0.001);降低血清中TNF-α、IL-6和IL-1β水平(<0.05、0.01);降低脑组织中、和mRNA表达(<0.01、0.001);增加脑组织中Akt的磷酸化水平(<0.01、0.001)而激活PI3K/Akt信号通路,进一步上调Bcl-2蛋白表达(<0.05、0.01、0.001),下调Bax蛋白表达(<0.05、0.001)。当归补血汤可能通过作用多靶点及多通路治疗CIRI,其机制与影响Akt1、TNF、IL-6、IL-1β等蛋白的表达进而调控PI3K/Akt信号通路抑制炎症和细胞凋亡有关。
当归补血汤;脑缺血再灌注损伤;网络药理学;磷脂酰肌醇-3-激酶/蛋白激酶B信号通路;炎症;细胞凋亡;毛蕊异黄酮葡萄糖苷;毛蕊异黄酮;阿魏酸;芒柄花素;藁本内酯;黄芪甲苷
缺血性脑卒中是常见的中风类型,临床治疗常以药物介导的静脉溶栓和动脉内血栓切除术为主[1-2],旨在通过再灌注恢复缺血脑组织的血液供应。然而,在脑缺血再灌注后,虽可以减少缺血引起的脑梗死面积和组织功能障碍,但快速的再灌注会对功能恢复造成更严重的影响,加重组织损伤[3],称为脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI),是导致患者严重残疾和死亡的首要因素之一[4]。此外,CIRI的病理机制复杂,包括炎症反应、氧化应激、凋亡、血脑屏障功能障碍、白细胞浸润等[5-10],致使目前的治疗策略难以达到预期效果。
在中医药理论指导下,传统中医药尤其是复方中药制剂在临床上治疗脑卒中及其并发症已有数千年的历史[11-13]。中医认为“气虚血瘀”是缺血性脑卒中和CIRI的主要病机特点之一,而“益气活血”是治疗关键环节之一[14-15]。现代药理学研究显示,益气活血类中药及中药复方具有抗炎、清除氧自由基、保护血脑屏障(blood brain barrier,BBB)完整性、抑制细胞凋亡等作用,在防治缺血性脑卒中及CIRI方面具有良好的优势与前景[16-17]。当归补血汤出自《内外伤辨惑论》,是益气补血的代表方剂,由黄芪和当归(5∶1)组成,具有明显的益气营血、扶正固本的功效[18]。现有研究表明,当归补血汤可通过改善BBB通透性,影响海马区一氧化氮合酶和脑源性促红细胞生成素的表达等保护CIRI的神经组织[19-21]。但目前对于其抗CIRI的主要生物活性成分和分子机制尚未被全面阐明,既不能充分认识其在临床疗效的科学内涵,亦不能对中医的传统理论做出科学的诠释,从而制约了其在医学上的运用和药物的进一步研制。
网络药理学结合系统生物学和交叉药理学的概念,从多维角度探讨中医药与疾病的关系,强调整体性和系统性,从而阐释药物、靶点与疾病间的多重相互作用,符合中医学从整体观念和辨证论治的角度诊治疾病的原则[22-24]。因此,本研究拟采用网络药理研究,分析当归补血汤的有效成分,筛选当归补血汤抗CIRI的作用靶点并挖掘其潜在通路,并进一步通过体内实验验证预测的主要通路,为药物研发提供新思路。
1 材料
1.1 数据库及软件
TCMSP数据库(http://lsp.nwsuaf.edu.cn/tcmsp. php)、SwissTargetPrediction 数据库(http://www. swisstargetprediction.ch/)、TCMID数据库(http:// www.megabionet.org/tcmid/)、UniProt数据库(https:// www.uniprot.org/)、GeneCards数据库(http://www. genecards.org/)、OMIM数据库(https://www. omim.org/)、DisGeNET数据库(http://disgenet.org/)、Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/ index.html)、String Version 11.0数据库(https://string-db.org/)、Cytoscape 3.6.0软件、DAVID 6.8数据库(https://david.ncifcrf.gov/)、KOBAS 3.0数据库(http:// kobas.cbi.pku.edu.cn/ kobas3/genelist/)、ZINC数据库(https://zinc.docking. org/substances/home/)、PubChem数据库(https:// pubchem.ncbi.nlm.nih.gov/)、PDB数据库(http:// www.rcsb.org/)、PyMOL软件、Openbabel软件、GraphPad Prism 9软件。
1.2 药材
黄芪(批号200801,产地甘肃)、当归(批号200721,产地甘肃)购自北京同仁堂贵阳药店,经贵州中医药大学孙庆文教授鉴定分别为豆科黄芪属植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao干燥根、伞形科植物当归(Oliv.) Diels的干燥根。
1.3 动物
SPF级雄性SD大鼠,体质量(200±20)g,6~7周龄,购自辽宁长生生物技术股份有限公司,动物质量合格证编号SCXK(辽)2020-0001。饲养于通风良好,室温18~25 ℃,相对湿度50%~70%的动物房,确保动物自由进食与饮水。动物实验经贵州中医药大学动物实验伦理委员会批准(伦理批准号20210052)。
1.4 药品与试剂
尼莫地平片(批号20200709,国药准字H20003010)购自拜耳医药保健有限公司;2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC,批号0719A21)购自北京雷根生物技术有限公司;大鼠白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒、大鼠IL-1β ELISA试剂盒(批号分别为E-EL-R0015c、E-EL-R2856c、E-EL-R0012c)购自武汉伊莱瑞特生物科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号AB-P-R 001)购自杭州贤至生物有限公司;BCA蛋白浓度测定试剂盒(批号P0010)购自上海碧云天生物技术有限公司;磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)多克隆兔抗(批号AF0016)购自Affinity公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)兔抗(批号A19693)购自Abclonal公司;Akt兔抗(批号60203-2-Ig、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)兔抗(批号50599-2-Ig)购自武汉三鹰生物技术有限公司;HRP标记的山羊抗兔二抗(批号BA1054)购自武汉博士德生物工程有限公司;Trizol(批号15596-026)购自Ambion公司;HiScript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)、SYBR Green Master Mix(批号分别为R233-01、Q111-02)购自南京诺唯赞生物科技股份有限公司;细胞凋亡检测试剂盒(批号E-CK-A322)购自Elabscience公司。
1.5 仪器
FlexStation 3型多功能酶标仪(德国Molecular Devices公司);H1650R型冷冻高速离心机(湖南湘仪离心机有限公司);ICV-450型电热恒温培养箱(日本ASONE公司);Pannoramic 250型数字切片扫描仪(匈牙利3DHIESTECH公司);微量移液器(德国Eppendorf公司);QuantStudio 6型实时荧光定量PCR仪、Multiskan MK3型酶标仪(美国Thermo Fisher Scientific公司)。
2 方法
2.1 网络药理学
2.1.1 当归补血汤活性成分与靶点预测 以“黄芪”“当归”或其拉丁文为关键词,在TCMSP数据库、TCMID数据库中进行检索,收集筛选有效成分。此外,将《中国药典》2020年版中2味中药的质量控制成分以及中国知网(CNKI)中已有报道的生物活性物质纳入分析。在TCMSP数据库、TCMID数据库、SwissTargetPrediction数据库中收集活性成分靶点,将3者整合,通过Uniprot数据库将靶点蛋白名进行标准化处理,去重。
2.1.2 潜在靶点预测 通过GeneCards、OMIM、DisGeNET数据库收集与“cerebral ischemia-reperfusion injury”“cerebral thrombosis”“ischemic stroke”和“cerebral embolism”病名相关的靶点,整合去除重复靶点,筛选得到CIRI相关靶点。当归补血汤活性成分靶点和CIRI靶点的韦恩图通过Venny 2.1在线工具绘制,将交集靶点作为当归补血汤治疗CIRI的潜在靶点。
2.1.3 蛋白相互作用网络(protein-protein interaction,PPI)的构建和分析通过String Version 11.0数据库对潜在靶点进行PPI分析,限定Homo sapiens、minimum required interaction score≥0.9,并隐藏游离蛋白。将结果以“TSV”格式导入Cytoscape 3.6.0软件中,拓扑分析由CytoNCA插件[25]完成,其中,介数中心线(betweenness centrality,BC)、紧密中心(closeness centrality,CC)和度值均是评价网络中节点贡献程度的重要参数,其数值越高,该靶点对网络参与度和贡献率越大[26]。通过参数分析,探索当归补血汤治疗CIRI可能的相关核心作用靶点。
2.1.4 “活性成分-靶点-疾病”网络的构建与分析 基于交集靶点,反向筛选得到对应活性成分,制作网络关系表及属性文件,依次导入Cytoscape 3.6.0软件,构建“活性成分-靶点-疾病”图,通过Network Analyzer插件计算度值,分析筛选主要药效成分。
2.1.5 基因本体(gene ontology,GO)功能与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 分别通过DAVID 6.8数据库、KOBAS 3.0数据库进行GO功能和KEGG通路富集分析。下载分析结果,将其分别按值和“Count”(每条通路中含有的潜在基因靶点的数量)值的大小进行排序。
2.1.6 分子对接验证 通过ZINC数据库、PubChem数据库下载成分结构的sdf格式文件,通过PyMOL将其转换为pdb格式;从PDB数据库筛选下载靶点蛋白结构。运用Auto Dock软件对蛋白结构去水、加全氢、导出为pdbqt(设置为配体);对小分子加全氢、设置为配体(自动分布电荷)、检测扭转键、选择扭转键、导出为pdbqt;设置对接Box、导出为gpf、运行Autogrid 4、设置对接参数及运算方法、导出为dpf、运行Autodock 4、查看结果;导出结果为pdbqt,运用Openbabel软件将其转换为pdb,后采用PyMOL进行可视化处理。
2.2 实验验证
2.2.1 当归补血汤的制备 按处方比例黄芪-当归(5∶1)准确称取适量药材,混匀,加8倍量纯水浸泡30 min,煎煮提取2次,每次1 h,滤过,合并滤液,煎煮浓缩至适当浓度,备用。通过HPLC法对制备的浓缩液进行分析,通过直接与对照品的保留时间相比较,定性了毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、阿魏酸、芒柄花素、藁本内酯和黄芪甲苷6个成分,质量分数(以生药计)分别为0.546、0.154、0.296、0.109、0.302、0.751 mg/g。
2.2.2 动物分组与给药 大鼠适应性喂养1周后,随机分为假手术组、模型组、尼莫地平(32.4 mg/kg,相当于临床剂量的6倍)组和当归补血汤低、中、高剂量(5.84、11.67、23.34 g/kg,分别相当于临床剂量的3、6、12倍)组,每组18只,分别称定质量、标记。各给药组ig相应药物(10 mL/kg),假手术组和模型组ig等体积生理盐水,每隔24 h给药1次,连续14 d。
2.2.3 造模与取材 给药14 d后,采用改良的Longa线栓法[27-29]复制大鼠大脑中动脉栓塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型。缺血2 h后,小心匀速抽出线栓以恢复再灌注过程,涂抹适当碘伏进行消毒以防感染。假手术组除未插入线栓外,其他操作相同;再灌注22 h后,深度麻醉大鼠,从腹主动脉采集约5 mL血液,室温放置1 h,3000 r/min离心15 min,吸取上清液,转移至−80 ℃冰箱中保存,备用。采血后,迅速断头取脑,以冰的生理盐水清洗,滤纸拭干,浸泡于4%多聚甲醛溶液中固定,于−80 ℃超低温保存备用。
2.2.4 神经行为学评分 再灌注22 h后,分别随机挑选12只大鼠参照国际通用的Longa法[29]进行神经行为学评分,选取评分≥1的大鼠进行后续实验。
2.2.5 脑梗死面积测定 再灌注22 h后,剔除小脑与嗅球的脑组织放入−20 ℃预冻30 min后,进行冠状切片,将脑切片用2% TTC避光染色15 min,正常部位为红色,梗死区为白色时,切片置于4%多聚甲醛中,24 h后取出切片进行拍照记录。将记录的TTC染色图像导入Image J图像处理软件,根据脑梗死严重程度自定义圈选梗死区域(白色)和全脑区域,通过“Analyze-Measure”模块分别计算面积,并计算梗死率。
梗死率=脑梗死总面积/脑切片总面积
2.2.6 病理形态学观察 将固定的脑组织脱水并经石蜡包埋及切片,进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.2.7 细胞凋亡指数测定 取各组大鼠脑组织切片,按细胞凋亡检测试剂盒说明书操作,于显微镜下观察脑组织中的凋亡细胞,计算细胞凋亡率。
细胞凋亡率=凋亡细胞数/总细胞数
2.2.8 大鼠血清中TNF-α、IL-6和IL-1β水平的测定 按ELISA试剂盒说明书检测大鼠血清中TNF-α、IL-6和IL-1β水平。
2.2.9 qRT-PCR检测大鼠脑组织中、和mRNA表达 取各组大鼠脑组织,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物由北京擎科生物科技有限公司合成,引物序列见表1。
表1 引物序列
Table 1 Primer sequences
基因序列 (5’-3’)产物大小/bp GAPDHF: ACAGCAACAGGGTGGTGGAC253 R: TTTGAGGGTGCAGCGAACTT IL-6F: GTTGCCTTCTTGGGACTGATG102 R: TACTGGTCTGTTGTGGGTGGT TNF-αF: CCGATTTGCCATTTCATACCAG232 R: TCACAGAGCAATGACTCCAAAG IL-1βF: CCTGTGTGATGAAAGACGGC218 R: TATGTCCCGACCATTGCTGT
2.2.10 Western blotting测定脑组织中Akt、p-Akt、Bcl-2和Bax蛋白表达 将低温冷冻保存的各组大鼠脑组织剪碎,加入细胞裂解液提取总蛋白。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用含5%脱脂奶粉的TBST封闭2 h后,分别加入兔抗Akt(1∶5000)、兔抗p-Akt(1∶1000)、兔抗Bax(1∶5000)、兔抗Bcl-2(1∶1000)和兔抗GAPDH(1∶1000),4 ℃孵育过夜;加入二抗,室温孵育2 h。使用ECL工作液显色曝光,扫描胶片,用Bandscan分析胶片灰度值(以GAPDH为内参蛋白)。
2.2.11 统计分析方法 数据使用软件SPSS 26.0进行统计处理,用表示,采用单因素方差分析比较各组间差异的显著性。采用Mann-Whitney检验,对神经行为学评分进行非参数统计分析。所有数据作图均由GraphPad Prism 9软件生成。
3 结果
3.1 活性成分及潜在靶点的收集
TCMSP数据库检索到212个活性成分。通过口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18筛选,得到黄芪的20个活性成分,当归的2个活性成分。查阅《中国药典》2020年版和文献,将部分成分纳入后续研究,共计30个活性成分,见表2。通过各数据库收集整理,得到695个活性成分靶点,5336个CIRI相关靶点。通过韦恩图分析,得到467个药物-疾病共同靶点作为当归补血汤治疗CIRI的潜在靶点。
3.2 PPI分析
为了获得潜在靶点交互作用的信息,将467个潜在靶点PPI网络的TSV文件导入Cytoscape 3.6.0进行分析,分析内容包括:(1)大于度值的2倍中位数;(2)同时大于CC、BC、度值的1倍。筛选得出靶点蛋白55个,即为当归补血汤治疗CIRI的关键靶点蛋白,见图1。根据度值进行排序,将排名前20的靶点作为核心靶点,用于分子对接,见表3。提示这些靶点在PPI网络中起着较为关键的作用,在治疗CIRI中可能占据重要地位。
3.3 “活性成分-靶点-疾病”网络
“活性成分-靶点-疾病”网络见图2。该网络中共有497个节点,1926条边,更加直观地展示多成分、多靶点的相互关系。经度值对当归补血汤活性成分进行排序,排名前10的活性成分见表4,将其作为当归补血汤治疗CIRI的关键活性成分,用于分子对接。
3.4 GO功能富集分析
GO功能富集分析结果显示,经<0.01筛选后,得到1087条GO结果,其中生物过程(biological process,BP)795条、分子功能(molecular function,MF)192条、细胞组成(cellular component,CC)100条,分别选取前10条进行可视化处理,见图3。BP主要涉及G蛋白偶联受体信号通路、RNA聚合酶II启动子转录的调控、凋亡过程的调控、细胞因子介导的信号通路、炎症反应等;CC主要涉及质膜、细胞溶质、细胞质等;MF主要涉及蛋白质结合、三磷酸腺苷(adenosine triphosphate,ATP)结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性等。体现当归补血汤对CIRI的治疗是多重作用的结果。
表2 活性成分信息
Table 2 Information of active ingredients
编号分子编码化合物OB/%DLPubChem CID DBT1MOL000211mairin55.380.7864971 DBT2MOL000239jaranol50.830.295318869 DBT3MOL000296常春藤皂苷元36.910.7573299 DBT4MOL000033(3S,8S,9S,10R,13R,14S,17R)-10,13-dimethyl-17-[(2R,5S)-5-propan-2-yloctan-2-yl]-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-ol36.230.7815976101 DBT5MOL000354异鼠李素49.600.315281654 DBT6MOL0003713,9-di-O-methylnissolin53.740.4815689655 DBT7MOL0003745′-hydroxyiso-muronulatol-2′,5′-di-O-glucoside41.720.69/ DBT8MOL0003787-O-methylisomucronulatol74.690.3015689652 DBT9MOL0003799,10-dimethoxypterocarpan-3-O-β-D-glucoside36.740.9274977390 DBT10MOL000380(6aR,11aR)-9,10-dimethoxy-6a,11a-dihydro-6H-benzofurano[3,2-c]chromen-3-ol64.260.4214077830 DBT11MOL000387联苯双酯31.100.67108213 DBT12MOL000392芒柄花素69.670.215280378 DBT13MOL000398异黄烷酮109.990.30160767 DBT14MOL000401黄芪甲苷I46.790.1151346122 DBT15MOL000403黄芪甲苷II46.060.1313996693 DBT16MOL000405黄芪甲苷III31.830.10441905 DBT17MOL000407黄芪甲苷IV22.50 0.1513943297 DBT18MOL000414咖啡酸酯54.970.051549111 DBT19MOL000417毛蕊异黄酮47.750.245280448 DBT20MOL000422山柰酚41.880.245280863 DBT21MOL000433FA68.960.716037 DBT22MOL000438(3R)-3-(2-hydroxy-3,4-dimethoxyphenyl)chroman-7-ol67.670.2610380176 DBT23MOL000439isomucronulatol-7,2′-di-O-glucosiole49.280.6215689653 DBT24MOL0004421,7-dihydroxy-3,9-dimethoxy pterocarpene39.050.485316760 DBT25MOL000098槲皮素46.430.285280343 DBT26MOL009290毛蕊异黄酮葡萄糖苷5.490.815318267 DBT27MOL000358β-谷甾醇36.910.75222284 DBT28MOL000449豆甾醇43.830.765280794 DBT29MOL000360阿魏酸39.560.06445858 DBT30MOL002201藁本内酯51.300.075877292

图1 关键靶点蛋白PPI网络筛选图
表3 核心靶点蛋白拓扑参数信息
Table 3 Topological parameter information of core target proteins
序号蛋白BCCC度值序号蛋白BCCC度值 1STAT30.038 205 130.947 368 425111TNF0.013 254 280.729 729 7334 2Akt10.026 395 360.857 142 864512IL-60.012 844 070.729 729 7334 3JUN0.026 197 200.830 769 234313HSP90AA10.015 546 760.729 729 7334 4EGFR0.020 950 660.805 970 154114ESR10.009 983 050.7233 5TP530.012 616 800.760 563 383715STAT10.013 734 340.7233 6CTNNB10.016 963 080.760 563 383716EGF0.009 975 970.7233 7RELA0.016 293 610.753617HRAS0.009 565 440.7233 8VEGFA0.016 670 830.753618ERBB20.010 972 390.701 298 7031 9MYC0.011 939 460.739 726 033519PIK3R10.011 611 460.701 298 7031 10SRC0.010 534 450.739 726 033520MAPK10.009 144 180.692 307 6930

图2 “活性成分-靶点-疾病”网络
表4 关键活性成分信息
Table 4 Information of key active components
编号活性成分度值 DBT25槲皮素159 DBT19毛蕊异黄酮115 DBT12芒柄花素111 DBT29阿魏酸92 DBT26毛蕊异黄酮葡萄糖苷91 DBT63,9-di-O-methylnissolin89 DBT17黄芪甲苷86 DBT10(6aR,11aR)-9,10-dimethoxy-6a,11a-dihydro-6H-benzofurano[3,2-c]chromen-3-ol81 DBT30藁本内酯78 DBT20山柰酚71
3.5 KEGG通路分析
KEGG通路分析结果,经<0.01筛选后,共得到229条通路结果,前20名见图4。包括代谢通路、PI3K/Akt信号通路、有丝分裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)信号通路、卡波西肉瘤相关疱疹病毒感染、Ras信号通路等。其中,抗CIRI最相关的通路为PI3K/Akt信号通路,且多数核心靶点主要富集于此条通路上。因此以其作为后续动物实验验证通路。
3.6 分子对接验证
分子对接中,对接分数表示活性物质与蛋白质的亲和力和构象的稳定性,如图5所示,各成分与蛋白对接的结合能均小于−21.42 kJ/mol,说明各成分与蛋白均能较好地结合[30]。此外,使用PyMoL软件对部分结果进行结构匹配分析见图6,成分与靶点之间通过形成氢键等相互作用使结构趋于稳定。

图3 GO功能富集分析

图4 KEGG通路富集分析(前20)

图5 分子对接结果图
3.7 当归补血汤对CIRI大鼠神经功能损伤的影响
如表5所示,与假手术组比较,模型组大鼠神经行为学评分显著升高(<0.001),神经功能损伤严重。与模型组比较,尼莫地平组和当归补血汤中、高剂量组大鼠神经行为学评分明显降低(<0.05),表明当归补血汤可以改善CIRI诱导的大鼠神经功能损伤。
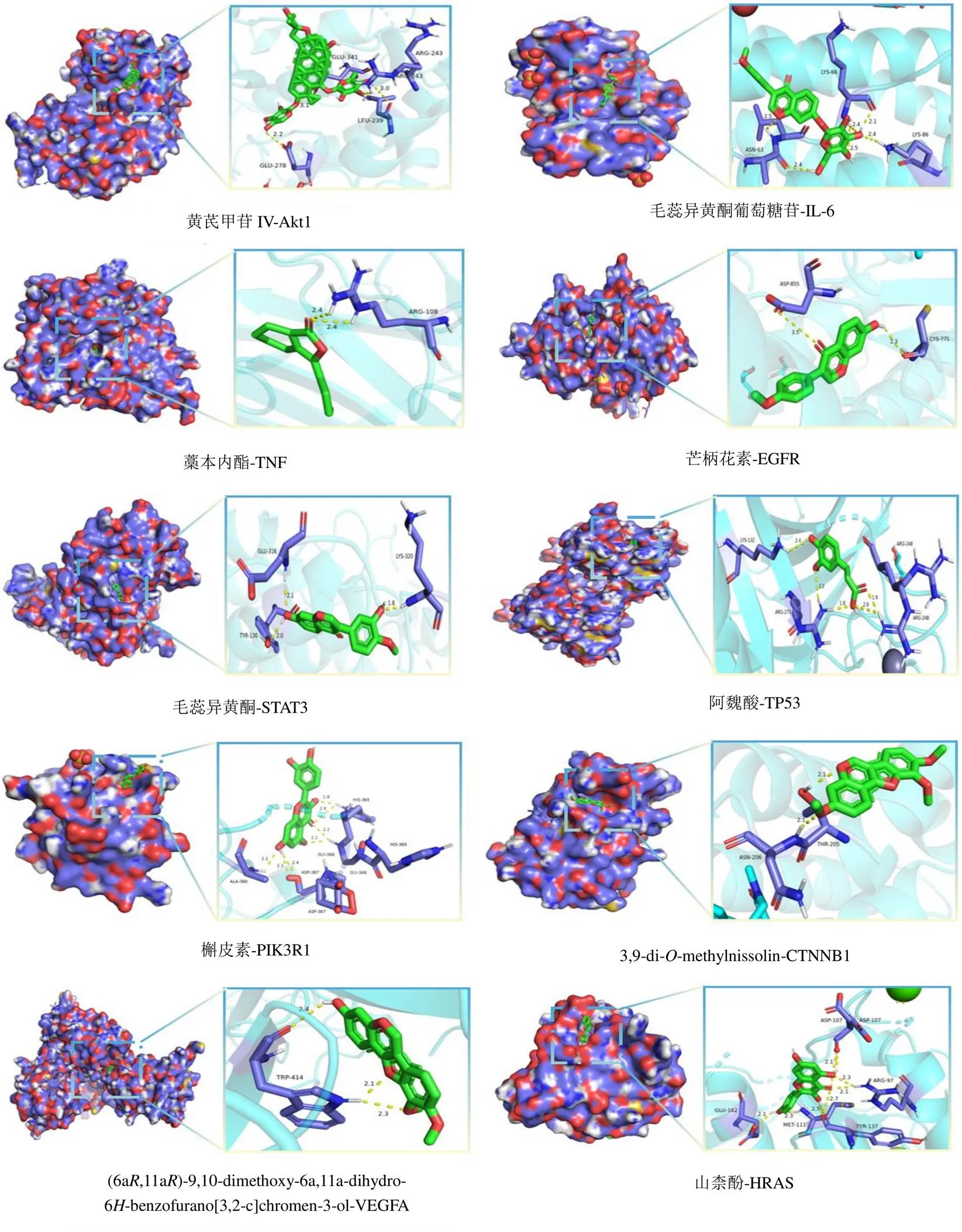
图6 部分分子对接结果可视化处理
表5 当归补血汤对CIRI大鼠神经功能损伤的影响(, n = 12)
Table 5 Effect of Danggui Buxue Decoction on neurological damage in CIRI rats (, n = 12)
组别剂量/(g·kg−1)神经行为学评分 假手术—0.00±0.00 模型—3.15±0.94*** 尼莫地平0.032 42.30±0.49# 当归补血汤5.842.85±0.72 11.672.31±0.78# 23.342.42±0.90#
与对照组比较:***<0.001;与模型组比较:#<0.05##<0.01###<0.001,下表同
***< 0.001control group;#< 0.05##< 0.01###< 0.001model group, same as below tables
3.8 当归补血汤对CIRI大鼠脑梗死面积的影响
如图7所示,假手术组大鼠脑组织并未观察到脑梗死情况,而模型组大鼠脑组织出现明显的脑梗死,脑梗死率高达(43.76±4.56)%。与模型组比较,尼莫地平能够明显降低大鼠脑梗死率(<0.05);当归补血汤中、高剂量组脑梗死率明显降低(<0.05、0.01)。
3.9 当归补血汤对CIRI大鼠脑组织病理形态的影响
如图8所示,假手术组大鼠脑组织软脑膜结构完整,炎性渗出不明显,血管丰富;皮质区神经元细胞形态正常,无细胞变性坏死、炎性细胞浸润或胶质细胞增生。而模型组脑组织皮质区可见坏死灶,坏死灶与周围正常组织分界较明显,坏死中央见神经元坏死,细胞崩解,胞质渗出,细胞核碎裂或溶解消失,坏死灶中央亦见核小呈圆形的胶质细胞增生,坏死灶周围神经元变性坏死,亦见胶质细胞增生。与模型组相比,各给药组脑组织病理形态学异常均得到改善,具体表现为皮质区坏死灶有所好转,少量神经元变性坏死,见少量胶质细胞增生。

与对照组比较:***P<0.001;与模型组比较:#P<0.05 ##P<0.01

A-神经元坏死 B-胶质细胞
3.10 当归补血汤对CIRI大鼠脑组织细胞凋亡的影响
TUNEL染色后,在荧光显微镜下,红色荧光为凋亡的细胞,蓝色荧光为细胞核。如图9所示,模型组可见细胞核收缩、染色质浓缩等典型的凋亡形态学特征;各给药组凋亡细胞数量均明显减少。定量分析结果见表6,与假手术组相比,模型组细胞凋亡率显著升高(<0.001);与模型组相比,各给药组细胞凋亡率显著降低(<0.05、0.01、0.001)。

图9 当归补血汤对CIRI大鼠脑组织细胞凋亡的影响(×400)
表6 各组大鼠脑组织细胞凋亡率(, n = 3)
Table 6 Cell apoptosis ratio in brain of rats in each group (, n = 3)
组别剂量/(g·kg−1)凋亡率/% 假手术—4.66±0.63 模型—28.21±2.68*** 尼莫地平0.032 49.71±1.12### 当归补血汤5.8425.13±0.95# 11.6721.07±0.54## 23.3417.40±1.18###
3.11 当归补血汤对CIRI大鼠血清中TNF-α、IL-6和IL-1β水平的影响
如表7所示,与假手术组相比,模型组大鼠血清中TNF-α、IL-6和IL-1β水平显著升高(<0.001);与模型组相比,各给药组大鼠血清中TNF-α水平显著降低(<0.05、0.01),尼莫地平组和当归补血汤中、高剂量组大鼠血清中IL-6和IL-1β水平显著降低(<0.05)。
表7 当归补血汤对CIRI大鼠血清中TNF-α、IL-6和IL-1β水平的影响(, n = 6)
Table 7 Effect of Danggui Buxue Decoction on levels of TNF-α, IL-6 and IL-1β in serum of CIRI rats (, n = 6)
组别剂量/(g·kg−1)TNF-α/(pg·mL−1)IL-6/(pg·mL−1)IL-1β/(pg·mL−1) 假手术—116.454±21.95944.155±5.23220.289±2.615 模型—156.976±14.899***58.239±3.565***31.521±2.573*** 尼莫地平0.032 4134.146±16.259#51.385±5.503#27.187±3.055# 当归补血汤5.84138.390±12.427#53.230±4.58529.015±2.949 11.67134.040±8.321#52.452±3.650#27.555±2.827# 23.34131.693±10.102##52.306±3.480#27.598±3.207#
3.12 当归补血汤对CIRI大鼠脑组织中TNF-α、IL-6和IL-1β mRNA表达的影响
如表8所示,与假手术组相比,模型组大鼠脑组织、和mRNA表达水平均显著升高(<0.001);与模型组相比,各给药组大鼠脑组织中、和mRNA表达水平均明显降低(<0.01、0.001)。
3.13 当归补血汤对CIRI大鼠脑组织中Akt、p-Akt、Bax、Bcl-2蛋白表达的影响
如图10和表9所示,与假手术组相比,模型组大鼠脑组织中p-Akt和Bcl-2蛋白表达水平显著降低(<0.001),Bax蛋白表达水平显著升高(<0.001);与模型组比较,各给药组大鼠脑组织p-Akt和Bcl-2蛋白表达水平均显著升高(<0.05、0.01、0.001),Bax蛋白表达水平显著降低(<0.05、0.001)。
表8 当归补血汤对CIRI大鼠脑组织IL-6、TNF-α和IL-1βmRNA表达的影响(, n = 3)
Table 8 Effect of Danggui Buxue Decoction on TNF-α, IL-6 and IL-1β mRNA expressions in brain of CIRI rats (, n = 3)
组别剂量/(g·kg−1)mRNA相对表达量 IL-6TNF-αIL-1β 假手术—0.996±0.0121.081±0.0710.899±0.088 模型—7.543±0.319***7.798±0.659***6.110±0.086*** 尼莫地平0.032 44.669±0.962###4.284±0.234###3.236±0.268### 当归补血汤5.845.365±0.323##5.812±0.091###4.040±0.327### 11.673.966±0.079###4.623±0.142###2.742±0.244### 23.342.540±0.345###2.458±0.175###2.361±0.204###

图10 各组大鼠脑组织Akt、p-Akt、Bax和Bcl-2蛋白表达的WB图
表9 当归补血汤对CIRI大鼠脑组织Akt、p-Akt、Bax和Bcl-2蛋白表达的影响(, n = 3)
Table 9 Effect of Danggui Buxue Decoction on Akt, p-Akt, Bax and Bcl-2 protein expressions in brain of CIRI rats (, n = 3)
组别剂量/(g·kg−1)蛋白相对表达量 Akt/GAPDHp-Akt/GAPDHBax/GAPDHBcl-2/GAPDH 假手术—0.680±0.0580.535±0.0360.244±0.0760.753±0.031 模型—0.763±0.067*0.119±0.036***0.857±0.049***0.169±0.025*** 尼莫地平0.032 40.717±0.0420.493±0.019###0.438±0.065###0.600±0.047### 当归补血汤5.840.731±0.0290.248±0.041##0.725±0.053#0.311±0.093# 11.670.722±0.0320.325±0.021###0.565±0.065###0.432±0.044## 23.340.679±0.046#0.445±0.022###0.450±0.061###0.597±0.029###
4 讨论
缺血性脑卒中常伴有神经功能障碍、脑梗死和病理学可观察到的组织损伤。以上各项指标可作为临床评价脑卒中病情的重要指标,亦可用于实验中药物治疗效果的评价。临床常通过再灌注治疗缺血性脑卒中,但随着脑组织恢复血液供应,将引起更严重的CIRI。目前,中和炎症反应、增加抗氧化能力被认为是治疗缺血性疾病的有益疗法[31]。TNF-α、IL-1β、IL-6是与CIRI的发生和发展密切相关的代表性促炎细胞因子,是影响炎症反应的关键因素。多项研究表明,TNF-α、IL-1β和IL-6可能成为防治CIRI的重要靶点[32-34]。分子对接结果表明,当归补血汤可能主要通过Akt1、转录因子AP-1(transcription factor AP-1,JUN)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、细胞肿瘤抗原p53(cellular tumor antigen p53,TP53)、TNF和IL-6等核心靶点治疗CIRI。同时,体内实验结果显示,当归补血汤组大鼠血清中IL-1β、IL-6和TNF-α水平明显降低,脑组织中、和mRNA表达水平显著降低。结合以上指标表明,当归补血汤能够通过减轻神经功能缺损、减少脑梗死面积、改善脑组织形态学异常、抑制炎症反应等方面发挥抗CIRI的作用。
本研究基于网络药理学,构建并分析当归补血汤抗CIRI的“活性成分-靶点-疾病”网络图,通过数据库搜索和筛选,获得当归补血汤的30种主要活性成分,分子对接研究显示其主要的活性成分与核心靶点均具有较好的结合活性,结合文献表明槲皮素[35]、芒柄花素[36]、毛蕊异黄酮[37]和阿魏酸[38]等可能是当归补血汤抗CIRI的主要药效物质基础。
KEGG通路富集分析表明,当归补血汤可能通过调控PI3K/Akt、MAPK等信号通路发挥抗CIRI的作用。其中,Akt1、JUN、EGFR、TP53、TNF和IL-6等62个核心靶点均富集于PI3K/Akt信号通路,作为一条关键的抗凋亡信号通路,激活PI3K/Akt,可使细胞凋亡受到抑制,线粒体功能得以改善,从而改善脑缺血再灌注所致的神经元损伤[39]。越来越多的证据表明,PI3K/Akt信号通路在CIRI中发挥重要作用[40-44]。Akt是一类抗凋亡调节因子,作为PI3K/Akt信号通路的核心效应器,当Akt磷酸化后可作用于Bcl-2蛋白家族,其中抗凋亡蛋白Bcl-2充当线粒体守门人,抑制细胞凋亡[45]。Bax蛋白位于细胞质中,是Bcl-2家族中的一员,当细胞发生调亡时,Bax可以迁移到线粒体膜中,使细胞色素C得到释放,加速细胞凋亡。此外,凋亡是否发生取决于Bcl-2/Bax表达,据报道,Bcl-2/Bax值的降低与凋亡的增加有关[46]。本研究表明,在模型大鼠脑组织中,细胞凋亡指数显著升高,p-Akt/Akt和Bcl-2/Bax显著降低,而当归补血汤可显著降低细胞凋亡指数,上调p-Akt/Akt和Bcl-2/Bax,表明当归补血汤可能通过激活PI3K/Akt信号通路,进一步调节Bcl-2和Bax蛋白表达,发挥抗凋亡作用而保护CIRI,初步验证了网络药理学的预测结果。
秦秀德等[47]总结张伯礼院士治疗脑卒中的方法,发现其更注重补气养阴、化痰、清热活血。当归补血汤作为益气补血的代表方,方中重用黄芪以大补脾肺、益气生血,再加少许当归滋补血营、阳生阴久、气旺血生[48],目前已有相关研究对其进行初步证实,研究表明当归补血汤可保护CIRI的神经组织[19-21]。本研究结合网络药理学、分子对接和动物实验,首次对当归补血汤治疗CIRI的机制进行研究,明确了当归补血汤多成分、多靶点的协同作用机制。同时,借助改良Longa线栓法复制的CIRI大鼠模型,证实当归补血汤可以通过调节PI3K/Akt信号通路抑制炎症来减少脑组织中细胞的凋亡,从而保护大鼠脑组织。本研究为当归补血汤抗CIRI的更深层次研究提供理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Goda T, Oyama N, Kitano T,. Prestroke conditions of acute ischemic stroke patients are associated with functional outcome after mechanical thrombectomy [J]., 2020, 29(2): 104540.
[2] Dong Q, Dong Y, Liu L P,. The Chinese Stroke Association scientific statement: Intravenous thrombolysis in acute ischaemic stroke [J]., 2017, 2(3): 147-159.
[3] Lin L, Wang X, Yu Z. Ischemia-reperfusion injury in the brain: Mechanisms and potential therapeutic strategies [J]., 2016, 5(4): 213.
[4] Pan J, Konstas A A, Bateman B,. Reperfusion injury following cerebral ischemia: Pathophysiology, MR imaging, and potential therapies [J]., 2007, 49(2): 93-102.
[5] Jin R, Liu L, Zhang S H,. Role of inflammation and its mediators in acute ischemic stroke [J]., 2013, 6(5): 834-851.
[6] Li P Y, Stetler R A, Leak R K,. Oxidative stress and DNA damage after cerebral ischemia: Potential therapeutic targets to repair the genome and improve stroke recovery [J]., 2018, 134(Pt B): 208-217.
[7] Jiang X Y, Andjelkovic A V, Zhu L,. Blood-brain barrier dysfunction and recovery after ischemic stroke [J]., 2018, 163/164: 144-171.
[8] Kalogeris T, Baines C P, Krenz M,. Cell biology of ischemia/reperfusion injury [J]., 2012, 298: 229-317.
[9] Yang J L, Mukda S, Chen S D. Diverse roles of mitochondria in ischemic stroke [J]., 2018, 16: 263-275.
[10] Ma Y Y, Liu Y Q, Zhang Z J,. Significance of complement system in ischemic stroke: A comprehensive review [J]., 2019, 10(2): 429-462.
[11] Han S Y, Hong Z Y, Xie Y H,. Therapeutic effect of Chinese herbal medicines for post stroke recovery: A traditional and network meta-analysis [J]., 2017, 96(49): e8830.
[12] Sun K, Fan J Y, Han J Y. Ameliorating effects of traditional Chinese medicine preparation, Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage [J]., 2015, 5(1): 8-24.
[13] 于潇, 王贵阳, 侯宇东, 等. 中药抗脑缺血再灌注损伤的作用及其机制的研究进展 [J]. 中草药, 2021, 52(5): 1471-1484.
[14] 胡建鹏. 益气活血法对脑缺血再灌注大鼠神经细胞凋亡Fas/FasL信号转导通路与调控的研究 [D]. 北京: 北京中医药大学, 2004.
[15] 王永炎. 中医内科学 [M]. 上海: 上海科学技术出版社, 2016: 124-132.
[16] Peng T M, Jiang Y Z, Farhan M,. Anti-inflammatory effects of traditional Chinese medicines on preclinicalmodels of brain ischemia-reperfusion-injury: Prospects for neuroprotective drug discovery and therapy [J]., 2019, 10: 204.
[17] Zhang B, Saatman K E, Chen L. Therapeutic potential of natural compounds from Chinese medicine in acute and subacute phases of ischemic stroke [J]., 2020, 15(3): 416-424.
[18] Lin P L, Li Z C, Xie R F,. Compatibility study of Danggui Buxue Tang on chemical ingredients, angiogenesis and endothelial function [J]., 2017, 7: 45111.
[19] 余晴晴, 柏建峰, 王江军. 当归补血汤对脑缺血再灌注损伤大鼠血管新生及Ang-1、Ang-2、VEGF和Tie-2的影响 [J]. 国际医药卫生导报, 2017, 23(9): 1317-1321.
[20] 高晓兰, 王强, 陈彦文, 等. 当归补血汤及其加味方对大鼠脑缺血再灌注损伤的保护作用研究 [J]. 时珍国医国药, 2013, 24(12): 2885-2887.
[21] 陆莹, 罗亚非, 范瑞娟. 当归补血汤对大鼠局灶性脑缺血再灌注血-脑屏障和大脑皮质神经元的影响 [J]. 神经解剖学杂志, 2013, 29(3): 301-305.
[22] Boezio B, Audouze K, Ducrot P,. Network-based approaches in pharmacology [J]., 2017, 36: 1700048.
[23] Li S, Zhang B. Traditional Chinese medicine network pharmacology: Theory, methodology and application [J]., 2013, 11(2): 110-120.
[24] 牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[25] Tang Y, Li M, Wang J X,. CytoNCA: A cytoscape plugin for centrality analysis and evaluation of protein interaction networks [J]., 2015, 127: 67-72.
[26] Wang C Q, Jiang W, Li W,. Topological properties of the drug targets regulated by microRNA in human protein-protein interaction network [J]., 2011, 19(5): 354-364.
[27] Rickels E. Middle cerebral artery occlusion in rats: A neurological and pathological evaluation of a reproducible model [J]., 1993, 32(3): 479.
[28] Woodruff T M, Thundyil J, Tang S C,. Pathophysiology, treatment, and animal and cellular models of human ischemic stroke [J]., 2011, 6(1): 11.
[29] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[30] Hsin K Y, Ghosh S, Kitano H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology [J]., 2013, 8(12): e83922.
[31] Pan Z H, Cui M D, Dai G L,. Protective effect of anthocyanin on neurovascular unit in cerebral ischemia/reperfusion injury in rats [J]., 2018, 12: 947.
[32] Lin S Y, Wang Y Y, Chang C Y,. TNF-α receptor inhibitor alleviates metabolic and inflammatory changes in a rat model of ischemic stroke [J]., 2021, 10(6): 851.
[33] Liu S J, Zhu S Y, Zou Y,. Knockdown of IL-1β improves hypoxia-ischemia brain associated with IL-6 up-regulation in cell and animal models [J]., 2015, 51(2): 743-752.
[34] Gertz K, Kronenberg G, Kälin R E,. Essential role of interleukin-6 in post-stroke angiogenesis [J]., 2012, 135(Pt 6): 1964-1980.
[35] Ashrafizadeh M, Samarghandian S, Hushmandi K,. Quercetin in attenuation of ischemic/reperfusion injury: A review [J]., 2021, 14(4): 537-558.
[36] Wu Q L, Cheng Y Q, Liu A J,. Formononetin recovered injured nerve functions by enhancing synaptic plasticity in ischemic stroke rats [J]., 2020, 525(1):67-72.
[37] Hsu C C, Kuo T W, Liu W P,. Calycosin preserves BDNF/TrkB signaling and reduces post-stroke neurological injury after cerebral ischemia by reducing accumulation of hypertrophic and TNF-α-containing microglia in rats [J]., 2020, 15(2): 326-339.
[38] Cheng C Y, Tang N Y, Kao S T,. Ferulic acid administered at various time points protects against cerebral infarction by activating p38 MAPK/p90RSK/ CREB/Bcl-2 anti-apoptotic signaling in the subacute phase of cerebral ischemia-reperfusion injury in rats [J]., 2016, 11(5): e0155748.
[39] Wang C Y, Wan H Z, Li M,. Celastrol attenuates ischemia/reperfusion-mediated memory dysfunction by downregulating AK005401/MAP3K12 [J]., 2021, 82: 153441.
[40] Feng C, Wan H F, Zhang Y Y,. Neuroprotective effect of Danhong Injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway [J]., 2020, 11: 298.
[41] Yu Y, Jia X J, Zong Q F,. Remote ischemic postconditioning protects the heart by upregulating ALDH2 expression levels through the PI3K/Akt signaling pathway [J]., 2014, 10(1): 536-542.
[42] Zhang Y Q, Wang H Y, Li H,. Gualou Guizhi Granule protects against OGD/R-induced injury by inhibiting cell pyroptosis via the PI3K/Akt signaling pathway [J]., 2021, 2021: 6613572.
[43] Zhang H Y, Song Y M, Feng C. Improvement of cerebral ischemia/reperfusion injury by daucosterol palmitate-induced neuronal apoptosis inhibition via PI3K/Akt/ mTOR signaling pathway [J]., 2020, 35(6): 1035-1044.
[44] Liang K, Ye Y, Wang Y,. Formononetin mediates neuroprotection against cerebral ischemia/reperfusion in rats via downregulation of the Bax/Bcl-2 ratio and upregulation PI3K/Akt signaling pathway [J]., 2014, 344(1/2): 100-104.
[45] Wang P P, Zhao M Y, Chen Z H,. Hydrogen gas attenuates hypoxic-ischemic brain injury via regulation of the MAPK/HO-1/PGC-1a pathway in neonatal rats [J]., 2020, 2020: 6978784.
[46] Uzdensky A B. Apoptosis regulation in the penumbra after ischemic stroke: Expression of pro- and antiapoptotic proteins [J]., 2019, 24(9/10): 687-702.
[47] 秦秀德, 刘玉, 吴彦青, 等. 张伯礼院士治疗中风恢复期及后遗症期处方统计分析 [J]. 新中医, 2017, 49(3): 19-21.
[48] 金·李东垣. 内外伤辨惑论 [M]. 北京: 中国医药科技出版社, 2011: 24.
Mechanism of Danggui Buxue Decoction in intervention of experimental cerebral ischemia reperfusion injury in rats based on PI3K/Akt signaling pathway
SHI Ya1, 2, LIU Wen1, 2, 3, LIU Xing-de1, SONG Xin-li1, 2, LI Xin1, 2, SHU Wan-fen1, 2, ZHANG Gan-chun1, 2, QIN Qin1, 2, WANG Hong-xin1, 2
1. Guizhou Medical University, Guiyang 550025, China 2. Guizhou Traditional Chinese Medicine Processing and Preparation Engineering Technology Research Center, National Miao Medicine Engineering Technology Research Center, School of Pharmacy, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China 3. Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China
To explore the interventional effect and related mechanism of Danggui Buxue Decoction (当归补血汤) on rats with cerebral ischemia reperfusion injury (CIRI) based on network pharmacology combined withexperiments.Active ingredients in Danggui Buxue Decoction and targets for the treatment of CIRI were collected from databases, protein-protein interaction (PPI) network was constructed, gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis were performed; Key targets and main active ingredients were selected for molecular docking by AutoDock software. After SD rats were given nimodipine or Danggui Buxue Decoction for 2 weeks, middle cerebral artery occlusion/reperfusion (MCAO/R) model was established by modified Longa suture method, neurobehavioral scores were evaluated And brain tissue infarct size was determined; TUNEL staining was used to determine the apoptosis of brain tissue; Hematoxylin-eosin (HE) staining was used to investigate the pathological changes of brain tissue; Levels of tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6) and IL-1β in serum were determined by ELISA; qRT-PCR was used to detect the mRNA expressions of,andin brain tissue; Western blotting was used to detect protein expressions of protein kinase B (Akt), phosphorylated Akt (p-Akt), B-cell lymphoma-2 (Bcl-2) and Bcl-2 associated X protein (Bax) in brain tissue.Thirty active ingredients of Danggui Buxue Decoction were screened out, 467 targets and 55 core targets of Danggui Buxue Decoction in the treatment of CIRI were obtained. KEGG pathway enrichment analysis showed that phosphatidylinositol-3-kinase (PI3K)/Akt signaling pathway was one of key mechanisms of Danggui Buxue Decoction against CIRI. Molecular docking showed that main active components in Danggui Buxue Decoction had relatively stable binding activities with core targets such as Akt1, signal transducer and activator of transcription 3 (STAT3), and transcription factor AP-1 (JUN), epidermal growth factor receptor (EGFR), cellular tumor antigen p53 (TP53), TNF and IL-6. The results of animal experiments showed that Danggui Buxue Decoction improved the neurological function damage in CIRI rats (< 0.05), reduced the infarct size of brain tissue (< 0.05, 0.01), alleviated the pathological damage of brain tissue, reduced the apoptosis index of brain tissue (< 0.05, 0.01, 0.001), decreased TNF-α, IL-6 and IL-1β levels in serum (< 0.05, 0.01), decreased,andmRNA expressions in brain tissue (< 0.01, 0.001), activated PI3K/Akt signaling pathway by increasing the phosphorylation level of Akt in brain tissue (< 0.01, 0.001), further up-regulated Bcl-2 protein expression (< 0.05, 0.01, 0.001), and down-regulated Bax protein expression (< 0.05, 0.001).Danggui Buxue Decoction may treat CIRI by acting on multiple targets and multiple pathways, and its mechanism is related to affecting the expression of Akt1, TNF, IL-6, IL-1β and other proteins, thereby regulating PI3K/Akt signaling pathway to inhibit inflammation and apoptosis.
Danggui Buxue Decoction; cerebral ischemia reperfusion injury; network pharmacology; PI3K/Akt signaling pathway; inflammatory response; cell apoptosis; calycosin-7--glucoside; calycosin; ferulic acid; formononetin; ligustolide; astragaloside IV
R285.5
A
0253 - 2670(2022)16 - 5052 - 14
10.7501/j.issn.0253-2670.2022.16.015
2022-05-17
国家自然科学基金资助项目(82060704);贵州省特色功能食品与中药制剂开发攻关平台项目(黔教合KY字[2020]006);贵州中医药大学药用高分子材料研究中心项目(贵中医党办发[2019]70)
石 娅(1993—),女,硕士研究生,研究方向为中药新技术与新制剂研究。Tel: 18285148380 E-mail: 328697640@qq.com
刘 文(1969—),男,博士生导师,教授,研究方向为中药新技术与新制剂研究。E-mail: 642771631@qq.com
[责任编辑 李亚楠]
