木犀草素对癫痫持续状态幼鼠海马组织神经细胞保护作用的机制研究
2022-08-11周琴孔海波王艳茹何保梅
周琴 孔海波 王艳茹 何保梅
癫痫持续状态(status epilepticus,SE)可导致以海马组织为主的脑损伤,其病理学基础包括细胞凋亡与坏死[1]。由于SE后的细胞凋亡具有可调控性,故其研究日益受到重视[2]。笔者团队前期研究发现,在SE大鼠的海马组织中,Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB信号通路被激活,进一步促进了下游炎症因子的释放,提示免疫炎症反应参与了SE后的脑损伤[3]。木犀草素是存在于多种植物中的一种天然黄酮类物质,具有抗炎、抗氧化、抑制凋亡等多种生物药理学作用[4]。本研究通过构建发育期SE幼年大鼠(下称幼鼠)模型,并使用木犀草素干预,旨在研究木犀草素是否可通过TLR4/NF-kB信号通路抑制SE后幼鼠脑内海马组织的免疫炎症反应及细胞凋亡,从而起到脑保护的作用。
1 材料和方法
1.1 实验动物 21日龄清洁级雄性SD幼鼠156只,体重50~80g,购于浙江中医药大学实验动物中心[合格证号:SYXK(浙)2020-0024]。幼鼠饲养在杭州鹰旸生物医药研发中心动物实验室,相对湿度70%,温度25℃,昼夜照明12 h/12 h变化。本实验经杭州鹰旸生物医药研发中心实验动物伦理委员会批准(伦理批准编号:EYOUNG-20201124-04)。
1.2 试剂和仪器 主要试剂:氯化锂(批号:K73036)、匹罗卡品(批号:K80477)均购于美国Fluka公司;溴化甲基东莨菪碱(批号:S8502)购于美国Sigma公司;木犀草素(批号:B20888)购于上海源叶生物科技有限公司;逆转录试剂盒(批号:CW2569)购于江苏康为世纪生物科技有限公司;SYBR Premix Ex Taq Ⅱ(批号:RR820A)购于日本Takara公司;BCA蛋白定量试剂盒(批号:pc0020)、蛋白marker(批号:PR1910)均购于北京Solarbio科技有限公司;TLR4一抗(批号:AF7017)和二抗(批号:S0009)均购于美国Afinity公司。TUNEL试剂盒(批号:G1501)购于武汉Servicebio生物科技有限公司。主要仪器:Micro17R低温高速离心机购自美国Thermo公司;CFX Connect实时荧光定量PCR仪购自美国BIO RAD公司;EPS300电泳仪、EPS300电泳槽、VE186转膜仪均购自浙江天能公司;610020-9Q化学发光仪购自上海勤翔科学仪器有限公司;RM2016病理切片机购自上海徕卡仪器有限公司;Nikon Eclipse C1正置荧光显微镜、Nikon DS-U3成像系统均购自日本尼康公司。
1.3 动物分组与模型制作 (1)动物分组:按照随机数字表法将幼鼠分为对照组12只、模型组48只、木犀草素1组(低剂量20 mg/kg)48只和木犀草素2组(高剂量50 mg/kg)48只,其中模型组、木犀草素1组和木犀草素2组在癫痫发作后的1、2、3和7 d分别处死12只幼鼠。(2)SE模型制作:采用氯化锂-匹罗卡品法制作幼鼠SE模型,幼鼠先予127 mg/kg氯化锂,所有给药方式均为腹腔注射,18 h后给予1 mg/kg溴化甲基东莨菪碱,30 min后予100 mg/kg匹罗卡品。幼鼠癫痫发作程度分级[5]:0级,无惊厥发作;Ⅰ级,面部抽动;Ⅱ级,节律性点头;Ⅲ级,前肢阵挛抽搐;Ⅳ级,全身强直伴站立;Ⅴ级,全身强直阵挛。惊厥程度达Ⅳ级以上,持续达30 min,且惊厥后幼鼠一般状况良好的为合格幼鼠模型。幼鼠癫痫发作30 min时给予1 mg/kg阿托品和400 mg/kg水合氯醛,SE后幼鼠给予光照取暖,30 min后予以0.9%氯化钠注射液和10%葡萄糖注射液各10 ml/kg。对照组以0.9%氯化钠注射液取代匹罗卡品,其余用药均同模型组。木犀草素1组和木犀草素2组在幼鼠惊止后30 min,予不同剂量的木犀草素(20、50 mg/kg),此后每天重复注射1次,直到处死。
1.4 幼鼠脑标本的采取及制作 幼鼠经腹腔注射400 mg/kg水合氯醛麻醉,断头完整分离出海马,右侧放入-80℃液氮中保存;左侧置于4%多聚甲醛中固定,脱水、石蜡包埋。
1.5 幼鼠海马组织中TLR4、NF-κB、半胱氨酸门冬氨酸特异性蛋白酶3(cysteine-containing aspartate-specific proteases-3,Caspase-3)、TNF-α mRNA表达水平检测 采用qRT-PCR法。取右侧海马标本制作匀浆,TRI Reagent法提取总RNA,按照逆转录试剂盒说明书进行逆转录反应。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,反应条件:95 ℃,10 min变性;95 ℃,15 s;60 ℃,60 s;40次循环。引物序列见表1。采用2-ΔΔCt法计算TLR4、NF-κB、Caspase-3、TNF-α相对表达量。

表1 引物序列(5'-3')
1.6 幼鼠海马组织中TLR4蛋白表达水平检测 采用Western blot法。经液氮研磨后的右侧海马标本放入离心管,蛋白定量采用BCA蛋白定量试剂盒,取等量缓冲液与样本混匀后进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,并转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉室温封闭2 h,加一抗后4℃孵育过夜,TBST洗膜10 min×3次,加二抗孵育1 h,TBST洗膜10 min×3次,最后曝光、显影。目的蛋白的表达水平以TLR4蛋白条带与内参GAPDH条带的灰度值比值来表示。
1.7 幼鼠海马组织神经细胞凋亡情况检测 采用TUNEL法。取石蜡切片,定位于海马CA1区,常规脱蜡脱水后,用蛋白酶K消化,滴加平衡缓冲液,孵育20 min,弃去缓冲液,滴加适量TDT酶、dUTP、buffer按1∶5∶50比例混合液,37℃孵育2 h,DAPI复染细胞核。最后荧光显微镜观察并采集图像,显色蓝色为正常细胞,绿色为阳性的凋亡细胞。神经细胞凋亡率=阳性的凋亡细胞数/总细胞数×100%。
1.8 统计学处理 采用SPSS 16.0统计软件。计量资料以表示,方差齐性时,多组间比较采用单因素方差分析,两两比较采用SNK-q检验;方差不齐时,多组间比较采用Kruskal-WallisH检验,两两比较采用Dunnett's T3检验。P<0.05为差异有统计学意义。
2 结果
2.1 癫痫发作后1、2、3和7 d各组幼鼠海马组织中TLR4、NF-κB、Caspase-3、TNF-α mRNA表达水平比较 与对照组比较,癫痫发作后1、2、3和7 d模型组幼鼠海马组织中TLR4、NF-κB、Caspase-3、TNF-α mRNA表达水平均升高(均P<0.01);与模型组比较,癫痫发作后1、2、3和7 d木犀草素2组幼鼠海马组织中TLR4、NF-κB、Caspase-3、TNF-α mRNA表达水平均降低(均P<0.05);癫痫发作后3和7 d木犀草素1组幼鼠海马组织中TLR4 mRNA表达水平均降低(均P<0.05),癫痫发作后1和3 d木犀草素1组幼鼠海马组织中Caspase-3 mRNA表达水平均降低(均P<0.05),癫痫发作后3 d木犀草素1组幼鼠海马组织中TNF-α mRNA表达水平降低(P<0.01),见表2。

表2 癫痫发作后1、2、3和7 d各组幼鼠海马组织中TLR4、NF-κB、Caspase-3、TNF-α mRNA表达水平比较
2.2 癫痫发作后1、2、3和7 d各组幼鼠海马组织中TLR4蛋白表达水平比较 与对照组比较,癫痫发作后1、2、3和7 d模型组幼鼠海马组织中TLR4蛋白表达水平均升高(均P<0.01)。与模型组比较,癫痫发作后1、2、3和7 d木犀草素2组幼鼠海马组织中TLR4蛋白表达水平均降低(均P<0.01),仅在癫痫发作后7 d木犀草素1组幼鼠海马组织中TLR4蛋白表达水平降低(P<0.05),见图1和表3。

图1 癫痫发作后1、2、3和7 d各组幼鼠海马组织中TLR4蛋白表达的电泳图
表3 癫痫发作后1、2、3和7 d各组幼鼠海马组织中TLR4蛋白表达水平比较
2.3 癫痫发作后1、2、3和7 d各组幼鼠海马组织神经细胞凋亡率比较 与对照组比较,癫痫发作后1、2、3和7 d模型组幼鼠海马组织神经细胞凋亡率均升高(均P<0.01);与模型组比较,癫痫发作后1、2、3和7 d木犀草素2组幼鼠海马组织神经细胞凋亡率均降低(均P<0.01),癫痫发作后2、3和7 d木犀草素1组幼鼠海马组织神经细胞凋亡率均降低(均P<0.05),见图2和表4。
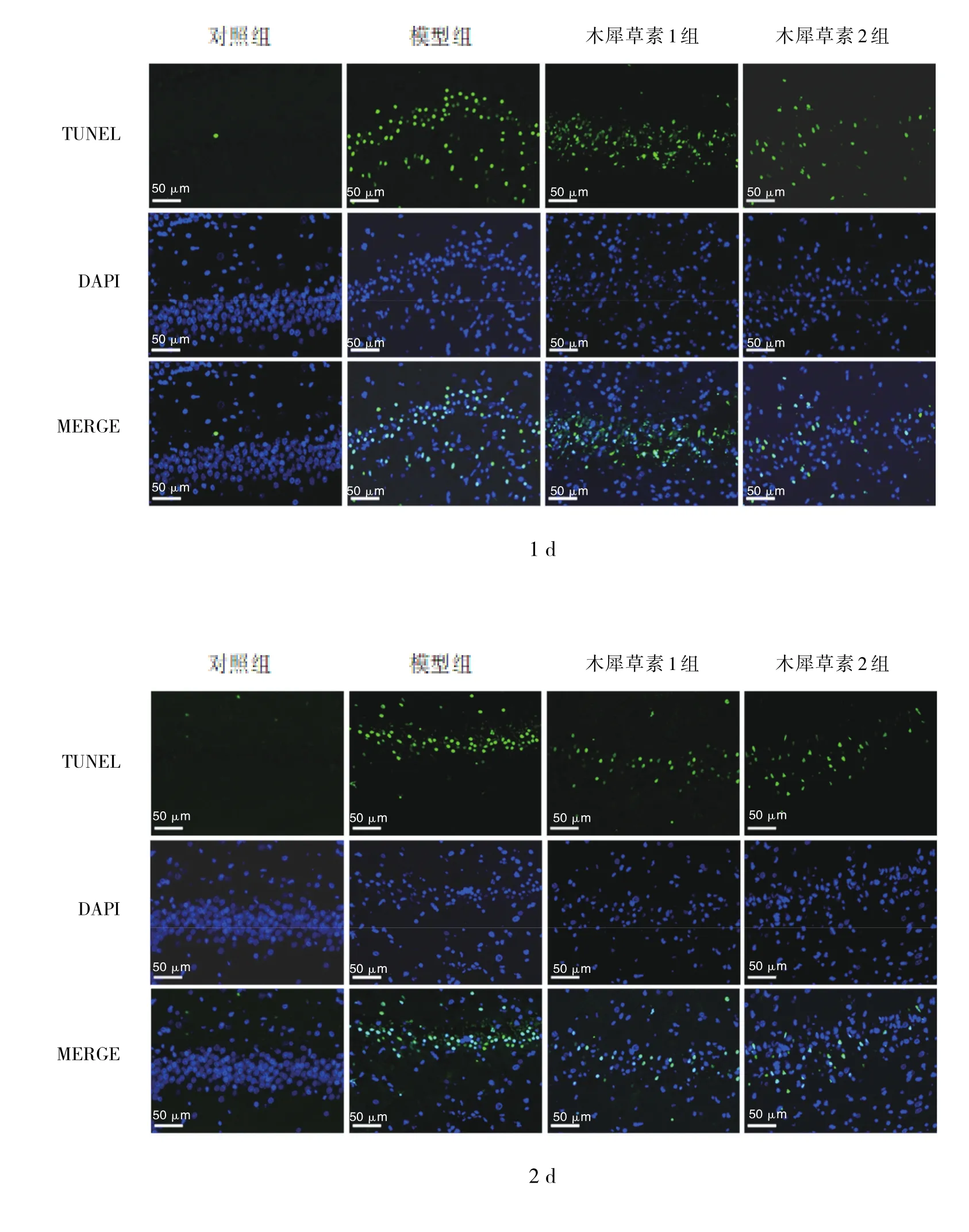

图2 癫痫发作后1、2、3和7 d各组幼鼠海马组织神经细胞凋亡表达情况(TUNEL染色,×400)
表4 癫痫发作后1、2、3和7 d各组幼鼠海马组织神经细胞凋亡率比较(%)
3 讨论
SE是小儿时期最常见的中枢神经系统急危重症之一,可引起学习、记忆和认知损害,给患儿的生活造成极大影响[6]。海马是癫痫发作后脑损伤的重要部位,其主要病理特征是过度的免疫炎症,以及神经细胞的坏死、凋亡、丢失等[7],抑制海马区免疫炎症反应及神经细胞凋亡,对于预防及减轻癫痫发作后的脑损伤至关重要。
TLR4是重要的天然免疫受体,参与了中枢神经系统损伤后的免疫应答[8]。研究发现,TLR4可表达于癫痫小鼠海马区的神经胶质细胞和神经元中[9],通过抑制TLR4可预防毛果芸香碱诱发的大鼠癫痫发作[10]。本实验结果显示,SE幼鼠海马组织中TLR4 mRNA和蛋白表达水平均升高,在惊厥后24 h达到高峰。此结果说明,在SE后的幼鼠海马组织中,TLR4被迅速激活。同时,本实验也发现,癫痫发作后1、2、3和7 d幼鼠海马组织中NF-κB、TNF-α mRNA表达水平均升高,其变化趋势与TLR4基本一致,提示NF-κB在癫痫发作后也迅速活化,并促使TNF-α的合成与释放。这一结果说明,TLR4/NF-κB通路参与了幼鼠SE后海马内的免疫炎症反应。
近年来,木犀草素的神经保护作用日益得到重视[11]。Lin等[12]研究发现木犀草素可以减少海人酸所致癫痫大鼠的海马损伤,减轻癫痫发作的程度,通过减少谷氨酸水平,减轻炎症反应。在戊四氮所致大鼠和小鼠癫痫模型中,使用木犀草素可以减轻癫痫的发作时间和强度,减轻癫痫后期的认知损害,减少脑神经的氧化应激损伤[13-14]。本实验观察到,经高剂量的木犀草素干预后,海马组织中TLR4、NF-κB、TNF-α表达水平均有降低,而低剂量的木犀草素干预效果欠佳。这一结果提示,木犀草素可通过抑制TLR4/NF-κB通路,减轻癫痫发作后海马的免疫炎症反应,且高剂量的抑制效果更佳。
Caspase-3在海马组织凋亡中起最后枢纽作用,是激活凋亡途径最关键的执行蛋白酶[15]。本实验发现,在癫痫发作后24 h Caspase-3 mRNA的表达已迅速达到高峰,此后随时间的延长表达水平逐步下降,其变化趋势与检测到的神经细胞凋亡率一致,这一结果表明,SE后幼鼠海马区出现了细胞凋亡的过度激活。在癫痫造模后给予高剂量的木犀草素干预,海马组织中Caspase-3表达水平及神经细胞凋亡率均降低,而低剂量抑制效果有限,提示高剂量的木犀草素能更好地抑制幼鼠SE后海马组织神经细胞中Caspase-3的激活,减少神经细胞凋亡。
综上所述,木犀草素可减轻SE幼鼠海马组织的炎症反应和细胞凋亡,其机制可能是通过调控TLR4/NF-κB通路来达到神经保护作用。
