儿童肺炎支原体感染对免疫功能影响的研究
2022-08-11侯秋英杨敏玲祝峰章爱莲
侯秋英 杨敏玲 祝峰 章爱莲
肺炎支原体(Mycoplasma pneumoniae,MP)是引起儿童下呼吸道感染的常见病原体,易感对象主要是5~14岁儿童[1]。近年来MP肺炎重症较为多见,表现为起病迅速、病情危重等特点,如不及时治疗,会对肺组织及肺外器官造成损伤[2],其作用机制可能与大量炎症介质释放有关[3-4]。既往研究显示,T淋巴细胞亚群功能紊乱在MP肺炎发病中起关键作用[5]。CD4+CD25+调节性T细胞(regulatory T cell,Treg)是具有高度抑制活性的Treg,占CD4+T细胞的5%~10%,主要调节效应T细胞清除病原体反应和炎症引起过度免疫反应之间的平衡[6]。已有研究报道显示,机体CD4+CD25+Treg细胞数量与病情严重程度和预后有密切关系[7]。Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB信号通路是机体最重要的炎症信号通路之一,可以调控机体炎症反应,促进炎性因子释放,参与感染性疾病的进展[8]。本研究探讨儿童MP感染对机体免疫功能的影响,以期为临床评估重症MP感染提供依据。
1 对象和方法
1.1 对象 选取2019年1月至2022年1月嘉兴市第二医院收治的儿童MP肺炎84例为研究对象,其中重症组39例,轻症组45例。重症组男22例,女17例;年龄2~12岁,中位年龄7(5,9)岁;表现为肺实变15例,肺不张3例,胸腔积液6例,肺外表现2例(头痛1例、心肌炎1例);轻症组男24例,女21例;年龄2~12岁,中位年龄7(6,8.25)岁。纳入标准:符合儿童MP肺炎的相关诊断标准[9],同时符合以下条件:(1)咳嗽伴发热;(2)MP感染标准:痰MP DNA>1.0×103copies/ml或双份血清MP-IgM阳性;(3)所有患儿检测前未使用抗菌药物、糖皮质激素及免疫抑制剂;(4)临床资料完整。重症MP肺炎诊断标准参考儿童社区获得性肺炎诊疗规范[10],符合以下任何一种情况属于重症:(1)有肺外并发症者;(2)一般情况差;(3)有意识障碍;(4)低氧血症;(5)超高热或持续高热>5 d;(6)有脱水征/拒食;(7)≥2/3一侧肺浸润、多叶肺浸润、胸腔积液、气胸、肺不张、肺坏死及肺脓肿。排除标准:(1)有细菌、病毒、真菌感染及肺结核、哮喘等疾病者;(2)血液系统疾病者;(3)使用糖皮质激素或免疫调节剂者;(4)支气管肺先天畸形或结构异常者;(5)存在认知功能发育障碍者。另选取同期本院健康体检儿童40名作为对照组,男22名,女18名;年龄2~12岁,中位年龄7(5,8.75)岁。3组儿童性别、年龄比较差异均无统计学意义(均P>0.05)。本研究经医院医学伦理委员会审批通过(伦理编号:jxey-2018053),8岁以上儿童均知情,所有患儿的法定监护人知情并签署知情同意书。
1.2 方法 所有儿童于清晨空腹抽取静脉血3 ml,置于黄色管中,24 h内将标本离心10 min(3 000 r/min,离心半径8 cm),分离血清,弃溶血标本,取上清液-70℃冻存待测。同时在紫色抗凝管里采集静脉血1 ml,轻轻摇晃后立即送至检验科,行WBC及超敏C-反应蛋白(high sensitivity C-reactive protein,hs-CRP)检测。(1)WBC和hs-CRP检测 使用深圳迈瑞生物公司血常规分析仪器BC2600检测WBC,乳胶增强免疫散射比浊法检测hs-CRP。(2)血清炎症因子水平检测:使用郑州安图公司PHOMO酶标分析仪,采用ELISA法检测IL-6水平。使用美国BECTON DICKINSON公司的流式细胞仪,采用ELISA法检测TNF-α水平。(3)血清Ig水平检测:使用西门子公司特种蛋白分析仪,采用速率散射比浊法检测 IgA、IgG、IgM。(4)外周血 CD3+、CD4+、CD8+、CD4+/CD8+T淋巴细胞亚群及CD4+CD25+Treg水平检测:使用FACSCanto Ⅱ流式细胞仪(美国BD Biosciences公司),并计算百分比。(5)TLR4/NF-κB信号通路相关蛋白表达水平检测:采用Western blot法。Ficoll密度梯度离心法分离外周血单个核细胞,采用RIPA细胞裂解液提取单个核细胞总蛋白,依次进行蛋白定量、电泳、转膜、封闭,加入兔抗人一抗β-ac-tin、TLR4、髓样分化因子 88(myeloid differ-entiation factor 88,MyD88)、磷酸化NF-κB(p-NF-κB)p65、NF-κB p65、NF-κB抑制蛋白(inhibitor of NF-κB-α,IκB-α)和磷酸化IκB-α(p-IκB-α),4 ℃孵育过夜,加辣根过氧化物酶标记的二抗,室温孵育2 h,滴加ECL于暗室曝光显影,以β-actin作为内参,分析对比条带强弱。
1.3 统计学处理 采用SPSS 22.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。Pearson相关分析TLR4/NF-κB信号通路相关蛋白与炎症因子、T淋巴细胞之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 3组儿童WBC、hs-CRP和血清炎症因子水平比较 重症组和轻症组患儿WBC、hs-CRP、IL-6、TNF-α水平均高于对照组,差异均有统计学意义(均P<0.05),重症组患儿WBC、hs-CRP、IL-6、TNF-α水平均高于轻症组,差异均有统计学意义(均P<0.05),见表1。

表1 3组儿童WBC、hs-CRP和血清炎症水平比较
2.2 3组儿童血清Ig水平比较 重症组和轻症组患儿IgA水平均低于对照组,重症组患儿IgA水平低于轻症组,差异均有统计学意义(均P<0.05);重症组患儿IgM水平高于对照组,差异有统计学意义(P<0.05),见表2。

表2 3组儿童血清Ig水平比较
2.3 3组儿童外周血T淋巴细胞水平比较 重症组和轻症组患儿 CD3+、CD4+、CD4+/CD8+水平均低于对照组,CD8+、CD4+CD25+Treg水平均高于对照组,差异均有统计学意义(均P<0.05);重症组患儿CD4+、CD4+/CD8+水平均低于轻症组,CD8+、CD4+CD25+Treg水平均高于轻症组,差异均有统计学意义(均P<0.05),见表3。
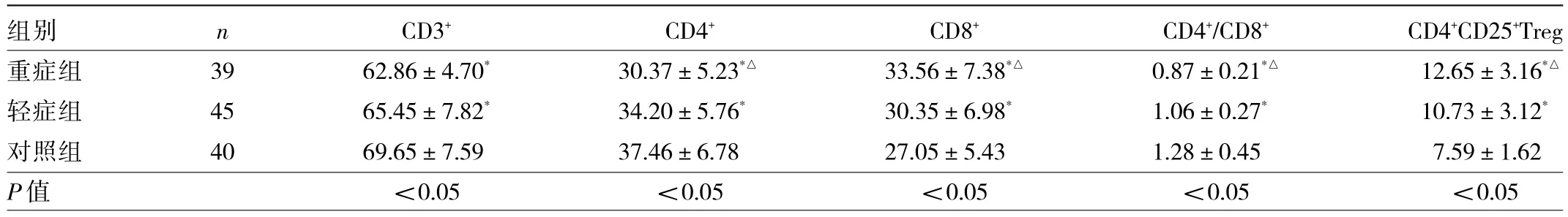
表3 3组儿童外周血T淋巴细胞水平比较(%)
2.4 3组儿童TLR4/NF-κB信号通路相关蛋白表达水平比较 重症组和轻症组患儿TLR4、MyD88、p-NF-κB p65、p-IκB-α水平均高于对照组,差异均有统计学意义(均P<0.05);重症组患儿TLR4、MyD88、p-NF-κB p65、p-IκB-α水平均高于轻症组,差异均有统计学意义(均P<0.05),见图1和表4。
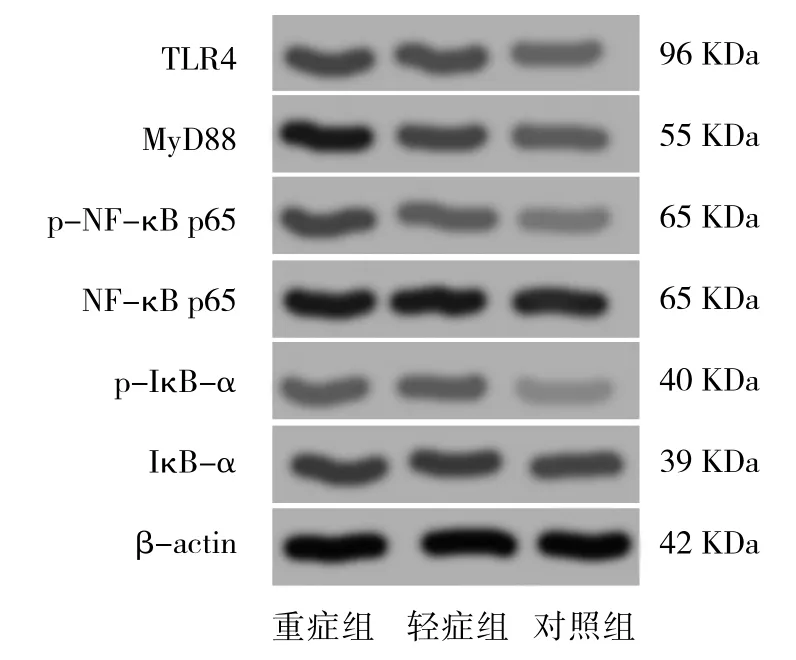
图1 3组儿童TLR4/NF-κB信号通路相关调控蛋白表达的电泳图

表4 3组儿童TLR4/NF-κB信号通路相关蛋白表达水平比较
2.5 MP肺炎患儿TLR4/NF-κB信号通路相关蛋白与炎症因子、T淋巴细胞的相关性分析 Pearson相关分析显示,TLR4/NF-κB信号通路相关蛋白TLR4、MyD88、p-NF-κB p65、p-IκB-α表达水平分别与WBC、hs-CRP、IL-6、TNF-α、CD4+CD25+Treg均呈正相关(均P<0.01),与CD4+/CD8+均呈负相关(均P<0.01),见表5。
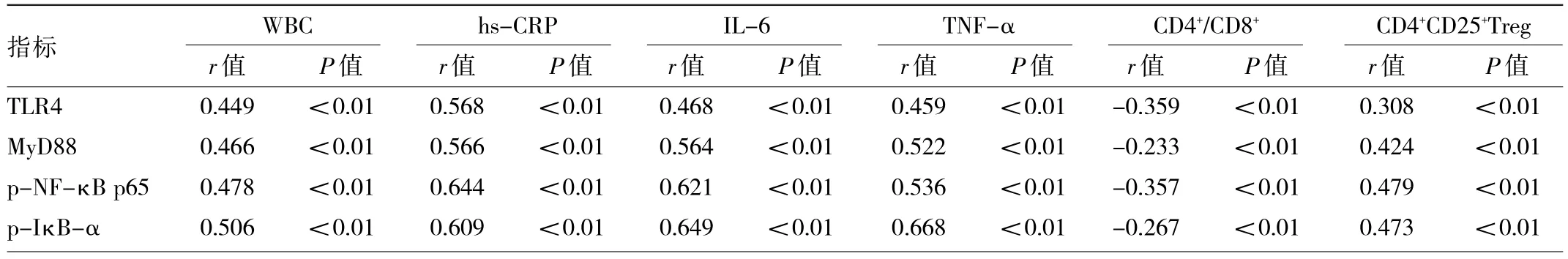
表5 TLR4/NF-κB信号通路相关蛋白与炎症因子、T淋巴细胞的相关性分析
3 讨论
MP是儿童社区获得性呼吸道感染的重要病原体之一,广泛存在于自然界中[11]。近年来,MP感染的发病率逐年上升,发病年龄提前,肺外并发症增多[12]。重症MP感染除呼吸道症状外,常伴有肺外多系统功能障碍,如血液系统、循环系统、神经系统等,如不能及时有效地治疗,不仅会影响生长发育,严重时还会威胁患儿生命[13]。MP感染的发病机制尚未完全清楚,目前认为MP感染机体后引起促炎细胞因子过度释放,产生过强的组织损伤,导致免疫功能失衡[14]。
IL-6是一种趋化因子,在介导T细胞活化、增殖及炎症反应中起重要作用[15]。TNF-α是一种促炎因子,诱导中性粒细胞的趋化和局部浸润,吞噬和杀伤病原体,引发炎症反应[16]。WBC是临床上用于检测是否细菌感染的传统指标[17]。hs-CRP是一种β球蛋白,通过结合病原菌细胞壁的磷酸胆碱或炎症损伤细胞暴露的磷脂等启动免疫应答[18]。本研究发现,重症组和轻症组患儿WBC、hs-CRP、IL-6、TNF-α水平均高于对照组,重症组患儿上述指标均高于轻症组,提示MP感染促进机体炎症因子大量释放,且表达水平与病情的严重程度相关。既往研究已证实,MP的膜蛋白能直接附着于气道上皮细胞,破坏上皮细胞功能,刺激气道黏膜,分泌hs-CRP、IL-6及TNF-α等炎症因子,引发全身炎症反应,促进疾病的发生、发展[19]。
Ig是免疫细胞受到病原微生物刺激,由浆细胞合成与分泌,能够同抗原产生特异性结合的球蛋白[20]。IgG是抗感染的主要抗体,是针对某种病原(如支原体、病毒等)产生的特异性抗体。IgM是初次体液免疫应答早期阶段的Ig,在感染早期发挥重要作用。而IgA主要在黏膜局部发挥免疫保护作用,能抑制病原微生物在呼吸道上皮附着,是防止病原体入侵的第一道防线[21-22]。本研究结果显示重症组和轻症组患儿IgA水平均低于对照组,且重症组IgA水平低于轻症组,IgM水平高于轻症组;而重症组和轻症组与对照组血清IgG水平比较差异无统计学意义。MP感染后对IgM、IgA的表达有抑制,且随感染的加重抑制作用越明显,但对IgG水平影响不明显,说明其抑制作用主要发生于感染早期。
T淋巴细胞是免疫系统中功能最大的细胞群,当血清中T淋巴细胞亚群数量或占比发生异常,会引起免疫平衡的紊乱[23]。CD3+细胞属于成熟的T淋巴细胞,代表机体细胞免疫功能的整体状态[24]。CD4+、CD8+T淋巴细胞是免疫系统的中心,其比值反映免疫状态,降低提示细胞免疫功能抑制[25]。CD4+CD25+Treg细胞是近年来发现的,具有抑制免疫调节功能的一组细胞亚群[26]。已有研究显示,CD4+CD25+Treg细胞可以抑制由细菌、支原体、病毒等病原感染后激发的免疫反应,并通过多种途径影响免疫状态,抑制淋巴细胞的活化和增殖[27]。本研究中,重症组和轻症组患儿CD3+、CD4+、CD4+/CD8+水平均低于对照组,CD8+、CD4+CD25+Treg水平均高于对照组,且重症组患儿CD4+、CD4+/CD8+水平均低于轻症组,CD8+、CD4+CD25+Treg水平均高于轻症组,提示感染越重对细胞免疫抑制越明显,与申秋燕等[28]研究结果相一致。
TLR4/NF-κB信号通路是人体炎症与免疫应答的重要组成部分,在多种疾病进展中发挥重要作用[29]。TLR4是机体识别病原微生物的关键受体,可以激活下游MyD88依赖性通路,MyD88介导的TLR4/NF-κB信号通路激活IKK,活化的IKK会泛素化、磷酸化并降解IκB-α,使得NF-κB p65与相应的炎症基因结合,启动炎性因子转录,诱发炎症和免疫应答[30]。本研究结果显示,重症组和轻症组患儿TLR4/NF-κB信号通路相关蛋白水平均高于对照组,表达水平随着疾病的严重程度增加而升高。TLR4/NF-κB信号通路相关蛋白表达分别与WBC、hs-CRP、IL-6、TNF-α、CD4+CD25+Treg呈正相关,与CD4+/CD8+呈负相关。说明MP感染可以激活TLR4/NF-κB信号通路,诱导大量炎症因子释放,引起免疫功能紊乱,加重肺组织损伤。
综上所述,MP感染会激活机体TLR4/NF-κB信号通路,介导炎症反应,引起Ig和淋巴细胞亚群水平发生异常,从而促进疾病的进展。因此,临床上MP肺炎可以通过评估炎症因子、Ig和淋巴细胞亚群水平判断病情的严重程度。
