核因子κB受体活化因子配体和肿瘤坏死因子α经炎性牙周膜干细胞外泌体促进破骨细胞分化
2022-08-09戴振宁郑蔚晗利时雨
戴振宁 郑蔚晗 利时雨,
1.广东省第二中医院口腔科,广州 510095;2.南方医科大学第三附属医院,广东省医学3D打印应用转化创新平台,广州510630
慢性牙周炎(chronic periodontitis,CP)是常见的口腔疾病,通常由牙菌斑生物膜作为始动因子,造成牙周组织的破坏,牙周炎晚期牙齿周围软组织和骨组织严重破坏吸收,引起牙齿的松动和脱落[1]。在生理状态下,由成骨细胞介导的骨基质分泌,与由破骨细胞介导的骨基质分解,往往处于动态平衡;而在病理性骨吸收状态下,主要表现为破骨细胞的过度激活[2-3]。以往研究[4-6]显示,在细菌引起的炎性环境中,牙周组织细胞和免疫细胞对炎性因子产生应答,如M1型巨噬细胞加速牙周炎病程,CD4+T 细胞通过分泌白细胞介素(interleukin,IL)-2、肿瘤坏死因子α(tumor ne‐crosis factor-α,TNF-α)激活破骨细胞导致牙槽骨吸收,B 淋巴细胞通过分泌核因子κB 受体活化因子配体(receptor activator of nuclear factor-κB li‐gand,RANKL)诱导破骨细胞进行骨吸收等。然而,对于牙周组织中的牙周膜干细胞(periodontal ligament stem cells,PDLSCs)在CP 的病理性骨吸收中扮演何种角色,目前缺乏相关研究。
干细胞可通过旁分泌机制调控细胞本身和周围细胞的生物学功能,外泌体(exosomes,Exo)是干细胞进行细胞间通讯、信号转导的重要媒介[7]。Exo是一种由细胞分泌的微小的细胞外囊泡,粒径通常在30~150 nm,其中含有丰富的蛋白、核酸、脂质等物质[8]。在不同的生理、病理环境下,Exo中的成分会随来源细胞蛋白、核酸表达谱改变而发生同步变化[9]。因此,CP 病程中,炎性牙周膜干细胞(PDLSCs-CP)可能经其分泌的Exo,实现抑制骨形成或促进骨吸收的功能。
本研究提取了健康牙周膜组织、炎性牙周膜组织中PDLSCs 的Exo,通过对Exo 蛋白组分的分析,初步研究PDLSCs-CP 中Exo 对RAW264.7 破骨细胞分化的影响,为CP 的病理性骨吸收发展机制提供新的视角。
1 材料和方法
1.1 细胞株、试剂、仪器
1.1.1 细胞株 细胞原代提取已获患者知情同意,本研究实验已通过医院伦理委员会审核批准。正常表型PDLSCs(PDLSCs-WT)来源于3例正畸治疗前拔除的健康牙的牙周膜组织,病例纳入标准:牙周健康、因正畸需要拔牙。PDLSCs-CP来源于3例CP 拔牙患者的炎性牙周膜组织,病例纳入标准:重度牙周炎、患牙Ⅲ度松动、牙槽骨吸收至根1/3、牙周袋>5 mm、有反复发作的牙周溢脓、肿痛史。RAW264.7细胞株为实验室保藏。
1.1.2 主要试剂 无Exo 胎牛血清(EXO-FBS-50A-1,SBI 公司,美国),DMEM 培养基(1196-5092)、双抗(15140122)、0.25% 胰蛋白酶(25200072)、杜氏磷酸盐缓冲液(Dulbecco’s phosphate buffered saline,DPBS)(14190144)、Ⅰ型胶原酶(171018029)(Gibco 公司,美国),蛋白浓度检测(bicinchoninic acid assay,BCA)试剂盒(23227,Thermo 公司,美国),抗体:CD63(ab134045)、Alix(ab-275377)、CD9(ab2366-30)、CD44(ab243894)、CD45(ab40763)、CD-105(ab2529)、肿瘤坏死因子受体相关因子2(TNF receptor associated factor 2,TRAF2)(ab-126758)、kappa B 抑制因子激酶β(inhibitor of kappa B kinase beta,IKKβ)(ab1249-57)、核转录因子κB(nuclear transcription factor κB,NF-κB)-p65(ab16502)、整合素β3(Integrin β3)(ab17-9473)、Goat anti-Rabbit IgG H&L(HRP)(Abcam公司,英国);TNF-α 酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒(DG-12110H,北京Dogesce 公司),RAN-KL ELISA 试剂盒(EK5377)、IL-1α ELISA 试剂盒(EK-8147)、骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)ELISA 试剂盒(EK5130)(SAB 公司,美国),转化生长因子β1(transforming growth factor β1,TGF-β1)ELISA试剂盒(H0287,上海信裕生物科技有限公司),RANKL蛋白、巨噬细胞集落刺激因子(macrophage colony-stimulating factor,MCSF)(苏州Novoprotein 公司),总RNA 提取试剂盒(Axygen公司,美国),逆转录试剂盒(TaKaRa公司,日本),实时荧光定量聚合酶链反应(real time quantitative polymerase chain reaction,RTqPCR)试剂盒(Roche 公司,瑞士),抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(上海贝博生物科技有限公司)。
1.1.3 主要设备 流式细胞仪(FACSAria Ⅲ,BD公司,美国),多功能高效离心机、智能超高速离心机(Beckman Coulter公司,美国),低速冷冻离心机(Sigma-Aldrich 公司,美国),Nano Sight 纳米粒径仪(Malvern 公司,英国),倒置激光共聚焦显微镜(Zeiss 公司,德国),凝胶成像系统(Bio-Rad 公司,美国),荧光聚合酶链反应(poly‐merase chain reaction,PCR)仪(ABI公司,美国),多功能酶标仪(BioTek 公司,美国),超高效液相色谱系统、蛋白质谱仪(Thermo公司,美国)。
1.2 方法
1.2.1 原代提取及细胞培养 刮下根中1/3 牙周膜组织,用含1%双抗、3%庆大霉素的DPBS溶液洗涤1 min。将牙周膜组织加入含3 g·L−1Ⅰ型胶原酶的DPBS 中,于37 ℃水浴中消化1 h。消化后过70 μm 滤膜过滤获得分散均匀的细胞,100g离心5 min后,用完全培养基(含10%无Exo血清、1%双抗的DMEM 培养基)重悬沉淀,调整细胞密度为每毫升1×104个,接种于T25 细胞培养瓶中,置于37 ℃、5%CO2细胞培养箱。1 d后全换液去除未贴壁细胞,后续2~3 d 全换液1 次,于细胞密度达80%时进行传代。
1.2.2 流式细胞检测 分别将1 名正畸患者和1 名CP患者的第2代PDLSCs-WT和PDLSCs-CP去掉培养液,用0.25%的胰蛋白酶消化1 min,用PBS洗涤后制成每毫升含有1×106个细胞的单细胞悬液。分入4 组试管,每管20 μL,分别检测CD44、CD45、CD105,滴加10 μL 一抗,冰上放置30 min。每管加入100 μL PBS重悬细胞,每管加入二抗4 μL,室温下避光反应30 min,PBS 洗涤3 次,上机进行流式细胞仪观察和检测,每次计数10 000个细胞。
1.2.3 差速离心法提取Exo 分别将2 名正畸患者和2 名CP 患者 的PDLSCs-WT 和PDLSCs-CP 细 胞分别接种至10 个T75 细胞培养瓶中,当细胞生长约80%融合,用PBS 洗涤2 次,每次1 min。用含10%无Exo 血清、1%双抗的完全培养基进行全换液,每瓶加入培养基50 mL。3 d 后收集细胞培养液(共500 mL)用作Exo 提取:4 ℃条件下,依次离心300g10 min,2 000g10 min,10 000g30 min,每次离心后取上清继续离心。继续4 ℃100 000g离心70 min,弃上清,每支离心管用2 mL DPBS 重悬沉淀。进而100 000g离心70 min,弃上清,每支离心管用200 μL DPBS重悬沉淀。用0.22 μm 孔径滤网过滤除菌,用EP 管分装置于−80 ℃保藏用于后续实验,取用时避免反复冻融。PDLSCs-WT 和PDLSCs-CP 细 胞的Exo 分别记为Exo-WT、Exo-CP。
1.2.4 Exo 鉴定 1)Western blot 检测Exo 标志物:Western blot 根据常规方法依次对细胞和Exo 的蛋白样品进行BCA 蛋白浓度测定、配制15%的分离胶和5%的浓缩胶、上样、电泳、转模、孵育一抗、孵育HRP 标记二抗、电化学发光(electroche‐miluminescence,ECL)检测。2)纳米粒径检测:将1 mL外泌体样品缓慢注入Nanosight纳米粒径仪样品池中,将温度计探头放入激光模块的铜孔内,调整焦距后,在标准操作程序中选择对样品进行粒径观测和计算。3)透射电子显微镜(transmis‐sion electron microscope,TEM)检测:将10 μL 外泌体样品滴加在铜网上,静置3 min,用无尘纸吸去浮液。在铜网上滴加10 μL 磷钨酸,静置1 min,无尘纸吸去浮液。室温干燥5 min,使用TEM 进行成像,操作电压为90~120 kV。
1.2.5 Exo蛋白质谱检测 通过常规步骤对Exo-WT和Exo-CP进行BCA 浓度测定、烷基化、酶解。酶解后肽段用液相色谱流动相A 溶解后使用EASYnLC 1200 超高效液相系统进行分离。流动相A 为含0.1%甲酸和2%乙腈的水溶液;流动相B 为含0.1%甲酸和90%乙腈的水溶液。液相梯度设置:0~96 min,4%~19%B;96~115 min,19%~32%B;115~118 min,32%~80%B;118~120 min,80%B,流速维持在500.00 nL·min−1。肽段经由超高效液相系统分离后被注入NSI 离子源中进行电离然后进Exploris 480质谱分析。所得二级质谱数据使用PD 2.4进行检索,将半胱氨酸烷基化Carbamidomethyl(C)设置为固定修饰,可变修饰为[‘Acetyl(Protein N-term)’,‘Oxidation(M)’,‘Deamidation(NQ)’]。
1.2.6 ELISA 检测 将Exo-WT、Exo-CP 稀释为1 mg·mL−1,采用TNF-α、RANKL、IL-1α、TGFβ1、BMP-2 的ELISA 试剂盒进行检测:根据试剂盒说明配置梯度浓度的标准样品和工作液,Exo与工作液反应后于酶标仪中检测光密度(optical den‐sity,OD)值。于Origin 8 软件中生成标准样品曲线,根据样品OD值计算蛋白浓度。
1.2.7 RT-qPCR检测 将RAW264.7以细胞密度为每毫升1×105个接种于12孔板中,待细胞生长约80%融合,分别给予5 种条件进行培养:完全培养基、无血清培养基(分别含10、100、1 000 μg·mL−1Exo-WT 或Exo-CP)、无血清培养基(含50 ng·mL−1RANKL 和25 ng·mL−1M-CSF)于5 d 时间点进行逆转录聚合酶链式反应(reverse transcription-poly‐merase chain reaction,RT-PCR)检测破骨分化相关基因TRAP、人组织蛋白酶K(cathepsin-K,Cath-K)、降钙素受体(caltitonin receptor,CTR)表达水平:将12 孔板中的培养基去除,用DPBS 洗涤2 次,每次3 min。用细胞刮转移RAW264.7 细胞至EP 管中,液氮冷冻后将样品磨碎成粉末,用总RNA 提取试剂盒提取RNA,使用逆转录试剂盒进行cDNA合成。逆转录完成后加入引物,引物序列如下。TRAP 上游引物序列:CTGGAGTGCAC‐GATGCCA,下游引物序列:TCCGTGCTCGGC‐GATGGA;Cath-K 上游引物序列:ATGTCTGTC‐TAAGTTTCTG,下游引物序列:CGCTCCTGG‐TATGGGCAGA;CTR 上游引物序列:CGACTATCCACTGCTACCG,下游引物序列:GTTGCTGATTGGAGGATTC;磷酸甘油醛脱氢酶(glyceralde‐hyde phosphate dehydrogenase,GAPDH)上游引物序列:ACCCAGAAGTGTGGATCC,下游引物序列:CACATTGGGGGTAGGAACAC。于RT-qPCR分析仪中,利用2−ΔΔCT法计算相关基因的表达。
1.2.8 Western blot检测 根据1.2.7分组,对TRAF-2、IKKβ、NF-κB-p65、Integrin β3 蛋白表达水平进行检测,方法如1.2.4(1)。
1.2.9 TRAP 染色 根据1.2.7 分组,采用试剂盒固定RAW264.7细胞5 min,蒸馏水洗涤2次。室温避光染色1 h,蒸馏水洗涤2次,镜检。采用ImageJ软件计算除破骨细胞外其余RAW264.7细胞的长度。
1.3 统计学分析
采用SPSS 24.0 软件对实验数据进行统计学分析,实验数据均以平均数±标准误表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 PDLSCs细胞及其Exo的鉴定
通过流式细胞术对正畸前患者PDLSCs-WT 细胞和CP患者PDLSCs-CP细胞的表面标记物进行检测,结果见图1A。PDLSCs-WT 和PDLSCs-CP 均高表达间充质干细胞表面标记物CD44、CD105;几乎不表达造血干细胞表面标记物CD45,符合PDLSCs的表面标记物特征。
通过差速离心法从PDLSCs-WT和PDLSCs-CP培养液中提取Exo,分别记为Exo-WT 和Exo-CP,Exo 样品和细胞蛋白样品经过Western blot 免疫印迹检测,结果见图1B。Exo-WT 和Exo-CP 都显著表达Exo 特征性标志物Alix、CD63、CD9,几乎不表达细胞内参蛋白β-actin;在相同浓度的蛋白样品中,细胞样品的Alix、CD63、CD9 表达水平较低。TEM 结果见图1C,2 种PDL-SCs 来源的Exo均为典型的“杯口状”囊泡。经BCA 法检测Exo-WT 和Exo-CP 的蛋白浓度,结果见图1D,从细胞培养液中差速离心提取的Exo,经过重悬样品体积和原细胞培养液体积的换算,每毫升细胞培养液中可分离获得的Exo 分别为26.45 μg±2.36 μg 和26.92 μg±5.74 μg,二者差异无统计学意义。通过纳米粒径追踪分析检测Exo的粒径尺寸,结果见图1E,Exo-WT和Exo-CP的粒径分布主要集中在30~150 nm范围内,少量囊泡的粒径可达200 nm。
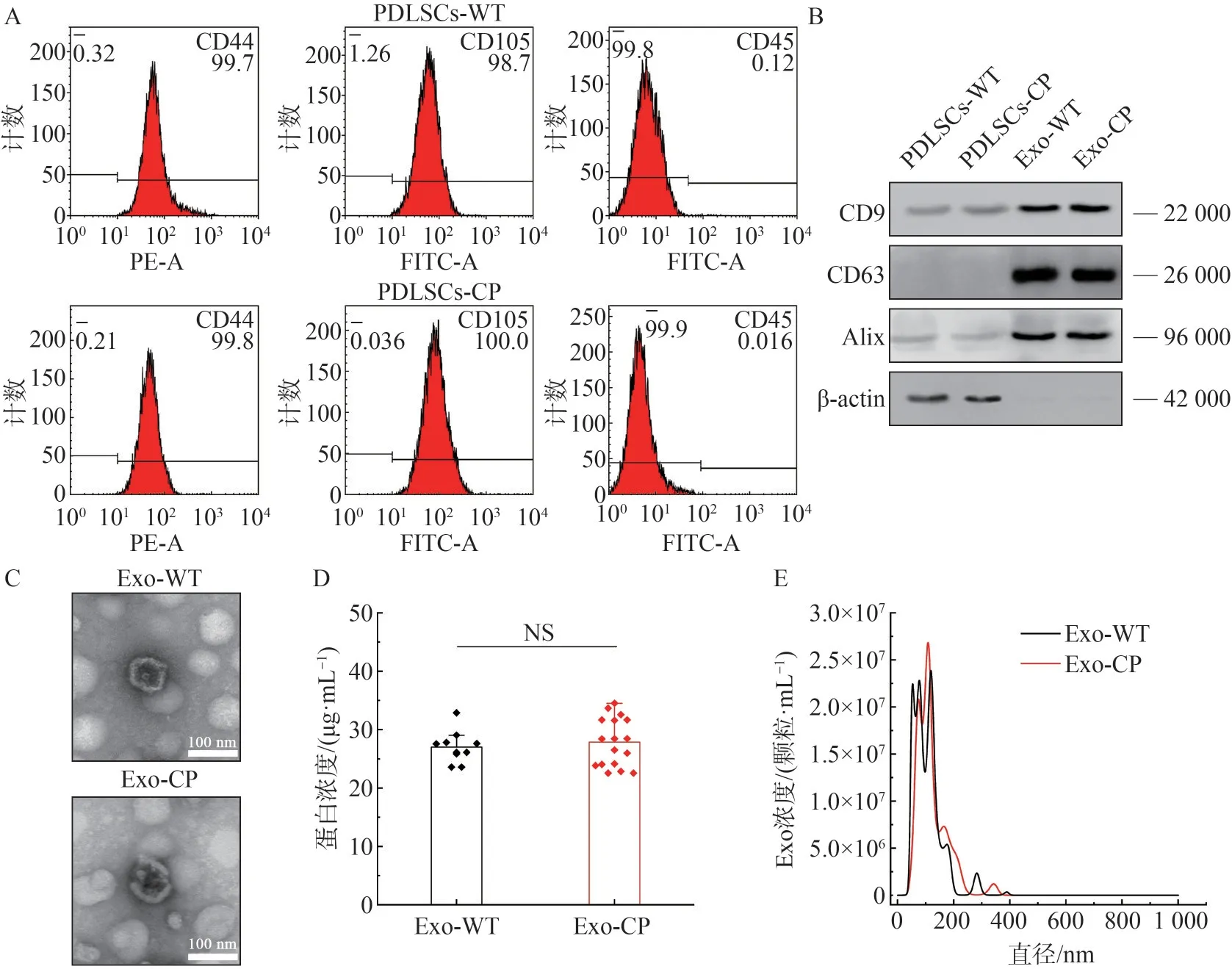
图1 PDLSCs细胞及其Exo鉴定结果Fig 1 Characterization of PDLSCs and Exo
2.2 Exo的蛋白组分分析
蛋白质谱共检测到378个蛋白,可定量的蛋白有246 个。蛋白质亚细胞结构分布结果见图2A。Exo-WT 与Exo-CP 所鉴定到的蛋白主要富集于细胞外、细胞质、细胞膜、内质网等,符合Exo蛋白分布特征。在这些可定量蛋白中Exo-WT/Exo-CP共筛选出33 个差异表达的蛋白,其中20 个表达下调,13 个表达上调。下调水平显著的蛋白包括TNFSF11、TNFSF2、IL1A、GLUT1、ODRF、OSCAR、MMP9、C3、MMP14;上调显著的蛋白包括TGFB1、TGFBR2、TGFBR3、BMP2B1、FG‐FR2、CCL4等(图2B)。
2.3 蛋白功能注释富集分析
根据基因本体(gene ontology,GO)富集分析,分别描述Exo-CP/Exo-WT 中差异蛋白的生物过程、细胞组分、分子功能分类,结果见图2C。差异蛋白的分子功能主要与骨吸收,细胞组分组织或合成和吞噬作用有关;差异表达蛋白所处的亚细胞定位主要集中在细胞质、细胞外空间和细胞膜;差异表达蛋白参与的生物过程主要与趋化因子活性,连接和催化活性有关。
利用KEGG 通路富集分析对Exo-WT/Exo-CP中差异蛋白涉及的信号通路予以描述,结果见图2D。主要涉及的信号通路包括TNF 信号通路、破骨细胞分化通路、NF-κB信号通路等。
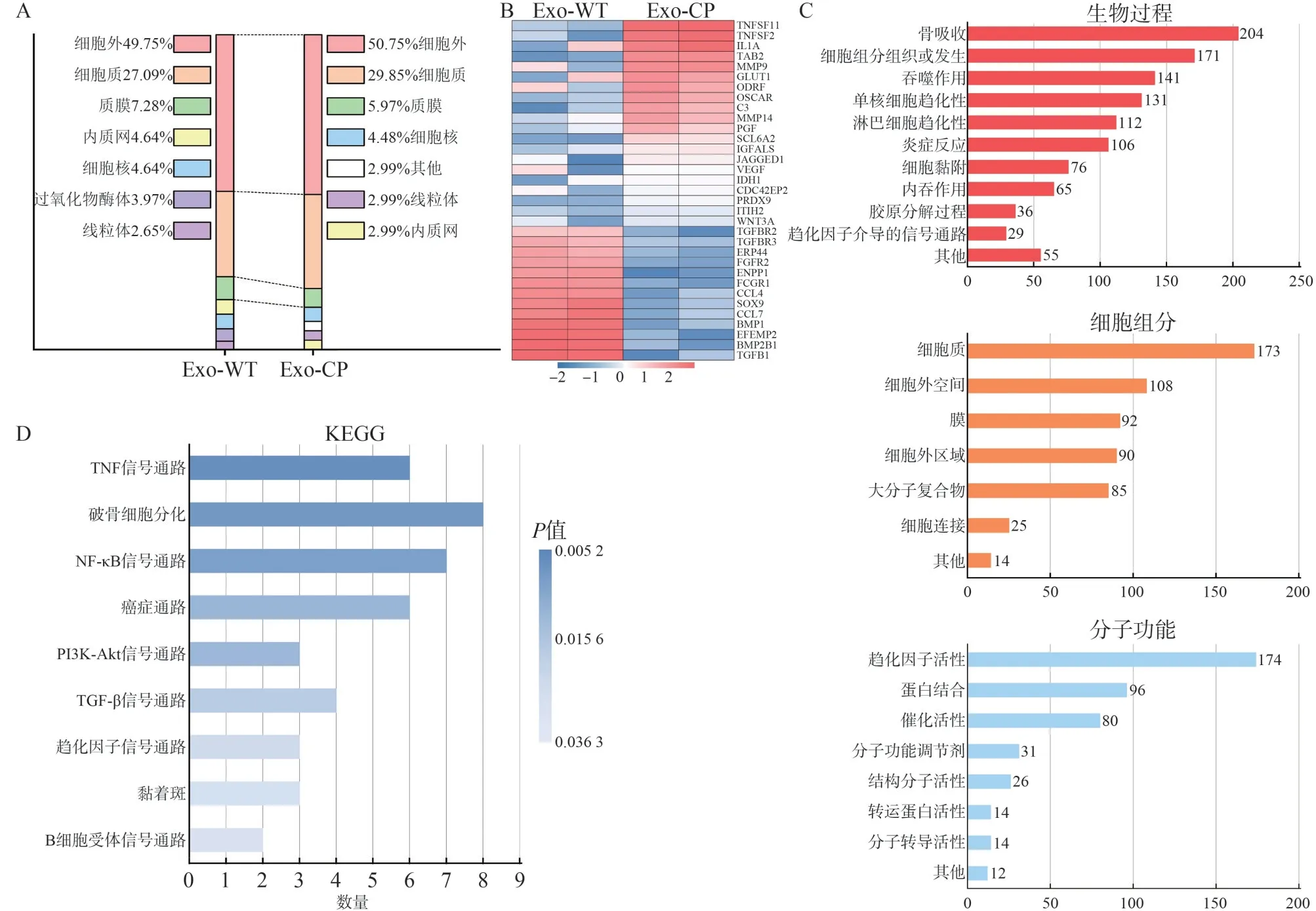
图2 Exo蛋白质谱分析Fig 2 Analysis of Exo protein profile
2.4 ELISA检测
利用ELISA 试剂盒对Exo-CP 和Exo-WT 所含TNF 信号通路相关细胞因子进行定量分析,结果见表1。相对于Exo-WT 组,Exo-CP 组TNF-α、RANKL、IL-1α水平均升高,差异有统计意义(P<0.05);而TGF-β1、BMP-2 水平均降低,差异均具有统计学意义(P<0.05)。
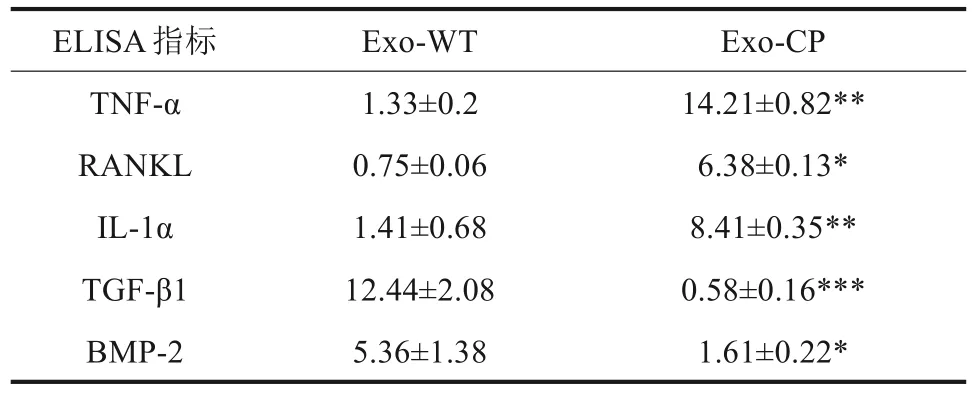
表1 外泌体细胞因子ELISA检测结果Tab 1 ELISA of exosomal cytokines ng·mL−1
2.5 不同浓度Exo-WT 和Exo-CP 对RAW264.7 破骨细胞分化的影响
利用RT-qPCR 检测各处理组破骨细胞分化相关基因的表达水平,结果见图3A。不同浓度Exo-WT 处理组的TRAP、Cath-K、CTR 基因表达水平基本与Control组保持一致。不同浓度Exo-CP处理组的TRAP、Cath-K 和CTR 基因的相对表达均上调,和Control 组间差异具有统计学意义(P<0.05),其 中100、1 000 μg·mL−1浓 度Exo 组 和RANKL+M-CSF 阳性对照组间差异无统计学意义(P>0.05),与10 μg·mL-1Exo 组差异有统计学意义(P<0.05)。
Western blot 检测破骨细胞分化相关蛋白的表达水平,结果见图3B。实验检测了RANKL、TNFα 的下游蛋白TRAF2,以及NF-κB 信 号通路的IKKβ、NF-κB-p65,破骨细胞特异表达蛋白Integ‐rin β3。在Exo-WT 组中,破骨细胞分化相关蛋白的表达水平基本与Control 组一致,TRAF2 和Inte‐grin β3 表达水平较低,IKKβ、NF-κB-p65 有检测蛋白表达且与Exo-WT外泌体浓度呈正相关,但显著低于Exo-CP组各浓度。在Exo-CP组中,上述破骨细胞分化相关蛋白的表达水平均呈阳性表达,与Exo-CP 外泌体浓度呈正相关,且1 000 μg·mL−1Exo-CP与RANKL+M-CSF组表达水平一致。
TRAP 染色后,胞质呈紫红色。各浓度Exo-CP 组和RANKL+M-CSF 组可见边界清晰、胞体巨大、胞浆量丰富、圆形、多核的破骨细胞。镜下视野中Control 组和Exo-WT 组的破骨细胞数量明显少于Exo-CP组和RANKL+M-CSF组(图3C)。
对TRAP 染色结果中未分化为破骨细胞的RAW264.7 细胞长度进行测量统计,结果见图3D。可见随外泌体浓度提高,RAW264.7 的细胞伪足扩张,细胞长度提高,由圆形转变为多角形,该现象在Exo-WT 组尤为明显。而对照组Control 组和RANKL+M-CSF组,细胞多呈圆形。
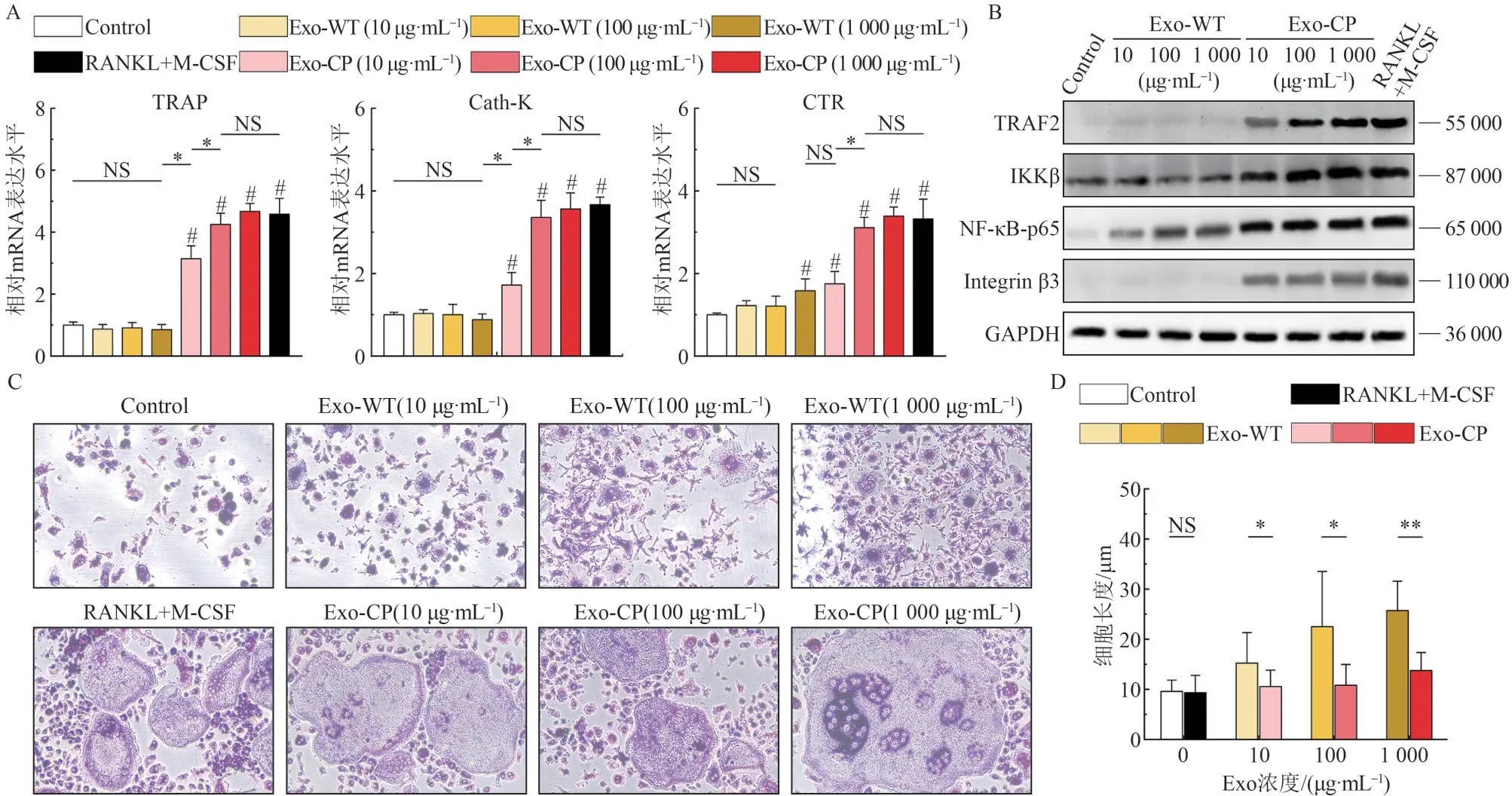
图3 RAW264.7细胞的破骨细胞分化检测Fig 3 Osteoclast differentiation detection of RAW264.7 cells
3 讨论
CP 是由牙菌斑生物膜的细菌及其产物为始动因子引起的牙周组织慢性炎症,牙周组织长期炎性浸润导致其力学缓冲、稳固支持的生理功能丧失,造成牙齿松动、牙槽骨吸收等病症。本研究关注的PDLSCs 来源于牙周膜,大量研究[10-11]表示利用酶消化法从牙周膜组织中分离的PDLSCs 细胞,表达CD44、CD105 等基质细胞、内皮细胞表面标记物,与本研究通过流式细胞术检测的表型一致。以往研究[12]证实了PDLSCs 的多向分化潜能,主要是成骨、成脂分化能力,也有研究[13]发现其具有向骨骼肌和神经节样细胞分化的潜能。本研究关注的牙槽骨吸收病理症状,涉及破骨细胞调控骨代谢、破骨细胞分化的相关功能,破骨细胞主要分化自单核巨噬细胞相互融合形成的多核巨细胞,不属于PDLSCs的终末分化方向,但在CP 环境下PDLSCs 的Exo 是否调控破骨细胞的分化、募集、激活,尚无相关研究。
Exo是细胞分泌的微小囊泡,最初被发现时被认为是细胞代谢排出的废物,后证实其中含有丰富的核酸、蛋白等成分,是介导细胞间通讯的重要媒介。目前的研究中发现不同细胞、不同环境下细胞所分泌的Exo功能有所差异,如肿瘤细胞分泌的Exo 可能介导肿瘤血管新生、肿瘤细胞迁移等[14]。而间充质干细胞分泌的Exo含有丰富的旁分泌因子,可介导旁分泌作用对干细胞进行激活和募集[15]。本研究通过常用的差速离心方法提取Exo,通过不同离心力依次离心去除培养液中的细胞、死细胞、细胞碎片、杂质蛋白等物质,最终收获Exo。经实验鉴定,本研究提取的Exo 高表达CD9、CD63 膜蛋白,以及Alix 外泌体内容物蛋白,其微观形态呈“杯口状”囊泡,粒径主要分布在30~150 nm范围内,符合外泌体的特征。值得注意的是,本研究采用了健康牙周组织的PDLSCs-WT和炎症牙周组织的PDLSCs-CP进行对照研究,以往研究[16]提出,细胞在缺氧、炎症等[17]条件下可能促进Exo分泌行为,但本研究通过蛋白浓度对Exo 进行定量并未发现Exo 分泌水平的差异。
目前有关PDLSCs Exo 的研究表明,在成骨诱导培养条件下,PDSLCs Exo 的miRNA 表达谱发生变化[18],可发挥与间充质干细胞Exo相似的组织修复功能,促进骨组织再生[19]。并且对于PDLSCs在成骨分化总circRNA 和lncRNA 的表达谱变化也有报道,明确了PDLSCs Exo 对成骨分化的促进作用[20]。而对于Exo-CP 的研究则报道了其促血管化和改善炎症微环境的作用:Liu等[18]发现Exo-CP中血管内皮生长因子表达水平上调,miR-17-5p 下调,对人脐静脉内皮细胞成管和牙周韧带的血管化具有促进作用。研究[21]构建了脂多糖刺激的PDLSCs-CP 模型,其外泌体含有miR-155-5p,通过靶向炎性PDLSCs 的SIRT1 来调节Th17/Treg 平衡以改善炎性微环境。上述研究多围绕Exo RNA成分的表达水平和功能,而本研究主要关注Exo-CP 的蛋白组分,并率先发现了其中破骨细胞分化相关蛋白的高表达。
在蛋白质谱的分析结果中,Exo-WT、Exo-CP的蛋白成分亚细胞定位主要为细胞外成分和细胞质成分,Exo-CP 高表达的TNFSF11、TNFSF2 即RANKL 和TNF-α,前者通过RANKL-RANK 信号途径[22],后者通过TNF-α-TNFR1 信号途径,二者皆可介导NF-κB 通路活化以促进炎症反应[23],以往研究[24]报道TNFSF11 由成骨细胞、破骨细胞前体细胞、活化T 细胞表达,与PDLSCs 表型一致。此外,鉴定的Exo-CP 高表达蛋白IL-1α、OSCAR、MMP9、MMP14 对于破骨细胞分化、破骨细胞存活、骨吸收活性具有密切影响。反之,Exo-CP 低表达而Exo-WT 高表达的TGF-β、FGF、BMP 等细胞因子,对骨形成和成骨分化起促进作用,反映出PDLSCs 和间充质干细胞的Exo 可能起到相似的促组织再生作用。生物信息学富集的差异表达蛋白富集的TNF 信号通路、破骨细胞分化信号通路、NF-κB 信号通路证实了PDLSCs-CP Exo 富含促进破骨细胞分化的细胞因子。根据蛋白质谱鉴定结果,对表达差异较大且功能作用突出的5种细胞因子TNF-α、RANKL、IL-1α、TGF-β1、BMP-2 进行了ELISA 验证,定量的细胞因子浓度与蛋白质谱鉴定的表达水平相吻合。
为验证Exo-CP 对破骨细胞分化的促进作用,本研究将不同浓度的Exo-WT 和Exo-CP 加入RAW264.7 进行共培养,通过RT-qPCR、Western blot、TRAP 染色实验证实了经过Exo-CP 作用,有效促进RAW264.7细胞的破骨细胞分化。由于难以对体内环境中PDLSC分泌外泌体的水平进行测定,本研究采用由低到高10、100、1 000 μg·mL−1的外泌体浓度进行诱导,Exo-CP 低浓度诱导即与Con‐trol 组产生了统计学差异,而中、高浓度组和RANKL+M-CSF 阳性对照组对破骨分化基因表达水平的上调作用差异无统计学意义。对破骨细胞分化相关通路的蛋白水平检测中,检测到TNF 信号通路的TNF-α 受体相关因子TRAF2,NF-κB 信号通路的IKKβ、NF-κB-p65,以及破骨细胞特异性膜蛋白Integrin β3,在Exo-CP 诱导下蛋白表达水平上升,这与蛋白质谱分析的富集信号通路是一致的。此外,TRAP 染色结果观察到Exo 浓度对RAW264.7 细胞形态产生影响,高浓度Exo 处理后细胞伪足扩张,根据以往研究,分析该现象可能是RAW264.7 细胞对Exo 的内化伴随着吞噬行为[25],进而因吞噬抗原而刺激活化,促使细胞分化出伪足[26]。而Exo-WT 较Exo-CT 更加促进细胞伪足伸长,可能和Exo膜蛋白以及Exo蛋白成分相关,其具体原因有待深入探索。
本研究尚存在值得进一步深入探索的问题,对于Exo所含成分的分析,本研究主要根据旁分泌途径影响生物学行为的观点出发,关注了Exo的蛋白组分,而对于核酸如mRNA、miRNA、lncRNA等未能一一进行检测。此外,本研究明确了PDLSCs-CP Exo 对破骨细胞分化的促进作用,是导致CP 牙槽骨吸收的病理因素之一,但在体内环境中,因PDLSCs Exo 引起的破骨细胞激活是否主导慢性牙周炎牙槽骨吸收的发生,有待进一步研究。
本研究初步分析了CP 中PDLSCs 细胞Exo 的蛋白组分,及其对RAW264.7 破骨细胞分化的影响。相对于PDLSCs-WT Exo,PDLSCs-CP Exo 富含RANKL和TNF-α,可通过激活TNF和NF-κB 相关信号通路促进破骨细胞分化。本研究为PDLSCs Exo 通过递送RANKL 和TNF-α,促进破骨细胞分化,导致慢性牙周炎的病理性骨吸收,提供了新的视角和思路。
利益冲突声明:作者声明本文无利益冲突。
